lncRNAPCGEM1在早期原发性肝细胞癌外周血中的表达及临床意义
何勇勇,方长英,李 萍,张青松,朱传卫
(1.宣城职业技术学院内科教研室,安徽 宣城 242000;2.宣城市中心医院检验科,安徽 宣城 242000)
肝癌发病率位居世界第6,也是死亡率位居第4的癌症,其中肝细胞癌占所有肝癌病例的75%~85%[1]。肝细胞癌恶性程度较高,早诊断早治疗是提高生存率关键所在,积极寻找有效的血清分子标志物对早期肝癌进行筛查和预后评估是一条重要途径。长链非编码RNA(long noncoding RNA,lncRNA)是一种长度大于200个核苷酸的非编码RNA。研究表明lncRNAs在肝癌的发生和发展中起着重要作用,可以作为分子标志物用于肝癌诊断和预后判断[2-3]。前列腺癌基因表达标记物1(prostate cancer gene expression marker 1,PCGEM1)是最早在前列腺癌中发现有促进细胞增殖功能的lncRNA[4],研究发现PCGRM1可充当某些microRNA(例如miR-145和miR-148a)的竞争性内源RNA,在前列腺细胞中发挥致癌作用[5-6]。本研究探讨PCGEM1在早期原发性肝细胞癌患者外周血中的表达及其对诊断和预后的意义。
1 资料与方法
1.1 研究对象
选取2016年3月—2019年12月在宣城市中心医院普外科接受肝癌切除术治疗的70例原发性肝细胞癌早期患者作为研究对象,其中男性62例,女性8例;年龄31~71岁,平均(49.04±9.26)岁。纳入标准:(1)术前未做任何治疗的初诊患者;(2)2位病理科医生确诊为肝细胞癌。排除标准:患者伴有严重心肺疾病、肝炎、肝硬化、高血压、脑出血、严重糖尿病和其他恶性肿瘤等疾病。另外选择同期体检的70名健康成年志愿者作为对照组,其中男性61例,女性9例;年龄25~68岁,平均(49.40±8.86)岁。肝癌患者和志愿者在身高、体重、性别、年龄和生活方式等一般资料差异无统计学意义(P<0.05)。本研究获得宣城市中心医院伦理委员会批准,所有研究对象均签署知情同意书。
1.2 方法
1.2.1 血液样本采集 在肝癌患者术前3 d和术后6 d采集15 mL血液,在志愿者体检时采集15 mL血液。血液样本采集后即刻5 000 r/min离心5 min,取上清移至无酶EP管中进行RNA提取和cDNA合成。
1.2.2 RNA提取和cDNA合成 取250 μL血清和750 μL TRIzol(Invitrogen公司)加入无酶EP离心管中,混匀后加入氯仿,振荡后冰上静置10 min,12 000 r/min离心10 min,取上清移至无酶EP离心管中,随后加入等量异丙醇冰上放置15 min后12 000 r/min离心,弃去上液,加入1 mL 75%乙醇,12 000 r/min离心15 min,洗涤后用适量无酶ddH2O溶解RNA,分光光度计测量RNA浓度为670 ng/μL,OD260/280为 1.96。采用 PrimeScriptTMRT reagent kit(Invitrogen公司)将提取的RNA逆转录成cDNA,反应体系为20 μL:1 μL模板RNA,4 μL 5×PrimeScript缓冲液混合物,1 μL PrimeScript RT酶,1 μL oligo dT引物和 13 μL 无 RNase 的ddH2O;反应条件:37℃30 min,85℃5 s,然后4℃孵育60 min,cDNA置-20℃冰箱保存。
1.2.3 qRT-PCR检测外周血中PCGEM1表达 依据GenBank数据库中提供的PCGEM1和内参GAPDH序列,采用Primer Premier 5.0软件设计引物序列并交由上海吉玛生物科技公司合成,PCGEM1上游引物:5′-TGCCTCAGCCTCCCAATA AC-3′,下游引物:5′-GGCCAAAATAAAACCAA ACAT-3′;内参GAPDH上游引物:5′-CAGGAGG CATTGCTGATGAT-3′,下游引物:5′-GAAGGCT GGGGCTCATTT-3′。按照Platinum®SYBR®Green qPCR SuperMix-UDG(Invitrogen公司)说明书使用7500荧光定量PCR仪(ABI公司)对PCGEM1进行扩增;反应体系20 μL,扩增条件:95℃预变性5 min;95℃变性10 s,60℃退火30 s,72℃延伸30 s,共40个循环,实验重复3次。用2-ΔΔCT方法计算早期肝细胞癌患者和健康体检者血液中PCGEM1表达量。
1.3 统计学分析
采用SPSS19.0软件处理实验数据,符合正态分布的计量资料以±s表示,组间比较使用t检验,采用受试者工作特征(receiver operator characteristic,ROC)曲线分析PCGEM1在血液中的表达对肝癌早期诊断和Edmondson-Steiner分级预测的价值,P<0.05为差异有统计学意义。
2 结果
2.1 PCGEM1在早期肝癌患者血清中的表达
肝癌患者术前血清中PCGEM1的表达量高于健康对照组和术后患者(均P<0.001);而肝癌患者术后和健康对照组血清中PCGEM1的表达差异无统计学意义(t=0.079,P=0.937)。见表1。结果表明早期肝癌患者血清中PCGEM1表达量高于健康人群,肝癌切除术后其表达量下降至正常水平。
表1 PCGEM1在各组中的相对表达量 (n=70,±s)

表1 PCGEM1在各组中的相对表达量 (n=70,±s)
1):与对照组相比,P<0.001;2):与肝癌术后组相比,P<0.001。
组别对照组肝癌组(术前)肝癌组(术后)PCGEM1表达量1.880±0.793 3.231±0.9421)2)1.871±0.528
2.2 血清中PCGEM1对早期肝癌的诊断价值
ROC分析结果显示PCGEM1诊断早期肝癌的曲线下面积为0.865(95%CI: 0.802~0.928,P<0.001),最优截断值为2.685,其敏感性和特异性分别为71.4%和91.4%,见图1。
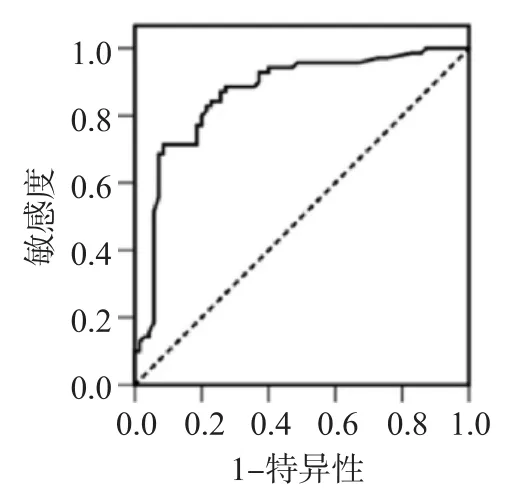
图1 PCGEM1诊断早期肝癌的ROC曲线
2.3 血清中PCGEM1对肝癌细胞分级的预测
ROC分析结果表明PCGEM1预测肝癌细胞Edmondson-Steiner分级的曲线下面积为0.903(95%CI: 0.820~0.985,P<0.001),最优截断值为3.115,其敏感性和特异性为97.4%和77.4%,见图2。

图2 PCGEM1预测肝癌细胞Edmondson-Steiner分级的ROC曲线
2.4 血清中PCGEM1表达与肝癌临床病理特征间的关系
肿瘤直径>5 cm、无肿瘤包膜和Edmondson-Steiner分级差(Ⅲ级和Ⅳ级)的早期肝癌患者的PCGEM1表达量升高,差异均有统计学意义(均P<0.05),见表2。

表2 PCGEM1表达与早期肝癌病理特征的关系
3 讨论
本研究显示早期肝癌患者外周血液中PCGEM1的表达升高且与肿瘤大小、包膜有无和肝细胞癌Edmondson-Steiner分级相关;ROC分析结果显示外周血中PCGEM1的表达用于诊断早期肝癌的敏感性和特异性分别为71.4%和91.4%;血液中PCGEM1相对表达值>3.115的患者肝癌细胞分化差,预示肿瘤恶性度高,其敏感性和特异性为97.4%和77.4%。此外,有研究证实PCGEM1过表达与患者预后密切相关,Zhang等[7]的研究表明宫颈癌患者肿瘤组织中PCGEM1过表达与FIGO晚期、淋巴结转移、远处转移及较差的总体生存率相关,PCGEM1促进宫颈癌细胞增殖、细胞周期进程、迁移和侵袭,同时抑制宫颈癌细胞凋亡。上述研究结果均证实了PCGEM1具有癌基因的特征。近年来,越来越多的证据表明lncRNAs可通过竞争性结合microRNA形成竞争性内源RNA,在细胞生物学功能中发挥重要作用[8],研究显示PCGEM1与miR-182结合形成竞争性内源RNA,上调FBXW11的表达[7],FBXW11属于F-box蛋白家族的FBXW亚家族,可通过调节底物磷酸化和泛素化在各种信号传导途径中起关键作用[9],例如:FBXW11通过激活NF-κB信号通路促进黑素瘤、肠癌和皮肤癌等恶性肿瘤的进展[10-11]。此外,FBXW11可通过激活NF-κB和β-catenin/TCF信号通路诱导淋巴细胞白血病的细胞周期进程和肿瘤形成[12],PCGEM1在肝癌细胞中的作用机制是否与上述信号通路有关还需进一步研究。但可以明确PCGEM1可通过多种途径促进肿瘤细胞增殖、迁移和侵袭,致使患者易出现淋巴结转移和远处脏器转移,从而复发率升高,生存率下降。
本研究发现患者外周血中PCGEM1过表达对肝癌早期诊断具有较好的临床价值。血液样本易获得,lncRNAs检测较为简单,通过检测外周血lncRNA PCGEM1的表达对早期肝癌进行筛查将是一个行之有效的临床方法,但由于其他肿瘤细胞和组织中PCGEM1也呈现高表达状态。因此,应用PCGEM1对肝癌高危人群进行筛查时,表达升高的筛查对象需进一步进行相关的实验室检查(血清甲胎蛋白检查)和影像学检查,以明确是否发生肝细胞癌。综上所述,对于已经确诊的肝细胞癌患者,lncRNA PCGEM1表达量越高则肿瘤较大且恶性程度高,提示患者预后可能较差。

