支架取栓治疗急性缺血性脑卒中的临床研究
罗小辉, 龙 敏, 曹红飞, 胡志斌, 黄 波
(新余市人民医院脑血管病科, 江西新余 336600)
急性缺血性脑卒中(acute ischemic stroke, AIS)发病率约占全部脑卒中的80%,发病隐匿且病情进展迅速,是人类致死、致残的主要原因之一〔1-2〕。临床治疗AIS的关键在于尽早开通闭塞血管,促进血流恢复,挽救缺血半暗带组织。静脉溶栓是临床治疗AIS常用手段,但因其有严格的溶栓时间窗,血管再通率不高,且对于合并大动脉闭塞再通率仅为13%~18%,临床应用受到一定限制〔3-5〕。近年来,血栓抽吸装置、支架取栓装置等新的血管内治疗器械相继应用于临床,闭塞血管再通率明显提高,支架取栓、动脉溶栓等血管内治疗显示出良好的应用前景。本研究旨在分析支架取栓、动脉溶栓治疗AIS的临床价值,为临床治疗方案选择提供参考。
1 资料与方法
1.1 一般资料
选取2019年4月-2020年3月就诊于我院的70例AIS患者。研究经伦理委员会审核批准。将患者按随机数字表法分为两组,各35例。试验组女12例,男23例;年龄36~75岁,平均年龄(56.32±4.23)岁;发病至入院时间0.20~4.50 h,平均发病至入院时间(3.21±0.21)h。参考组女15例,男20例;年龄33~77岁,平均年龄(56.41±4.19)岁;发病至入院时间0.40~5.20 h,平均发病至入院时间(3.29±0.18)h。两组基本资料对比,差异无统计学意义(P>0.05)。存在可比性。
1.2 入选标准
纳入标准:符合AIS相关诊断标准〔6〕,并经CT等检查确诊;签署知情同意书;发病至入院时间≤6 h。排除标准:严重感染;恶性肿瘤;肝、肾功能异常;脑出血;血液系统疾病;既往有头颅手术史或脑卒中病史。
1.3 方法
试验组行支架取栓:取平卧位,局麻后,对股动脉用Seldinger法穿刺,6F导管鞘置入,脑血管造影确定闭塞血管位置。导丝引导下将微导管置入闭塞血管远端。微导管造影确认远端血管通畅。经微导管将Solitaire AB型支架植入血栓部位,支架远端释放,放置3~5 min后,回撤微导管、支架,必要时可多次取栓。
参考组行动脉溶栓:取位、麻醉与穿刺法同试验组。静脉给予肝素4000~5000 IU,维持活化全血凝血时间约220 s。经双侧椎动脉与颈动脉实施脑血管造影,明确侧支循环状况和闭塞血管部位。导丝引导下将微导管置入闭塞血管远端,并穿过血栓造影,明确闭塞远端血管状况和血栓长度后给药。在闭塞血管近端置入造影导管,注入10 mL生理盐水+10万U尿激酶,时间为10~30 min。观察血管再通情况,若闭塞血管未开通,可重复给药。如溶栓时间超过1 h或尿激酶用量>80万U仍未开通,则停止治疗。 术后两组均给予常规控制收缩压、营养支持等辅助治疗,术后24 h口服100 mg/d阿司匹林与75 mg/d氯吡格雷,连续治疗30 d。
1.4 观察指标
(1)分别于术前、术后72 h采集两组空腹静脉血5 mL,离心取上清液,使用美国Awareness全自动生化免疫分析仪测定血清神经元特异性烯醇化酶(NSE)、中枢神经特异蛋白(S100β)水平。(2)术前、术后14 d,用美国国立卫生研究院卒中量表(NIHSS)评估两组神经功能缺损情况,总分为45分,分值高低与神经功能缺损程度呈负相关。(3)采用改良RANKIN量表(mRS)评估患者术前、术后3个月残障水平,分值为0~6分,0分为完全无症状,6分为死亡为6分。mRS评分为0~2分表示预后良好,3~6分表示预后不良。(4)以脑梗死溶栓再通血流分级(TICI)对两组治疗后血管再通情况进行评估,血管再通失败为0~Ⅰ级,血管部分再通为Ⅱ级,血管完全再通为Ⅲ级。血管再通率=Ⅲ级率+Ⅱ级率。(5)对比两组并发症发生情况:脑出血等。
1.5 统计学方法
2 结果
2.1 血清指标
两组治疗前血清指标对比,差异无统计学意义(P>0.05),试验组治疗后NSE、S100β水平低于参考组,差异有统计学意义(P<0.05)(见表1)。

表1 两组血清指标对比
2.2 神经功能缺损程度、残障水平
两组治疗前mRS、NIHSS评分对比,差异无统计学意义(P>0.05),试验组NIHSS评分低于参考组,差异有统计学意义(P<0.05);两组mRS评分比较,差异无统计学意义(P>0.05)(见表2)。

表2 两组mRS、NIHSS对比分)
2.3 血管再通情况
试验组血管再通率高于参考组,差异有统计学意义(P<0.05)(见表3)。
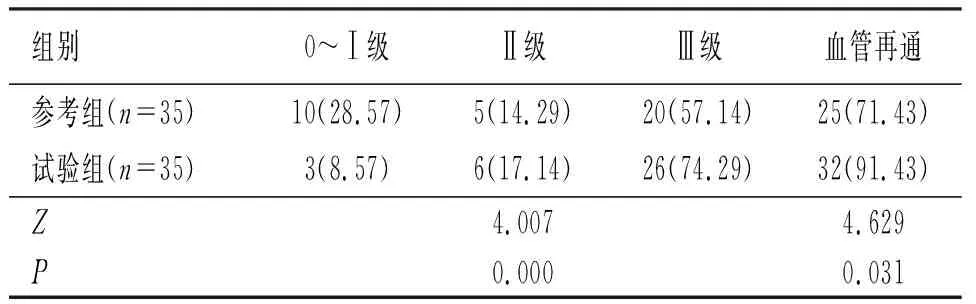
表3 两组血管再通情况对比〔n(%)〕
2.4 并发症
参考组术中出现6例脑出血(17.14%),试验组中无脑出血发生,差异有统计学意义(χ2=4.557,P=0.010)。
3 讨论
AIS作为临床常见的高致残、致死的脑血管疾病,可继发严重神经功能障碍,诱发意识障碍、语言障碍和肢体瘫痪等〔7〕。AIS生理病理机制复杂,当脑组织缺血且合并再灌注时,机体内会产生炎性细胞损害、能量耗竭、钙离子超载、自由基释放等一系列炎性反应,损伤神经细胞,造成脑细胞死亡〔8-11〕。AIS病灶是由缺血中心区和周围缺血半暗带组成,其中后者存在大量可逆的神经元,若能在短时间内重建缺血半暗带血循环并开通阻塞血管,可促进该区域神经细胞存活,恢复神经功能。静脉溶栓虽能改善患者病情,但其严格的时间窗,部分患者发病至开始治疗时间远远超过时间窗,治疗效果欠佳。动脉溶栓是临床对AIS治疗的常用介入手段,与静脉溶栓相比,血管再通率高且临床预后更好,具有患者接受度高、治疗费用低等优点〔12-14〕。但对于合并颅内血管急性栓塞患者,血管再通率欠佳,且治疗中会因静脉给药而诱发颅内出血,造成血管再次闭塞〔15〕。
NSE、S100β可调节脑细胞间联系、细胞内信号传导、能量代谢、细胞结构,促进突触生长、神经元分化、胶质增生,一旦患者出现胶质细胞或神经元损伤,两者可经细胞间液进入血液与脑脊液,是反映中枢神经细细胞损伤的特异性、敏感性指标〔16-17〕。本研究结果显示,试验组NSE、S100β、NIHSS评分、并发症发生率低于参考组,血管再通率高于参考组,两组mRS评分比较无明显差异,与申东峰等〔18〕研究结果相似,提示支架取栓治疗效果与安全性优于动脉溶栓。Solitaire AB型支架属于自膨式镍钛支架,能完全回收,柔韧性良好且释放回收简便,置入血栓段后,按照血栓段长度将支架展开完全覆盖血栓,以径向支撑力向血管壁挤压血栓,且在血栓内留置血栓数分钟后缓慢回收,能更彻底的将血栓取出,尽可能恢复闭塞段血流,缩短血管再通时间〔19-20〕。Solitaire AB型支架取栓无需使用溶栓药物,可减少术中脑出血发生风险;可反复应用于同一患者的取栓,最大程度开通闭塞血管,改善预后。
综上所述,与动脉溶栓相比,AIS行支架取栓治疗安全性更高,能提高血管再通率,减轻神经功能缺损,值得临床推广。

