α-琼胶酶OUC- GaJJ96的异源表达及酶学性质
金 佳,江承程,毛相朝,2,*
(1.中国海洋大学 食品科学与工程学院, 山东 青岛 266003;2.青岛海洋科学与技术国家试点实验室/海洋药物与生物制品功能实验室, 山东 青岛 266237)
琼脂是从红藻细胞壁中提取出来的一种重要多糖,由琼脂糖和琼脂胶组成[1]。琼脂糖是由3,6-L-内醚半乳糖和D-半乳糖经α-1,3-糖苷键和β-1,4-糖苷键交替连接组成的线性大分子多糖[2],由于其物理性质独特,在食品、医药等领域应用广泛[3]。琼脂胶与琼脂糖结构类似,但琼脂胶在羟基和伯醇基上不同程度地被硫酸基、丙酮酸、甲氧基、糖基等取代[2]。
琼脂糖水解后生成的琼胶寡糖具有许多生物功能,如抗氧化[4]、抗炎[5]、抗癌[6]和保湿美白[7]等,同时可作为益生元调节肠道菌群[8]。琼胶寡糖的制备方法主要分为酸解法和酶解法两种,相比于非特异性断裂糖苷键的酸解法,酶解琼脂糖可特异性断裂糖苷键,产物更单一、条件更温和。琼胶酶在琼脂糖酶解过程中具有重要作用,根据水解位点的不同,琼胶酶可分为两种类型:α-琼胶酶(EC 3.2.1.158)和β-琼胶酶(EC 3.2.1.81)。α-琼胶酶可以水解α-1,3-糖苷键产生以D-半乳糖作为非还原性末端的琼寡糖,β-琼胶酶水解β-1,4-糖苷键产生以3,6-L-内醚半乳糖作为非还原性末端的新琼寡糖[9]。
自琼胶酶被发现以来,关于β-琼胶酶克隆表达的研究较多,目前所表征的β-琼胶酶涵盖了GH16、GH50、GH86和GH118四个家族,研究较为深入。Ohta等[10]在2003年报道了第一个GH16家族的β-琼胶酶AgaA,来源于食辛乳聚糖卓贝尔氏黄杆菌(ZobelliagalactanivoransDsiJT);GH50和GH118家族的糖苷水解酶都属于β-琼胶酶,比如AgaB[11]、AgWH50C[12]、AgWH50B[13]等;Ohta等[14]在2004年报道了第一个GH86家族的β-琼胶酶AgrA。目前有研究报道的α-琼胶酶仅有5个,分别是来自溶藻性类单胞菌(AlteromonasagarlyticusGJ1B)的AgaA[15],来自深海杆菌济州居盐菌(Thalassomonassp. 44 JAMB- A3)的AgaA33[16],来自Thalassomonassp. LD5的AgaD[17],来自卵链属噬琼胶卵链菌(Catenovulumagarivorans)的CaLJ96[18]以及来自卵链属沉积物卵链菌(CatenovulumsediminisWS1- A)的AgaWS5[19]。α-琼胶酶可用于偶数琼寡糖的制备或可结合β-半乳糖苷酶进行奇数新琼寡糖的制备。目前市场上可以购买到偶数新琼寡糖和奇数琼寡糖标品,但偶数琼寡糖标品缺乏,所以寻找可用于制备偶数琼寡糖的α-琼胶酶具有重要意义。本研究拟在NCBI数据库中,以已报道的α-琼胶酶序列为模板进行序列比对,克隆表达得到一个α-琼胶酶,探究其酶学性质和水解产物,希望为酶解琼脂糖制备偶数琼寡糖提供理论基础。
1 材料与方法
1.1 材料与试剂
大肠杆菌(E.coli)DH5α、BL21(DE3)感受态细胞,北京天根生化科技公司;低熔点琼脂糖,美国Sigma公司;琼脂糖,美国Invitrogen公司;核酸染料Redsafe,韩国iNtRON公司;蛋白胨、酵母粉、琼脂粉,英国Oxiod公司。其他未提及试剂均为国产分析纯。
LB液体培养基:质量分数为1.0% NaCl、1.0%蛋白胨、0.5%酵母粉。高压灭菌条件为121 ℃,20 min。
LB固体培养基:在LB液体培养基的基础上,加入质量分数为1.5%~2.0%琼脂粉。高压灭菌条件相同。
1.2 仪器与设备
5804R型高速冷冻离心机、Mastercycler nexus型PCR仪,德国艾本德股份公司;WD- 9405B型水平摇床、DYY- 6C型电泳仪,北京市六一仪器厂;HH- 3A型水浴锅,常州智博瑞仪器制造有限公司;TGL16型离心机,长沙英泰仪器有限公司;MULTISKAN FC型酶标仪,赛默飞世尔科技公司;JY92- IIN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;SPX型生化培养箱,新江南仪器有限公司;DW- 86L386型立式超低温保存箱,青岛海尔股份有限公司;GI80TW型立式自动压力蒸汽灭菌锅,厦门致微仪器有限公司;LC- 20AT型高效液相色谱仪,日本岛津公司;电喷雾离子源质谱,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1OUC- GaJJ96的克隆表达
在NCBI数据库中,以已研究的α-琼胶酶基因序列为模板进行检索,根据序列相似性进行选择,得到来源于溶藻性吉尔维菌(Gilvimarinusagarilyticus)的α-琼胶酶基因(GenBank序列号:WP- 041525041.1),克隆表达后得到α-琼胶酶OUC- GaJJ96。在SMART(http:// smart. embl-heidelberg. de/)在线网站预测信号肽,结果表明,OUC- GaJJ96在N端含有26个氨基酸编码的信号肽。利用SnapGene对删除信号肽的基因序列进行引物设计,引物由青岛擎科公司合成,引物序列分别为OUC- GaJJ96- F(5’-GGATCCATGGTTAACAGCAATACC-3’),OUC- GaJJ96- R(5’-AAGCTTATGACTCAGTTCCAGAAT-3’)。基因片段经PCR扩增后与载体pET21a(+)连接,构建重组质粒pET21a(+)-OUC- GaJJ96。将转化到E.coliBL21后的菌液于37 ℃培养16 h,挑取菌落接种到LB培养基中,采用异丙基硫代半乳糖苷(IPTG)诱导表达。诱导结束后于4 ℃,8 000 r/min离心15 min,收集菌体。
1.3.2OUC- GaJJ96的纯化
选用20 mmol/L,pH值为8.0的磷酸盐缓冲液将菌体重悬,完全复溶后在低温下超声破碎(功率360 W,30 min),破碎结束后于4 ℃,8 000 r/min离心15 min,取上清液即为粗酶液。纯化所用填料为ProteinIso®Ni- NTA Resin,纯化过程中所用的缓冲液、相关溶液以及粗酶液均用0.45 μm滤膜过滤,纯化操作均在4 ℃进行。先用六倍柱体积的平衡缓冲液(20 mmol/L磷酸盐缓冲液、10 mmol/L咪唑、500 mmol/L NaCl)平衡柱子;上样后依次用含有不同咪唑浓度梯度(20、50、80、120、200 mmol/L)的洗脱缓冲液洗脱柱子,并分别对粗酶液及纯化后酶液进行SDS- PAGE检测。
1.3.3OUC- GaJJ96酶学性质的表征
1.3.3.1 OUC- GaJJ96酶活力的测定
采用DNS法进行酶活力测定[20]。吸取193 μL,质量分数为0.3%的低熔点琼脂糖底物(pH值为7.0,50 mmol/L Tris- HCl缓冲液配制),5 μL纯化后的酶液和2.0 μL 1 mol/L的Ca2+于1.5 mL EP管中,混合后于30 ℃反应30 min,沸水浴5 min终止反应。取200 μL反应液与300 μL DNS沸水浴5 min,冷却至室温,于540 nm测定吸光值。以灭活后的酶液作对照,每个反应做3个平行。
α-琼胶酶酶活力单位(U)的定义:每分钟水解琼脂糖产生1 μmol还原糖所需要的酶量。
1.3.3.2 最适温度和热稳定性的测定
1)OUC- GaJJ96最适温度的测定。将用pH值为7.0的Tris- HCl缓冲液配制的质量分数为0.3%的琼脂糖底物在25、30、35、40、45、50、55、60 ℃条件下温育10 min。分别吸取190 μL温育后的底物,10 μL纯化后的酶液和2.5 μL 1 mol/L的Ca2+于1.5 mL EP管中,混合后于30 ℃反应30 min,沸水浴5 min终止反应。用DNS法测定酶活力,以最大值为100%,分别计算各温度下的相对酶活力,每个反应做3个平行。
2)OUC- GaJJ96热稳定性的测定。取适量纯化后的酶液在25、30、35、40、45、50、55、60 ℃条件下放置,按不同时间取样,在最适反应条件下测定酶活力。以未经处理的酶液作对照,计算不同处理下的残余酶活力,每个反应做3个平行。
1.3.3.3 最适pH值和酸碱稳定性的测定
1)OUC- GaJJ96最适pH值的测定。分别用50 mmol/L的pH值为3.0~6.0的柠檬酸盐缓冲液,50 mmol/L的pH值为6.0~8.0的Na2HPO4-NaH2PO4缓冲液,50 mmol/L的pH值为7.0~9.0的Tris- HCl缓冲液和50 mmol/L的pH值为9.0~10.0的甘氨酸- NaOH缓冲液,配制质量分数为0.3%的低熔点琼脂糖底物,煮溶后于30 ℃条件下温育10 min。吸取190 μL温育后的底物,10 μL纯化后的酶液和2.5 μL 1 mol/L的Ca2+于1.5 mL EP管中,混合后于30 ℃条件下反应30 min,沸水浴5 min终止反应。用DNS法测定酶活力,以最大值为100%,分别计算不同pH值条件下的相对酶活力,每个反应做3个平行。
2)OUC- GaJJ96酸碱稳定性的测定。取适量纯化后的酶液于pH值为6.0~10.0的缓冲液中,在4 ℃条件下放置,按不同时间取样,在最适反应条件下测定酶活力。以未经处理的酶液作对照,计算不同处理下的残余酶活力,每个反应做3个平行。
1.3.4OUC- GaJJ96水解产物分析
1.3.4.1 高效液相色谱分析
1)高效液相色谱(HPLC)分析条件[13]。Sugar Pak I色谱柱(6.5 mm×300 mm,10 μm)。流动相为50 mg/L的乙二胺四乙酸二钠钙盐(EDTA- CaNa2),设置柱温为75 ℃,流速为0.5 mL/min,示差折光(RID)检测器检测。
2)样品制备。吸取190 μL质量分数为0.3%的低熔点琼脂糖底物,10 μL纯化后的酶液和2.5 μL 1 mol/L的Ca2+于1.5 mL EP管中,混合后于30 ℃条件下反应,按不同时间取样,沸水浴5 min终止反应。将反应后的溶液过0.22 μm滤膜后于4 ℃保存,作为后续HPLC分析样品。吸取190 μL质量分数为0.3%的低熔点琼脂糖底物,10 μL纯化后的酶液和2.5 μL 1 mol/L Ca2+于1.5 mL EP管中,混合后于30 ℃条件下反应24 h,不终止反应,补加β-半乳糖苷酶AgWH2A[21],在其最适反应温度(40 ℃)下充分反应20 h,沸水浴5 min终止反应。将反应后的溶液过0.22 μm滤膜后于4 ℃保存,作为后续HPLC分析样品。
3)标品制备。由于市场上缺乏偶数琼寡糖标品,所以选用已有较深入研究的CaLJ96[19]反应产物作标品。吸取190 μL质量分数为0.3%的低熔点琼脂糖底物,10 μL纯化后的CaLJ96和2.5 μL 1 mol/L的Ca2+于1.5 mL EP管中,混合后于30 ℃条件下反应12 h,沸水浴5 min终止反应。将反应后的溶液过0.22 μm滤膜后于4 ℃冰箱保存,作为后续HPLC分析标品。
1.3.4.2 电喷雾离子源质谱分析
1)电喷雾离子源质谱(ESI- MS)分析条件[18]。采用负离子扫描模式,全扫描质荷比(m/z)为100~1 000。
2)样品制备。吸取190 μL质量分数为0.3%的低熔点琼脂糖底物,10 μL纯化后的酶液和2.5 μL 1 mol/L Ca2+于1.5 mL EP管中,混合后于30 ℃条件下反应24 h,沸水浴5 min终止反应。将反应后的溶液过0.22 μm滤膜后于4 ℃保存,作为后续ESI- MS分析样品。
1.4 数据处理
采用Origin Pro 9.0软件进行数据统计和图片处理,数据均为3次平行。
2 结果与分析
2.1 OUC- GaJJ96的序列分析结果
OUC- GaJJ96的开放阅读框(ORF)总长度为3 759 bp(GenBank序列号WP_041525041.1),编码1 252个氨基酸。将OUC- GaJJ96与已报道的5个α-琼胶酶序列进行比对,结果显示:OUC- GaJJ96与来自ThalassomonasagarivoransJAMB- A33的AgaA33[16]序列同源性最高,为58.81%(GenBank序列号BAF44076.1),与来自AlteromonasagarlyticusGJ1B的AgaA[15](GenBank序列号AAF26838.1)序列同源性为57.51%,与来自Thalassomonassp. LD5的AgaD[17](GenBank序列号AQN80853.1)序列同源性为56.44%,与来自Catenovulumagarivorans的CaLJ96[18](GenBank 序列号WP_035015824.1)序列同源性为57.92%,与来自CatenovulumsediminisWS1- A的AgaWS5[19](GenBank序列号WP_143872330.1)序列同源性为52.78%。OUC- GaJJ96的进化树分析结果见图1。图1显示:OUC- GaJJ96同之前报道的α-琼胶酶都属于GH96家族,但OUC- GaJJ96属于该家族的一个独立分支,说明它是一种较为新型的α-琼胶酶。

图1 OUC- GaJJ96进化树分析Fig.1 Phylogenetic analysis of OUC- GaJJ96
2.2 OUC- GaJJ96蛋白的表达及纯化结果
将用于表达的菌株接入LB培养基中,培养至OD600达到0.6左右时加入IPTG诱导培养20 h,收集并破碎菌体制备粗酶。通过DNS法初步测定粗酶活力,与灭活的酶液相比,粗酶显示出较高的酶活力,可用于进一步纯化。经过镍柱纯化得到目的蛋白OUC- GaJJ96。酶活力测定结果显示:OUC- GaJJ96比酶活力为2.68 U/mg。OUC- GaJJ96蛋白的SDS- PAGE电泳结果见图2。图2显示:目的蛋白分子质量约为180 kDa,DNAMAN预测蛋白分子质量为136.1 kDa。

M:标准蛋白Marker;1:粗酶蛋白;2:纯化的蛋白。图2 OUC- GaJJ96蛋白纯化的SDS- PAGE分析结果Fig.2 SDS- PAGE analysis of OUC- GaJJ96
2.3 酶学性质分析
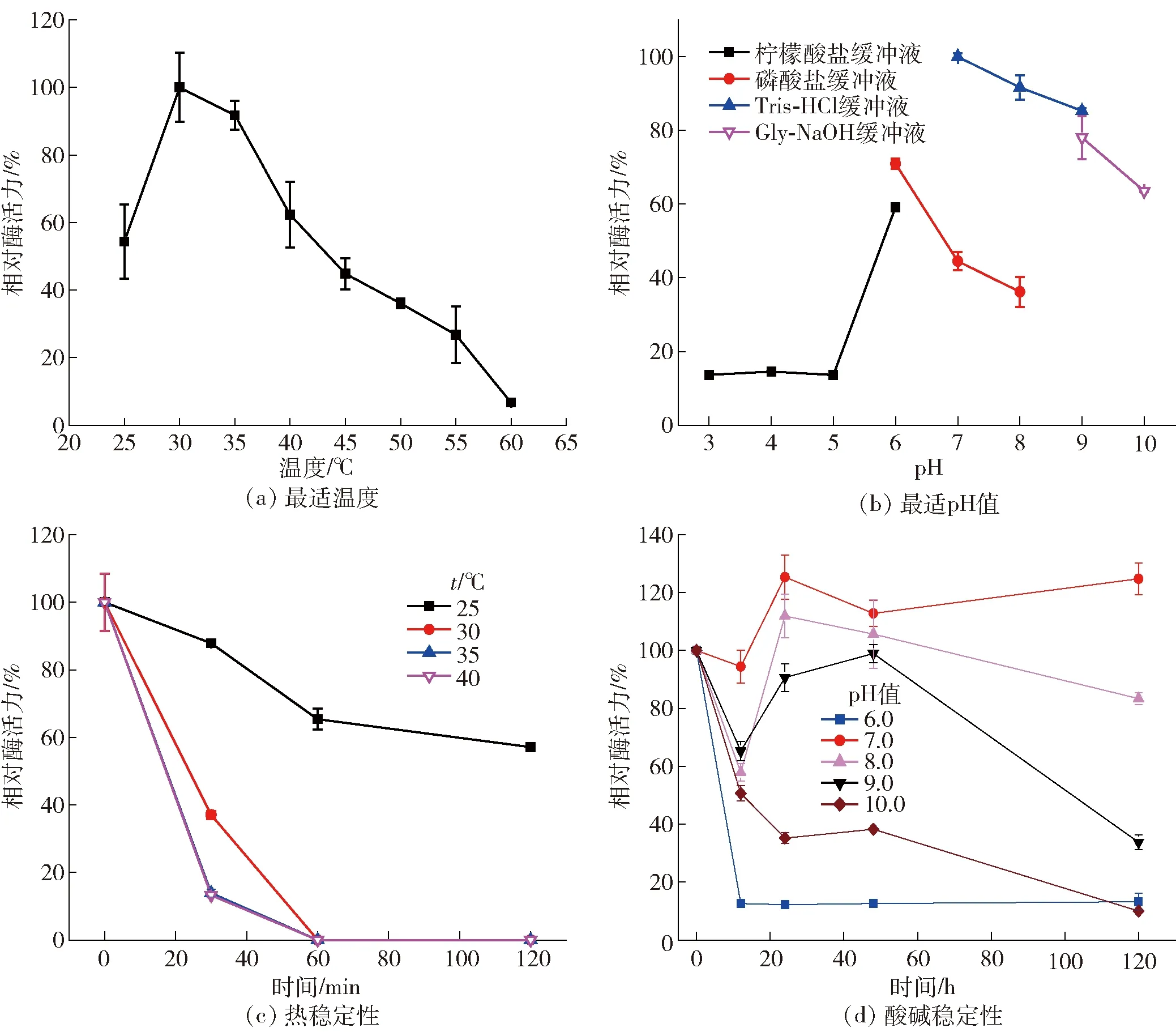
图3 温度和pH值对酶活力的影响Fig.3 Influence of temperature and pH on enzyme activity
OUC- GaJJ96酶学性质研究结果见图3。图3(a)及图3(b)表明:OUC- GaJJ96在30 ℃、pH值为7.0(Tris- HCl缓冲液)的环境中表现出最高酶活力,与已报道的α-琼胶酶相似。Lee等[19]报道的α-琼胶酶AgaWS5在40 ℃、pH值为8.0的环境中表现出最高酶活力,且具有独特的耐寒性,在10 ℃可保留超过40%的最高酶活力;Liu等[18]报道的α-琼胶酶CaLJ96最适反应温度和pH值分别为37 ℃、7.0;Ohta等[16]报道的α-琼胶酶AgaA33最适反应温度和pH值分别为45 ℃、8.5,可在40 ℃环境中30 min内保持稳定;Potin等[15]报道的α-琼胶酶AgaA最适反应温度和pH值分别为42.5 ℃、7.2,在低于30 ℃的环境中保存几天后仍有酶活力,温度超过45 ℃或pH值低于6.5均会失活;Zhang等[17]报道的α-琼胶酶AgaD最适反应温度和pH值分别为35 ℃、7.4。图3(c)热稳定性研究结果表明:OUC- GaJJ96在高于35 ℃放置30 min几乎完全失活,在25 ℃及30 ℃放置30 min可分别保持初始酶活力的87.9%、37.04%,在高于30 ℃条件下放置1 h几乎完全失活。图3(d)酸碱稳定性研究结果表明:OUC- GaJJ96在4 ℃,pH值为6.0的环境中放置12 h基本失去活性;在4 ℃,pH值为10.0的环境中放置12 h可保持初始酶活力的50.64%;在pH值为7.0条件下最稳定。
2.4 OUC- GaJJ96的水解产物分析
由于市场上缺乏偶数琼寡糖标品,以有较深入研究的α-琼胶酶CaLJ96[18]与琼脂糖反应产物作为标品,通过HPLC对不同时间取样的样品进行检测,并进一步通过ESI- MS分析产物。OUC- GaJJ96水解产物的HPLC检测结果见图4。图4(a)表明:随着反应的进行,P1、P2和P3的含量呈现递增趋势,且主要产物为P2。由于偶数琼寡糖与偶数新琼寡糖的分子质量一致,无法根据分子质量判断产物是偶数琼寡糖还是新琼寡糖。考虑到β-半乳糖苷酶只切割琼寡糖非还原端的糖苷键,将其降解生成D-半乳糖和相应的新琼寡糖,因此选择对OUC- GaJJ96水解琼脂糖的产物进行再解析。图4(b)表明:在OUC- GaJJ96的水解产物中补加β-半乳糖苷酶反应后,出峰时间发生了偏移,说明β-半乳糖苷酶AgWH2A可以继续降解OUC- GaJJ96的水解产物。OUC- GaJJ96水解产物的ESI- MS检测结果见图5。图5表明:产物分子质量P1为936 Da,P2为630 Da,P3为324 Da。进一步结合Liu等[18]的研究结果分析得出,产物P1为琼六糖,P2为琼四糖,P3为琼二糖。其他已报道的α-琼胶酶AgaWS5[19]、CaLJ96[18]、AgaA33[16]、AgaA[15]及AgaD[17]主要水解产物均为琼四糖,OUC- GaJJ96的主要水解产物与其相同。
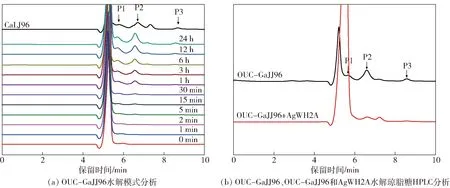
图4 OUC- GaJJ96水解产物的HPLC分析结果Fig.4 HPLC analysis of hydrolysis products of agarose hydrolyzed by OUC- GaJJ96

图5 OUC- GaJJ96水解产物ESI- MS分析结果Fig.5 ESI- MS analysis of hydrolysis products of agarose hydrolyzed by OUC- GaJJ96
3 结 论
克隆表达了来自Gilvimarinusagarilyticus的α-琼胶酶OUC- GaJJ96。OUC- GaJJ96属于GH96家族,蛋白分子质量约为180 kDa,比酶活力为2.68 U/mg,在30 ℃、pH值为7.0(Tris- HCl缓冲液)条件下显示出最高酶活力,主要水解产物为琼四糖。OUC- GaJJ96除可用于偶数琼寡糖标品的制备外,参考β-琼胶酶与α-新琼二糖水解酶结合制备奇数低聚合度琼寡糖的方法及Yang等[21]的研究,可将OUC- GaJJ96与β-半乳糖苷酶AgWH2A结合制备奇数新琼寡糖。通过对OUC- GaJJ96最适反应温度和pH值的考察,得到最佳反应条件,结合水解产物研究,充分了解其酶解性质,希望能丰富α-琼胶酶酶库,并能为偶数琼寡糖的生物酶法制备提供理论基础。

