Cyclobacterium qasimii脱乙酰酶的异源表达及酶学性质
马佳菲,秦 臻,范立强,赵黎明,*,蒋丽华,*
(1.华东理工大学 生物工程学院/发酵工业分离提取技术研发中心/生物反应器工程国家重点实验室,上海 200237; 2.上海大学 生命科学学院, 上海 201900)
氨基葡萄糖(glucosamine,GlcN)是天然的氨基单糖,在自然界中广泛存在,其衍生物N-乙酰氨基葡萄糖(N-acetyl-D-glucosamine,GlcNAc)是甲壳素(又称为几丁质)的结构单元。GlcN是唯一的碱性单糖,游离的氨基使其具有生物活性。GlcN不仅可用于治疗关节炎,促进关节生理活性的正常运行[1-4],而且具有多种生物活性,如抗癌[5-7]、抗氧化[8-11]、抑菌[12-13]、抗病毒[14]等。GlcN已被广泛应用到医药、饲料、保健食品、化妆品等领域中。
GlcN的广泛使用促使其需求量不断增加,刺激了其工业化生产的发展。目前GlcN的生产方法有酸水解法、微生物发酵法和生物催化法。传统的甲壳素酸水解法[15-17]需在高温条件下,并在浓酸中进行水解,存在环境污染严重、设备要求高等问题。通过微生物发酵法制备GlcNAc[18-19],并进一步脱乙酰基获得GlcN,已逐渐成为规模化生物制造GlcN的主要途径;然而该方法的脱乙酰反应仍需要采用酸水解来实现。Deng等[20-21]还报道了微生物发酵法直接生产GlcN,但在发酵过程中,GlcN降解速度快,且GlcN及其降解产物对宿主细胞具有抑制作用,导致产量较低。Jiang等[22-23]报道了以GlcNAc为底物,全细胞催化生产GlcN,此方法环境污染少,但仍未达到工业化生产的需求。基于已有的生产方法,利用微生物发酵法得到的GlcNAc,再利用一种环境友好、成本低、生产效率高且工艺简单的生物酶催化法将GlcNAc脱乙酰基生产GlcN,将是一种更理想的GlcN生产方法。
已报道的可应用于GlcN生产的脱乙酰酶存在反应温度高、底物亲和力差等问题;因此,挖掘稳定性好、反应条件温和、底物亲和力高的N-乙酰氨基葡萄糖脱乙酰酶具有重要的意义。来源于Cyclobacteriummarinum的脱乙酰酶CmCBDA是第一个报道的能够在体外温和条件下催化GlcNAc脱乙酰基生成GlcN的酶,且能耐受较高的底物浓度[24]。本研究拟利用生物信息学手段筛选与CmCBDA氨基酸序列相似性最高的卡西氏菌Cyclobacteriumqasimii来源脱乙酰酶(CqCBDA),对CqCBDA的编码基因进行克隆、表达及纯化,并进行酶学性质表征,以期为工业化生产GlcN提供具有应用价值的生物酶制剂。
1 材料与方法
1.1 材料与试剂
Cyclobacteriumqasimii脱乙酰酶基因CqCBDA由生工生物工程(上海)股份有限公司合成;大肠杆菌(E.coli)DH5α和BL21(DE3)感变态细胞,购自上海康为试剂生物科技公司;带有卡那霉素抗性基因的载体pET28a(+),购自美国Novagen有限公司;Taq DNA聚合酶,购自南京Vazyme生物科技有限公司;T4 DNA连接酶和限制性内切酶,购自美国New England Biolabs有限公司;DNA Marker DL2000和蛋白 Marker,购自大连TaKaRa生物工程有限公司;SanPrep柱式质粒DNA小量抽提试剂盒、DNA胶回收试剂盒、PCR产物纯化试剂盒,购自生工生物工程(上海)股份有限公司;N-乙酰氨基葡萄糖,购自上海麦克林生化科技有限公司。
LB液体培养基:5 g酵母提取物,10 g胰蛋白胨,10 g NaCl,用去离子水定容至1 L。LB固体培养基:5 g酵母提取物,10 g胰蛋白胨,10 g NaCl,20 g琼脂粉,用去离子水定容至1 L。
1.2 仪器与设备
MyCycler聚合酶链式反应(polymerase chain reaction,PCR)扩增仪、Power Pac Basic电泳仪,美国Bio-Rad公司;JY92- IIN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;UV765型紫外- 可见分光光度计,上海佑科仪器有限公司;1200型高效液相色谱仪,安捷伦科技(中国)有限公司。
1.3 实验方法
1.3.1基因序列筛选与分析
根据NCBI数据库提供的已报道的具有N-乙酰氨基葡萄糖脱乙酰酶活性的Cyclobacteriummarinum来源脱乙酰酶基因CmCBDA的编码序列(GenBank登录号:WP_149392827),利用BlastP (https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析其与其他蛋白的序列相似性,筛选得到Cyclobacteriumqasimii来源的具有潜在N-乙酰氨基葡萄糖脱乙酰酶活性的CqCBDA基因序列(GenBank登录号:WP_020891027)。使用DNAMAN软件分析CqCBDA核酸序列并确定酶切位点,并使用Primer Premier 5软件设计引物。根据数据库中脱乙酰酶氨基酸序列,使用MEGA 7.0软件按照 Neighbor- joining运算方法构建系统发育树[25],使用ClustalX2软件进行多重序列比对。
1.3.2重组质粒的构建

1.3.3重组CqCBDA的表达与纯化
将含有重组质粒pET- 28a- CqCBDA的阳性工程菌接种至含50 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min条件下培养至OD600达到0.6~0.8,加入终浓度为1 mmol/L的异丙基硫代半乳糖苷,30 ℃诱导培养12 h。离心收集菌体,用缓冲液A(20 mmol/L咪唑,20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH值8.0)重悬,超声破碎后10 000 r/min离心10 min,得到的上清液即为含有可溶性重组蛋白的粗酶液。将粗酶液上样至预先平衡好的Ni-IDA柱后,先用缓冲液A和缓冲液B(40 mmol/L咪唑,20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH值8.0)洗涤,再用缓冲液C(200 mmol/L咪唑,20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH值8.0)冲洗,收集带有组氨酸标签(Histidine tag,His-tag)的重组CqCBDA。SDS- PAGE法检测重组蛋白表达纯化效果。
1.3.4酶学性质表征
1.3.4.1 蛋白定量和酶活力的检测
1)蛋白定量检测[26]。以牛血清蛋白作为标准品绘制标准曲线,采用考马斯亮蓝法测定蛋白浓度。在1 mL的考马斯亮蓝试剂中,加入100 μL适当稀释的酶液,迅速混匀,室温反应3 min后,以加入等量蒸馏水的试剂作为空白对照。使用分光光度计检测样品在595 nm波长下的吸光值,根据测得的吸光值和标准曲线计算出纯酶中的蛋白浓度。
薄层层析色谱法(thin-layer chromatography,TLC)定性检测得到的可溶性重组酶是否具有N-乙酰氨基葡萄糖脱乙酰酶活性。TLC条件:展开剂为异丙醇、水和氨水混合液(三者体积比为15.0∶1.0∶7.5);显色剂的配制方法为,将适量的大茴香醛溶于乙醇中,缓缓加入少量的浓H2SO4,再加入少量的醋酸混合,展开时间为60 min。
2)酶活力检测。将270 μL用缓冲液配制而成的10 g/L GlcNAc溶液在水浴锅中预热2 min,然后加入30 μL适当稀释的酶液,反应10 min,立即沸水浴加热5 min终止反应。采用高效液相色谱法(high performance liquid chromatography,HPLC)检测反应液中GlcN的浓度,计算酶活力。
酶活力单位(U)定义:在酶促反应条件下,每分钟生成1 μmoL GlcN(N-乙酰氨基葡萄糖)所需的脱乙酰酶酶量。
HPLC条件[27]:色谱柱为氨基柱(250 mm×4.6 mm,5 μm);检测器为紫外检测器,检测波长为195 nm;流动相为体积分数为35%的水相(称取3.5 g K2HPO4,加水溶解,加入0.25 mL氨水,混匀,用磷酸调节pH值至7.5,用水定容至1 L)和65%的乙腈,流速为1 mL/min;色谱柱温度为35 ℃;进样量为10 μL。
1.3.4.2 最适温度和热稳定性的测定
重组CqCBDA在不同温度(25~60 ℃)下分别进行反应,测定其酶活力。以测得的最高酶活力为100%,计算不同温度下的相对酶活力,确定该酶的最适温度。
以未经处理的酶液的酶活力为100%,将重组CqCBDA分别置于不同温度(30~80 ℃)下孵育60 min后,在最适温度下测定残余酶活力,确定该酶的热稳定性。
1.3.4.3 最适pH值和酸碱稳定性的测定
重组CqCBDA在不同pH值(pH值为6.0~10.0)的缓冲液中,在最适温度下分别进行反应,测定其酶活力。以测得的最高酶活力为100%,计算不同pH值条件下的相对酶活力,确定该酶的最适pH值。
以未经处理的酶液的酶活力为100%,将重组CqCBDA分别置于不同pH值(pH值为6.0~10.0)的缓冲液中,在最适温度条件下孵育60 min后,在最佳反应条件下测定残余酶活力,确定该酶的酸碱稳定性。
1.3.4.4 动力学参数的测定
为了测定重组CqCBDA的动力学参数,将其分别置于不同质量浓度(0.25~64.00 mg/mL)的GlcNAc溶液中,在最适反应条件下进行反应,测定其酶活力。通过Sigma plot软件计算Vmax和Km值,从而计算出Kcat值和Kcat/Km值。
1.3.4.5 金属离子和EDTA对酶活力影响的测定
在反应液中分别加入终浓度为10 mmol/L的不同金属离子(Ni2+、Mn2+、Ca2+、K+、Ba2+、Mg2+、Co2+、Cu2+、Zn2+)和EDTA,以不加金属离子的酶液的酶活力为100%,测定金属离子和EDTA对重组CqCBDA酶活力的影响。
1.4 数据处理与分析
采用软件MEGA7.0和Clustacx2进行氨基酸序列分析,采用软件Origin 9.0对实验数据进行统计分析和图形绘制。
2 结果与分析
2.1 CqCBDA的序列分析结果
为了筛选得到具有N-氨基葡萄糖脱乙酰酶活性的脱乙酰酶,利用Blast比对CmCBDA与其他蛋白的序列相似性,得到Cyclobacteriumqasimii来源的脱乙酰酶基因(CqCBDA),基因全长879 bp,编码292个氨基酸。Blast分析结果显示:CqCBDA氨基酸序列与CmCBDA序列相似度最高,达78.40%。图1为CqCBDA的序列分析结果,图1(a)的CqCBDA氨基酸序列系统发育树同样显示:CqCBDA与CmCBDA具有最近的进化关系。
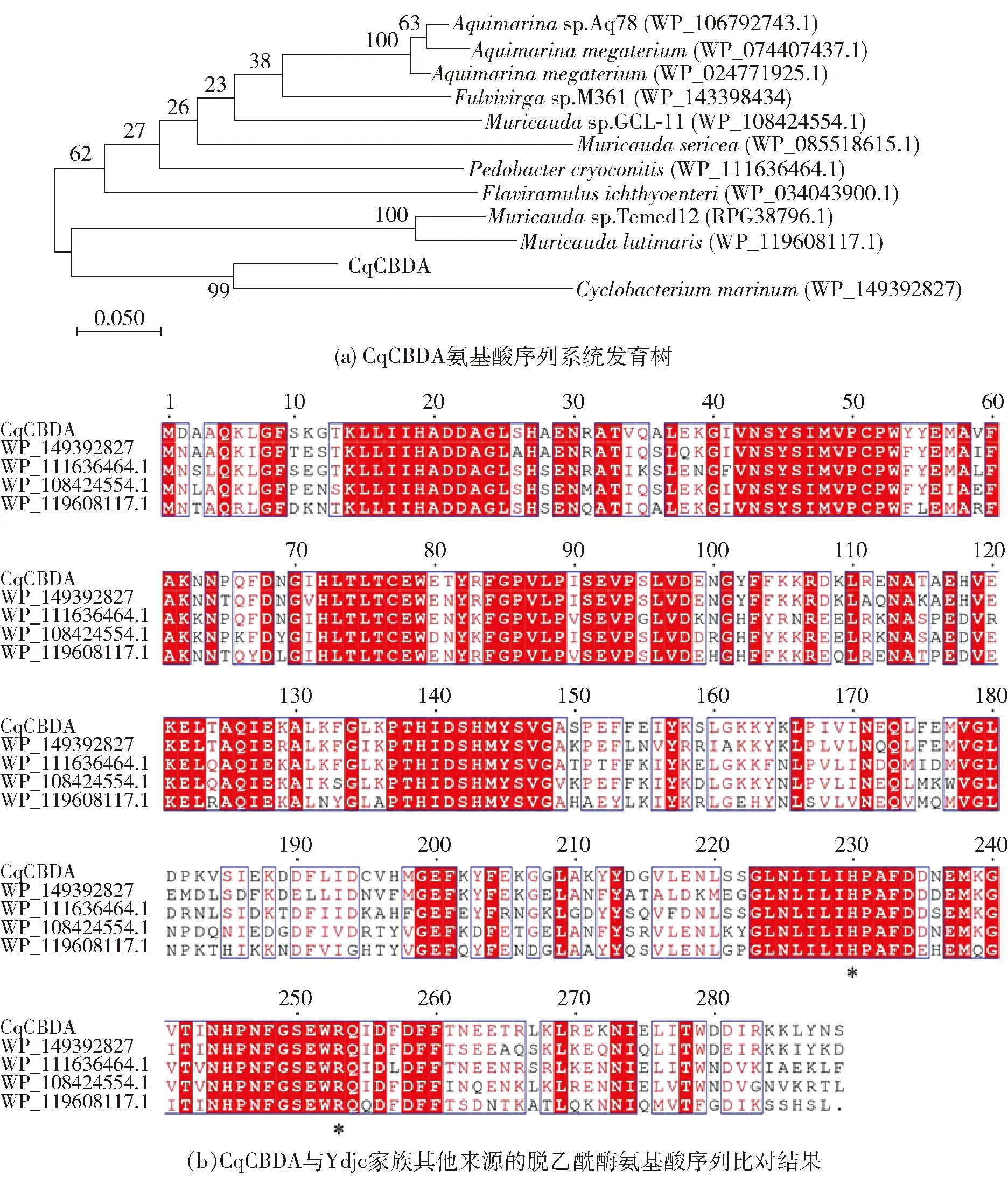
CqCBDA多重序列比对包括:海环杆菌(WP_149392827)、幽门螺杆菌(WP_111636464.1)以及鼠尾菌(WP_108424554.1、WP_119608117.1)来源的脱乙酰酶。图上方的数字表示氨基酸的残基序号;保守的氨基酸标以红色阴影,活性中心的两个催化氨基酸残基(His230和Arg253)以星号标注。图1 CqCBDA的序列分析结果Fig.1 Results of sequence analysis of CqCBDA
图1(b)为CqCBDA与Ydjc家族其他来源的脱乙酰酶多重序列比对结果。图1(b)显示:有多处高度保守的氨基酸序列重合[28],如与产物乙酸分子的氧原子形成氢键的Arg253,与乙酸分子的另一个氧原子形成氢键的His230,尤其是与Ydjc家族脱乙酰酶氨基酸序列中高度保守的Asp22、His72和His143氨基酸残基也完全一致;因而,推断CqCBDA可能归属于Ydjc家族。
2.2 重组质粒的构建结果
以含目的基因的菌体作为模板,进行PCR扩增,PCR扩增产物的琼脂糖凝胶电泳结果如图2。图2显示:PCR扩增得到一条900 bp左右的特异性条带,其大小符合理论预期,与CqCBDA基因大小一致。经双酶切的基因和表达载体连接后,转化至E.coliDH5α感受态细胞,经测序鉴定,成功构建并得到重组表达质粒pET- 28a- CqCBDA。
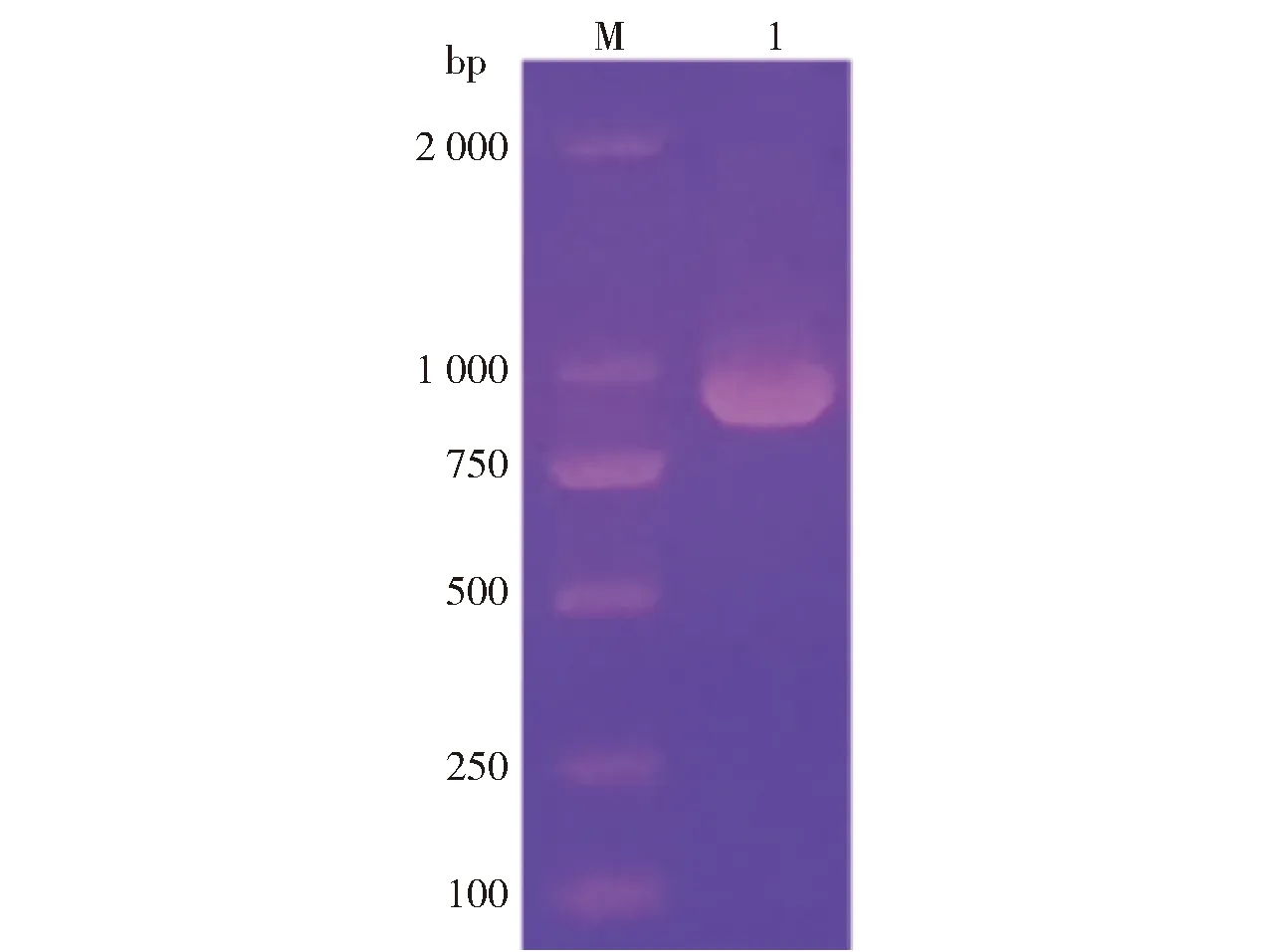
M:DNA Marker;1:PCR扩增产物。图2 PCR扩增产物琼脂糖凝胶电泳Fig.2 Agarose gelelectrophoresis result of gene fragment
2.3 重组蛋白的表达与纯化结果
表达质粒pET- 28a- CqCBDA转化至E.coliBL21感受态细胞后,在LB液体培养基中进行培养,并用IPTG诱导表达,采用Ni- IDA亲和层析柱对上清液中的可溶性目的蛋白进行纯化。通过SDS- PAGE分析蛋白表达情况和纯度,蛋白凝胶电泳结果如图3。图3显示:全细胞液和上清液中均含有33 kDa大小的条带,与目的蛋白分子质量大小相同,表明已成功表达了可溶性重组目的蛋白;可溶性蛋白的含量较高,且成功获得高纯度的可溶性目的蛋白。
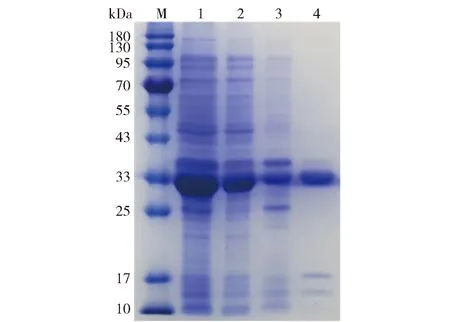
M:蛋白marker;1:全细胞液;2:超声破碎上清液;3:超声破碎沉淀;4:纯化的目的蛋白。图3 重组CqCBDA的表达和纯化结果Fig.3 Results of expression and purification of recombinant CqCBDA
2.4 酶学性质分析
2.4.1重组CqCBDA的催化活性
以适当浓度的GlcNAc溶液作为反应底物,检测重组CqCBDA的N-乙酰氨基葡萄糖脱乙酰酶活性,TLC检测结果如图4。图4显示:随着反应时间的延长,GlcN的颜色加深,GlcNAc的颜色变浅,说明GlcNAc不断脱乙酰基生成GlcN,这表明重组CqCBDA具有N-乙酰氨基葡萄糖脱乙酰酶活性。

图4 重组CqCBDA的N-乙酰氨基葡萄糖脱乙酰 酶活性的TLC检测结果Fig.4 TLC analysis of recombinant CqCBDA N-acetylglucosamine deacetylase activity
GlcNAc和GlcN的高效液相色谱图如图5。图5显示:GlcNAc和GlcN的出峰时间分别为4.925 min和8.259 min,两者的出峰时间差距较大,说明GlcNAc和GlcN能很好地分离。以GlcNAc为底物,重组CqCBDA的比酶活力为11.5 U/mg。

图5 GlcNAc和GlcN的HPLC色谱图Fig.5 HPLC chromatograms of GlcNAc and GlcN
2.4.2温度对重组CqCBDA酶活力的影响
在不同温度下测定酶活力,重组CqCBDA的最适温度测定结果如图6。图6显示:CqCBDA的最适反应温度为40 ℃,在该反应温度下酶活力达到最大值。当温度低于30 ℃或高于45 ℃时,CqCBDA的相对酶活力降低至50%以下;当温度高于50 ℃时,酶活力大幅度降低,相对酶活力降至10%以下。GlcN不稳定,会发生褐变,尤其是在较高温度下会加速褐变和副反应的发生,且温度越高褐变越明显[29]。已报道的、可应用于GlcN生产的脱乙酰酶属于高温酶[22],在温度较高条件下进行反应,GlcN褐变损失增加。CqCBDA能在温和条件下催化GlcNAc脱乙酰基生产GlcN,减少褐变损失。
将酶液在30~80 ℃条件下孵育60 min,测定其残余酶活力。重组CqCBDA的热稳定性的测定结果如图6(b)。图6(b)显示:当孵育温度低于40 ℃时,CqCBDA具有高稳定性,其残余酶活力仍能保持在90%以上;当孵育温度高于40 ℃时,稳定性出现大幅度下降,这说明CqCBDA不耐高温。
2.4.3pH值对重组CqCBDA酶活力的影响
在不同pH值条件下测定酶活力,重组CqCBDA的最适pH值测定结果如图7。图7(a)显示:CqCBDA的最适反应pH值为7.6,在该pH值条件下酶活力达到最大值;当pH值在6.8~7.6时,CqCBDA的活性较高,其相对酶活力均在80%以上;当pH值小于6.4或大于8.0时,CqCBDA的相对酶活力降低至60%以下。GlcN的褐变与pH值密切相关,美拉德反应发生在pH值为4~9,随着pH值上升,褐变加剧[25]。CmCBDA的最适pH值为9.0[24],相比于CmCBDA,在CqCBDA的最适反应pH值条件下,GlcN的非酶褐变减缓。
将酶液稀释于不同pH值的缓冲液中,在40 ℃条件下孵育60 min,测定其残余酶活力。重组CqCBDA的酸碱稳定性测定结果如图7(b),图7(b)显示:在较广的pH值范围内(pH值为6.0~10.0),CqCBDA能保持良好的酸碱稳定性,残余酶活力均维持在70%以上;尤其是当pH值在7.5~8.5时,其残余酶活力仍能维持在90%以上,说明CqCBDA在弱碱性条件下稳定性高。

图6 温度对重组CqCBDA酶活力的影响Fig.6 Effects of temperature on purified recombinant CqCBDA

图7 pH值对重组CqCBDA酶活力的影响Fig.7 Effects of pH on purified recombinant CqCBDA
2.4.4动力学参数测定结果
在40 ℃、pH值为7.6的最适反应条件下,以不同浓度的GlcNAc溶液作为底物,分别测定重组CqCBDA的比酶活力,通过Sigma plot软件计算其动力学常数,动力学拟合曲线如图8。CqCBDA的Vmax和Km分别为11.69 U·mg-1和3.90 mmol·L-1,计算可得Kcat和Kcat/Km分别为6.43 s-1和1.64 (s·mmol·L-1)-1。CmCBDA的Km值为(48±18)mmol·L-1[25],相比于CmCBDA,CqCBDA与底物GlcNAc的亲和力更高,更有利于酶催化反应的进行。
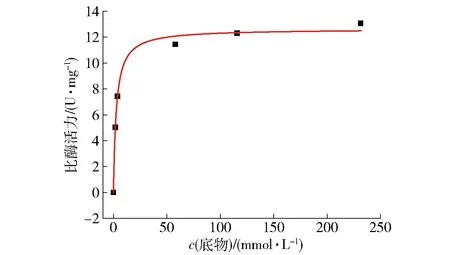
图8 重组CqCBDA的酶促反应动力学方程拟合曲线Fig.8 Enzymatic reaction kinetic equation fitting curve of recombinant CqCBDA
2.4.5金属离子对重组CqCBDA酶活力的影响
金属离子通常作为辅因子参与到生物催化反应过程,或者参与到酶高级结构的稳定化中,因而金属离子对酶活力影响的考察对于指导生物催化剂的制备和稳定化具有重要的意义。不同的金属离子对于重组CqCBDA酶活力的影响,实验结果如表1。表1显示:Co2+、Cu2+、Zn2+对酶活力有显著的抑制作用,其他金属离子影响较小,EDTA对CqCBDA的酶活力影响也不大。结果表明:CqCBDA不是金属依赖型酶,也不严格依赖某种金属离子。

表1 金属离子和EDTA对重组CqCBDA酶活力的影响Tab.1 Effects of metal ions and EDTA on activity ofrecombinant CqCBDA
3 结 论
GlcN具有多种生理活性,N-乙酰氨基葡萄糖脱乙酰酶作为酶法绿色制备GlcN中具有重要意义的水解酶,受到广泛关注。本研究筛选得到了具有N-乙酰氨基葡萄糖脱乙酰酶活性的卡西氏菌Cyclobacteriumqasimii来源的脱乙酰酶(CqCBDA),并通过构建系统进化树和序列相似性比对分析,推断其应归属于Ydjc家族。利用基因工程的手段将CqCBDA在E.coliBL21(DE3)中进行异源表达,成功得到可溶性重组CqCBDA。酶学性质研究表明:CqCBDA的最适反应温度为40 ℃,最适pH值为7.6,能在温和条件下选择性催化GlcNAc生产GlcN,可减少反应过程中GlcN因褐变而导致的损失;在温度低于40 ℃的条件下,CqCBDA能保持90%以上的相对酶活力,具有良好的稳定性,金属离子对其酶活性的影响较小。CqCBDA具有酶法生产制备GlcN的应用潜力,希望能为GlcN的酶法制备提供理论依据。

