体外模拟人肠道微生物对葡萄酒花色苷稳定性的影响
刘杨洁,白晓璇,吴璐璐,刘 洋,韩富亮
(1.西北农林科技大学 葡萄酒学院/陕西省葡萄与葡萄酒工程技术研究中心, 陕西 杨凌 712100;2.西北农林科技大学 合阳葡萄试验示范站, 陕西 合阳 715300)
花色苷是一种天然的可食用水溶性色素,广泛分布在水果和蔬菜及其相应的食品中。研究表明:花色苷具有抗氧化、抗炎、抗肿瘤、抗菌、心血管保护、神经保护、调节血脂、改善肥胖、修复DNA损伤等多种有益健康的生理活性功能[1-3]。
红葡萄酒含有丰富的花色苷,新红葡萄酒中游离花色苷质量浓度在100~2 000 mg·L-1[4-5]。根据其结构,可将欧亚种红葡萄酒花色苷分为基本花色苷、酰化花色苷、吡喃花色苷和花色苷衍生物(包括寡聚花色苷和多聚花色苷)[6],其中含量最多的花色苷为二甲花翠素-3-O-葡萄糖苷及其相应的乙酰化和香豆酰化葡萄糖苷[7-9]。红葡萄酒花色苷含量受品种、风土、栽培技术、酿造工艺、陈酿等因素影响[5, 10-12]。
研究表明:多数花色苷的生物可利用度很低[13],花色苷的生物利用率与其在消化系统中的稳定性关系密切。胃肠道理化环境(如pH值、温度等)影响花色苷的稳定性,在胃部酸性pH条件下,花色苷比较稳定,而在肠道碱性pH条件下,花色苷易降解产生更小分子的酚酸和醛等产物[14-15]。
肠道微生物是影响花色苷稳定性的重要因素[16-17]。人体肠道微生物主要分布在大肠,以细菌为主,且99%以上为厌氧菌,大肠中的微生物种类有500种之多,数量可达3.9×1013(以体重70 kg计算)[17]。
肠道微生物对葡萄酒花色苷稳定性的影响尚不完全明确。本研究采用体外方法培养人体肠道微生物,将赤霞珠红葡萄酒与肠道微生物混合培养,分析花色苷含量变化,研究肠道微生物对花色苷稳定性的影响,比较花色苷结构与稳定性的关系,为花色苷的消化吸收提供理论和数据支撑,为提高葡萄酒中高稳定性花色苷从而提高其生物利用率提供指导。
1 材料与方法
1.1 材料与试剂
厌氧培养基LA0740,北京索莱宝科技有限公司;磷酸盐缓冲溶液(phosphate buffer solution,PBS),以十二水合磷酸氢二钠、磷酸二氢钾、氯化钾、氯化钠配制,试剂分别购自北京索莱宝科技有限公司和广州市金华大化学试剂有限公司;无水乙醇,成都市科隆化学品有限公司;氢氧化钠,广州市金华大化学试剂有限公司;乙腈、甲醇,色谱级,安徽时联特种溶剂股份有限公司;甲酸、乙酸,色谱级,天津科密欧化学试剂有限公司。二甲花翠素-3-O-葡萄糖苷,纯度≥95%, Sigma-Aldrich(上海)贸易有限公司。
1.2 葡萄酒样品
实验用酒样为新疆产的赤霞珠红葡萄酒(2015年),基本理化指标见表1。
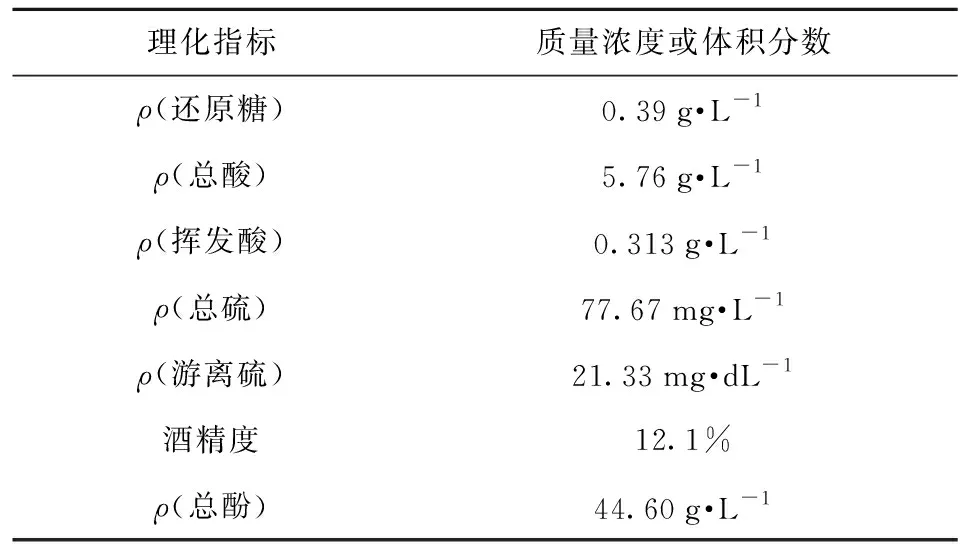
表1 赤霞珠葡萄酒样理化指标Tab.1 Physicochemical compositions ofCabernet Sauvignon wine
1.3 仪器与设备
YOX- Ⅱ型厌氧培养箱,上海跃进医疗器械有限公司;SW- CJ- 1FD型超净工作台,苏州安泰空气技术有限公司;TGL- 18M型台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;LC- 20A型高效液相色谱仪,日本岛津公司;SX- 700型全自动高压蒸汽灭菌锅,日本TOMY公司;FD- 1C- 50型真空冷冻干燥机,北京博医康实验仪器有限公司;BT25S型万分之一分析天平,北京赛多利斯科学仪器有限公司;DCG- 9140A型电热恒温鼓风干燥箱,上海森信实验仪器有限公司。
1.4 实验方法
1.4.1肠道菌群培养液的制备
参考Hidalgo等[18],略做修改。采集肠道状况稳定良好,至少3个月未服用过抗生素类药物的健康志愿者的粪便,实验当天现场采集,立即使用。样品称重后用PBS(pH值7.4)以m(粪便)∶V(PBS)=1 g∶9 mL比例制成混悬液,过滤后600 g、37 ℃条件下离心5 min。收取上清液,用无菌厌氧培养基以V(上清液)∶V(厌氧培养基)=1 mL∶9 mL比例混匀,37 ℃厌氧条件下避光无菌培养,模拟人体肠道菌群环境。
1.4.2模拟消化葡萄酒花色苷和二甲花翠素-3-O-葡萄糖苷实验
红葡萄酒样品经冷冻干燥制成干粉,用肠道菌群培养液溶解并稀释至原酒花色苷浓度的二分之一作为处理组,对照组酒样干粉使用灭菌的肠道菌群培养液溶解稀释,37 ℃厌氧环境中避光培养24 h,分别于0、4、12、24 h取样5 mL,3 000 r/min、4 ℃条件下离心10 min,上清液经0.22 μm孔径过滤后进行花色苷的高效液相色谱分析。
以二甲花翠素-3-O-葡萄糖苷为标准品,将其与肠道菌群培养液混合,分别制成二甲花翠素-3-O-葡萄糖苷质量浓度为50、10 mg·L-1的标准品处理组1、标准品处理组2,以含有相同浓度二甲花翠素-3-O-葡萄糖苷的无菌培养体系为标准品对照组1、标准品对照组2,培养条件、取样方法同葡萄酒花色苷。
1.4.3花色苷的高效液相色谱分析
参照Yang等[14]的方法,采用高效液相色谱进行分析。
色谱柱:Kromasil 100-5-C18(250 mm×4.6 mm×5 μm)。流动相A为V(超纯水)∶V(乙腈)∶V(甲酸)=8∶4∶1;流动相B为V(超纯水)∶V(乙腈)∶V(甲酸)=4∶4∶1。洗脱程序为0~45 min,0%~35% B;45~46 min,35%~100% B;46~50 min,100% B;50~51 min,100%~0% B;51~55 min,0% B。进样量20 μL;流速1.0 mL/min;柱温35 ℃;检测波长520 nm。
HPLC结果参考文献[14, 19-21],根据保留时间与最大吸收波长,确定各峰代表的花色苷种类,以二甲花翠素-3-O-葡萄糖苷为标准品,对样品中的花色苷进行定量。
1.5 数据处理
采用SPSS 20.0 软件对数据进行ANOVA分析,Origin Pro 9.1 绘制花色苷含量的动态变化图。
2 结果与分析
2.1 葡萄酒中花色苷的分析结果
用高效液相色谱检测葡萄酒样品,共检测出9种花色苷,谱图和含量分析见图1和表2。由分析可知,其中包括5种基本花色苷和4种酰化花色苷,总质量浓度为150.51 mg·L-1。其中,二甲花翠素-3-O-葡萄糖苷含量最高,占总花色苷质量分数的56.00%。酰化花色苷中,二甲花翠素-3-O-(6-O-乙酰基)-葡萄糖苷含量最高,占总花色苷质量分数的19.89%。

1,花翠素-3-O-葡萄糖苷;2,花青素-3-O-葡萄糖苷;3,3′-甲花翠素-3-O-葡萄糖苷;4,甲基花青素-3-O-葡萄糖苷;5,二甲花翠素-3-O-葡萄糖苷;6,甲基花青素-3-O-(6-O-乙酰基)-葡萄糖苷;7,二甲花翠素-3-O-(6-O-乙酰基)-葡萄糖苷;8,甲基花青素-3-O-(6-O-反式-对香豆酰基)-葡萄糖苷;9,二甲花翠素-3-O-(6-O-反式-对香豆酰基)-葡萄糖苷。图1 赤霞珠葡萄酒花色苷的液相色谱Fig. 1 HPLC chromatography of anthocyanins in Cabernet Sauvignon red wine

表2 赤霞珠葡萄酒花色苷分析结果Tab.2 Analysis of anthocyanins in Cabernet Sauvignon red wine
2.2 肠道微生物对葡萄酒花色苷稳定性的影响
2.2.1肠道微生物对总花色苷稳定性的影响
图2为肠道菌群处理组和对照组在24 h内葡萄酒总花色苷含量的变化。无菌条件下总花色苷的降解率为9.57%,而模拟肠道菌群作用下,花色苷降解率约为前者的2倍,达到19.10%,两者具有显著差异(P<0.05),这说明肠道菌群可显著地促进花色苷的降解。
葡萄酒花色苷在模拟肠道菌群条件下0~4 h的降解速率最大,达到10.74%,与花色苷体外共培养研究中,多数花色苷在前5 h有最大降解水平的结果相符[18],这可能与肠道微生物在前期分泌的葡萄糖苷酶活性有关[22-24]。

不同字母表示差异显著(P<0.05)。图2 肠道菌群作用24 h葡萄酒总花色苷质量浓度变化Fig.2 Mass concentration changes of total anthocyanins in wine within 24 h incubation with gut microbiota
2.2.2肠道微生物对基本花色苷稳定性的影响
葡萄酒中5种基本花色苷在肠道菌群作用24 h内的含量变化如图3。经过24 h,花翠素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷、3′-甲花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷的质量浓度分别下降35.85%、5.60%、27.20%、18.82%、15.33%,肠道菌群促进了5种基本花色苷的降解,但方差分析表明,对照组和处理组的降解水平没有显著差异。
不同字母表示差异显著(P<0.05)。图3 肠道菌群作用24 h葡萄酒5种基本花色苷质量浓度变化Fig.3 Mass concentration changes of five basic anthocyanins in wine within 24 h incubation with gut microbiota
基本花色苷降解率的排序由高到低依次为花翠素-3-O-葡萄糖苷、3′-甲花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷,表明花色苷结构的B环影响肠道微生物对基本花色苷的作用。随着花色苷B环上羟基数量的增加,花色苷降解水平提高,而甲氧基数量的增加有助于稳定花色苷结构,缓解微生物对花色苷的分解。这可能与肠道微生物具有较强的脱羟基作用有关[25-26],但具体机制仍需进一步验证。花青素-3-O-葡萄糖苷含有羟基,但降解水平最低,对照组甚至出现含量上升的情况,可能与其本身含量较少出现误差导致,也可能是花色苷在微生物作用下发生结构之间的转换形成了少量的花青素-3-O-葡萄糖苷,如花翠素-3-O-葡萄糖苷脱羟基,或其他基本花色苷脱甲氧基或甲基形成花青素-3-O-葡萄糖苷[16-17,27]。
2.2.3肠道微生物对酰化花色苷稳定性的影响
葡萄酒中4种酰化花色苷在肠道菌群作用24 h内的含量变化如图4。经过24 h,甲基花青素-3-O-(6-O-乙酰基)- 葡萄糖苷、二甲花翠素-3-O-(6-O-乙酰基)-葡萄糖苷、甲基花青素-3-O-(6-O-反式- 对香豆酰基)-葡萄糖苷、二甲花翠素-3-O-(6-O-反式- 对香豆酰基)- 葡萄糖苷的质量浓度分别下降20.69%、19.53%、29.30%、28.07%。除甲基花青素-3-O-(6-O-反式- 对香豆酰基)- 葡萄糖苷外,与对照组相比,肠道微生物显著促进酰化花色苷降解(甲基花青素-3-O-(6-O-乙酰基)- 葡萄糖苷、二甲花翠素-3-O-(6-O-反式- 对香豆酰基)- 葡萄糖苷,P<0.01;二甲花翠素-3-O-(6-O-乙酰基)- 葡萄糖苷,P<0.05)。

不同字母表示差异显著(P<0.05)。图4 肠道菌群作用24 h葡萄酒4种酰化花色苷质量浓度变化Fig.4 Mass concentration changes of four acylated anthocyanins in wine within 24 h incubation with microbiota
对比甲基花青素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷及其酰化衍生物在肠道菌群作用下的降解率,酰基化降低花色苷结构的稳定性[14],肠道微生物可能优先进行花色苷糖基的去酰基化作用,但具体机制需进一步研究。当母体结构相同时,乙酰化花色苷比反式香豆酰化花色苷更稳定;当酰化结构相同时,花色苷的稳定性与其B环结构有关。
2.3 肠道微生物体对二甲花翠素-3-O-葡萄糖苷稳定性的影响
二甲花翠素-3-O-葡萄糖苷与肠道菌群共培养24 h内的含量变化如图5。肠道微生物作用24 h后,高浓度与低浓度组的二甲花翠素-3-O-葡萄糖苷均完全降解,而无菌条件下的降解率分别为63.86%和65.07%,肠道微生物显著促进二甲花翠素-3-O-葡萄糖苷的降解(高浓度P<0.01;低浓度P<0.05)。二甲花翠素-3-O-葡萄糖苷标准品的降解主要发生在4~12 h,标准品几乎在前12 h完全降解,降解速度和降解水平快于、高于葡萄酒样品中的二甲花翠素-3-O-葡萄糖苷,这表明:不同花色苷之间可能存在相互作用或者葡萄酒存在基质效应,从而影响肠道微生物对花色苷的降解,具体机制需要进一步研究。
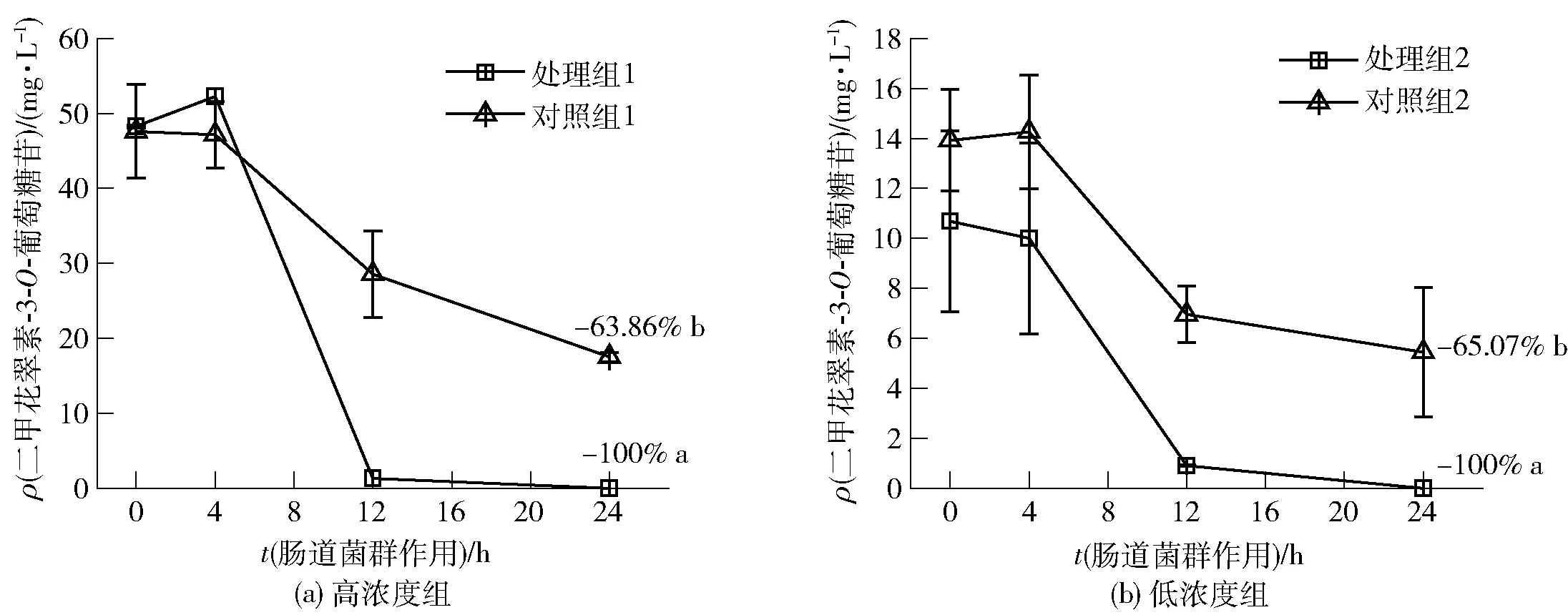
不同字母表示差异显著(P<0.05)。图5 肠道菌群作用24 h二甲花翠素-3-O-葡萄糖苷标准品质量浓度变化Fig.5 Mass concentration changes of malvidin-3-O-glucoside within 24 h incubation with gut microbiota
3 结 论
肠道微生物对葡萄酒中9种花色苷的降解具有促进作用。花色苷的B环结构与酰化类型影响肠道菌群的分解作用。花色苷的降解水平随其B环羟基数量的增加而提高,随甲氧基数量的增加而降低;肠道微生物对酰化花色苷的降解作用更强,乙酰化花色苷比反式香豆酰化花色苷更稳定。相比于二甲花翠素-3-O-葡萄糖苷标准品,葡萄酒样品中的二甲花翠素-3-O-葡萄糖苷降解更缓慢,降解水平更低,花色苷之间可能存在影响肠道菌群降解花色苷的相互作用或葡萄酒存在基质效应。肠道微生物是影响葡萄酒花色苷在人体内稳定性的重要因素,对其作用机制进一步研究,有助于了解花色苷在人体结肠的消化吸收规律,指导提高花色苷人体生物可利用率的探究。

