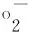低共熔溶剂提取黄精多糖工艺优化及抗氧化活性研究
汪 涛,周新群,孙君社,2,张志民,2,王民敬,2,胡雪芳,2,裴海生,2,*
(1.农业农村部规划设计研究院 农产品加工工程研究所, 北京 100121;2.农业农村部农产品产后处理重点实验室, 北京 100121;3.贵州大学 酿酒与食品工程学院, 贵州 贵阳 550025)
黄精(Polygonatumsibiricum,PS)是我国首批进入药食同源目录的中药品种,富含多糖、黄酮、多酚、蒽醌、甾体皂苷、生物碱和人体所需的多种氨基酸等重要的活性成分[1]。黄精多糖(Polygonatumsibiricumpolysaccharides,PSPs)是黄精的主要活性成分之一,具有抗氧化[2]、抗衰老[3]、抗疲劳[4]、增强免疫[5]、治疗糖尿病[6]和预防老年痴呆[7]等作用。Long等[8]用生理盐水和PSPs溶液分别处理荷瘤小鼠,发现PSPs通过激活TLR4受体来阻碍肺癌MAPK/NF-kB信号通路,发挥免疫增强作用,表明PSPs未来有可能用于预防肺癌的发生。
目前,PSPs提取技术主要集中在热水浸提、碱提、酶解、微波和超声波辅助提取等,但美中不足的是这些技术存在能耗大、效率低、价格昂贵和污染环境等诸多问题,最关键的是它们很难应用于大批量的工业化生产[9-10]。为了解决这些问题,需要开发一种新型的提取方法。低共熔溶剂(deep eutectic solvents,DESs)是由氢受体与氢供体按合适比例混合加热形成的液态混合溶剂,其凝固点比任何一种配位剂都要低,具有不易挥发、价格低、毒性小、绿色环保、容易制备、不需要纯化等优势,更重要的是它可以适用于工业化生产[11-14]。目前,DESs的应用主要集中在化工方面,在药食方面相对较少。Tang等[15]应用DESs提取白柏中黄酮类化合物,与热水浸提法相比较,黄酮类化合物槲皮素、杨梅素和穗花杉双黄酮提取率分别增加了128.7%、111.7%和111.1%。Chanioti等[16]选取DESs中氯化胆碱- 柠檬酸(DES-CA)和胆碱氯化物- 乳酸(DES-LA)分别提取橄榄渣中酚类化合物,发现DES-CA提取的总酚含量和抗氧化活性均高于均质化、微波、超声波和高静水压力辅助等提取方法。DESs除了提取黄酮、酚类物质的应用外,已有提取多糖方面的相关报道,如Saravan等[17]利用DESs结合亚临界水提取褐藻多糖,结果表明在150 ℃、1.99 kPa,含水量70%及液料比36.81 mL/g条件下,褐藻多糖的提取率为14.93%。DESs之所以能够增加植物活性物质溶出,可能与其自身的理化性质有关,DESs黏度低且呈弱酸性;黏度低的溶液有很好的渗透能力,再者弱酸性溶液有辅助分解植物细胞壁木质素及纤维素的作用[18]。但到目前为止,未见其应用于提取PSPs的报道。因此,本研究利用DESs提取PSPs,通过响应面分析优化提取工艺,并通过总抗氧化能力试剂盒法、1,1-二苯基-2-三硝基苯肼(DPPH)法和邻苯三酚自氧化法对其抗氧化活性进行研究,以期为PSPs工业化提取和功能性研究提供理论指导。
1 材料与方法
1.1 材料与试剂
黄精(Polygonatumsibiricum),辽宁澳地森生物工程有限公司。
氯化胆碱,上海国药控股化学试剂有限公司;乙二醇、柠檬酸、丙三醇、尿素、草酸、浓硫酸、苯酚、邻苯三酚、1,1-二苯基-2-苦肼基(DPPH)自由基、抗坏血酸,国药集团化学试剂有限公司;总抗氧化能力测定试剂盒,南京建成生物工程研究所。所有试剂均为国产分析纯。
1.2 仪器与设备
UV- 1780型紫外可见分光光度计,岛津仪器(苏州)有限公司;GM- 0.5型隔膜真空泵,天津市津腾实验设备有限公司;HWS- 26型电热恒温水浴锅,苏州江东精密仪器有限公司;RE- 52B型旋转蒸发仪,上海上自仪转速表仪表电机有限公司;AR223CN型电子天平,奥豪斯(常州)仪器有限公司;H1850型台式离心机,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1PSPs提取方法与测定
热水浸提法[19]:称取0.2 g黄精粉(80目),在温度80 ℃、液料比1.5 mL/g的条件下提取120 min,重复提取2次得到黄精多糖。
DESs提取法:称取0.2 g黄精粉(80目)与DESs混匀,水浴提取。待提取结束后,加5.0 mL蒸馏水终止反应。真空抽滤,收集滤液,蒸发浓缩,加入无水乙醇至最终含量为80%,静置醇沉2 h,7 000 r/min离心8 min得到粗多糖。
提取实验均重复3次,采用苯酚- 硫酸法[23]测定PSPs含量。葡萄糖标准曲线:y=0.008 2x+0.028 3,R2=0.999 1。按式(1)计算PSPs提取率:
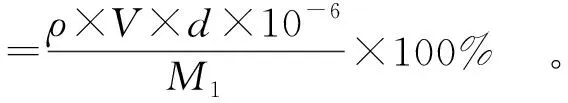
(1)
式(1)中,ρ,PSPs水溶液质量浓度,μg/mL;V,PSPs水溶液体积,mL;d,稀释倍数;M1,样品干质量,g。
1.3.2DESs配位剂对PSPs提取率的影响
将乙二醇- 氯化胆碱(DES-EC)、柠檬酸- 氯化胆碱(DES-GC)、丙三醇- 氯化胆碱(DES-CC)、尿素- 氯化胆碱(DES-UC)、草酸- 氯化胆碱(DES-OC)分别按氢受体与氢供体物质的量比2.0混匀,在100 ℃水浴至溶解。在温度80 ℃、液料比20 mL/g、时间30 min条件下,按1.3.1实验步骤分别提取PSPs并计算提取率。
1.3.3单因素实验设计
在DESs配位剂筛选结果的基础上,分别选取DESs配位剂物质的量比(1.0、1.5、2.0、2.5、3.0)、温度(70、80、90、100、110 ℃)、时间(15、30、45、60、75 min)和液料比(10、20、30、40、50 mL/g)进行单因素实验,考察各因素对PSPs提取效果的影响,按1.3.1节实验步骤分别提取PSPs并计算提取率。
1.3.4响应面优化试验
在单因素实验的基础上,确定最适温度,并利用响应面分析法对其余3个因素进一步优化。根据Box-Behnken试验设计原理,选取尿素- 氯化胆碱物质的量比(A)、时间(B)及液料比(C)3个因素为自变量,以PSPs提取率为响应值,进行三因素三水平的响应面分析,优化PSPs的提取工艺,试验因素与水平设计见表1。
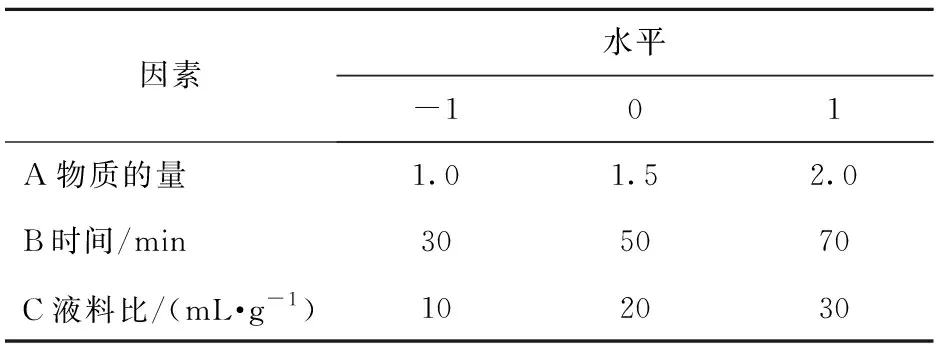
表1 响应面试验因素与水平Tab.1 Factors and levels of Box-Behnken design
1.3.5DESs重复利用实验
按照1.3.1节DESs提取PSPs方法,将醇沉离心得到的上清液真空蒸发至体积不变以回收DESs,根据1.3.4得到的优化工艺条件重复利用DESs提取PSPs,按式(1)、式(2)计算PSPs提取率和含量。
(2)
式(2)中,ρ,PSPs水溶液含量,μg/mL;V,PSPs水溶液体积,mL;d,稀释倍数;M2,粗多糖干质量,g。
1.3.6PSPs抗氧化活性测定
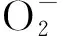

(3)
式(3)中,A0,蒸馏水代替样品的吸光度;Ax0,蒸馏水代替邻苯三酚的吸光度;Ax,样品的吸光度。
1.3.6.2 DPPH自由基清除率的测定
取2.0 mL不同质量浓度的PSPs与2.0 mL 0.2 mmol/LDPPH溶液混匀,暗反应30 min,蒸馏水调0,在波长517 nm处测定吸光度(Ax);同样测定2.0 mL 0.2 mmol/L DPPH溶液与2.0 mL 体积分数70%乙醇溶液的吸光度(A0),以及2.0 mL不同质量浓度的PSPs与70%乙醇溶液的吸光度(Ax0)[21]。按式(4)计算DPPH自由基清除率。
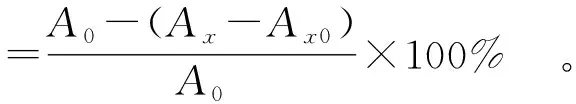
(4)
1.3.6.3 总抗氧化能力测定
根据总抗氧化能力测定试剂盒操作步骤测定不同质量浓度的PSPs总抗氧化能力[22]。按式(5)计算PSPs的总抗氧化能力。
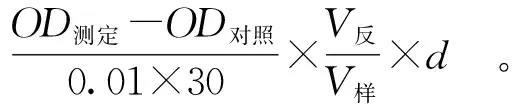
(5)
式(5)中,总抗氧化能力,μg/mL;V反,反应液体积,mL;V样,取样液体积,mL;d,稀释倍数。
1.4 数据处理
采用Design Expert 8.0.6、Origin 2017和SPSS 19对实验数据进行处理。
2 结果与分析
2.1 DESs配位剂对PSPs提取率的影响分析
DESs选择不同的配位剂结合,可以得到具有特定理化性质的溶剂。根据配位剂的性质可以将DESs分为3种类型:I类由季铵盐和MClx形成,该类与金属卤化物/咪唑盐体系类似;Ⅱ类由水合金属卤化物与氯化胆碱形成;Ⅲ类由氢受体与氯化胆碱组成,氢受体通常是酰胺、羧酸或醇[11,23]。Ⅰ、Ⅱ类具有金属离子性质,不适合在药食方面的应用,这里主要考察Ⅲ类DESs,在此基础上选择乙二醇- 氯化胆(DES-EC)、柠檬酸- 氯化胆碱(DES-GC)、丙三醇- 氯化胆碱(DES-CC)、尿素- 氯化胆碱(DES-UC)、草酸- 氯化胆碱(DES-OC)作为提取PSPs的研究对象。这5种DESs按物质的量比2.0混合溶解,在温度80 ℃、液料比20 mL/g条件下,提取PSPs 30 min,结果如图1。DES-UC对PSPs提取效果最好,多糖提取率为15.11%。与热水浸提得到的PSPs提取率(7.73%)进行比较,PSPs提取率由大到小依次为DES-UC、 DES-OC、 DES-CC、 DES-GC、DES-EC、热水浸提。引起PSPs提取效果差异的原因一方面可能是DESs的理化性质,如黏度、极性和溶解度不同;另一方面可能是DESs与PSPs之间的键能和静电作用[24]。根据实验结果,选择DES-UC作为后续的研究对象。
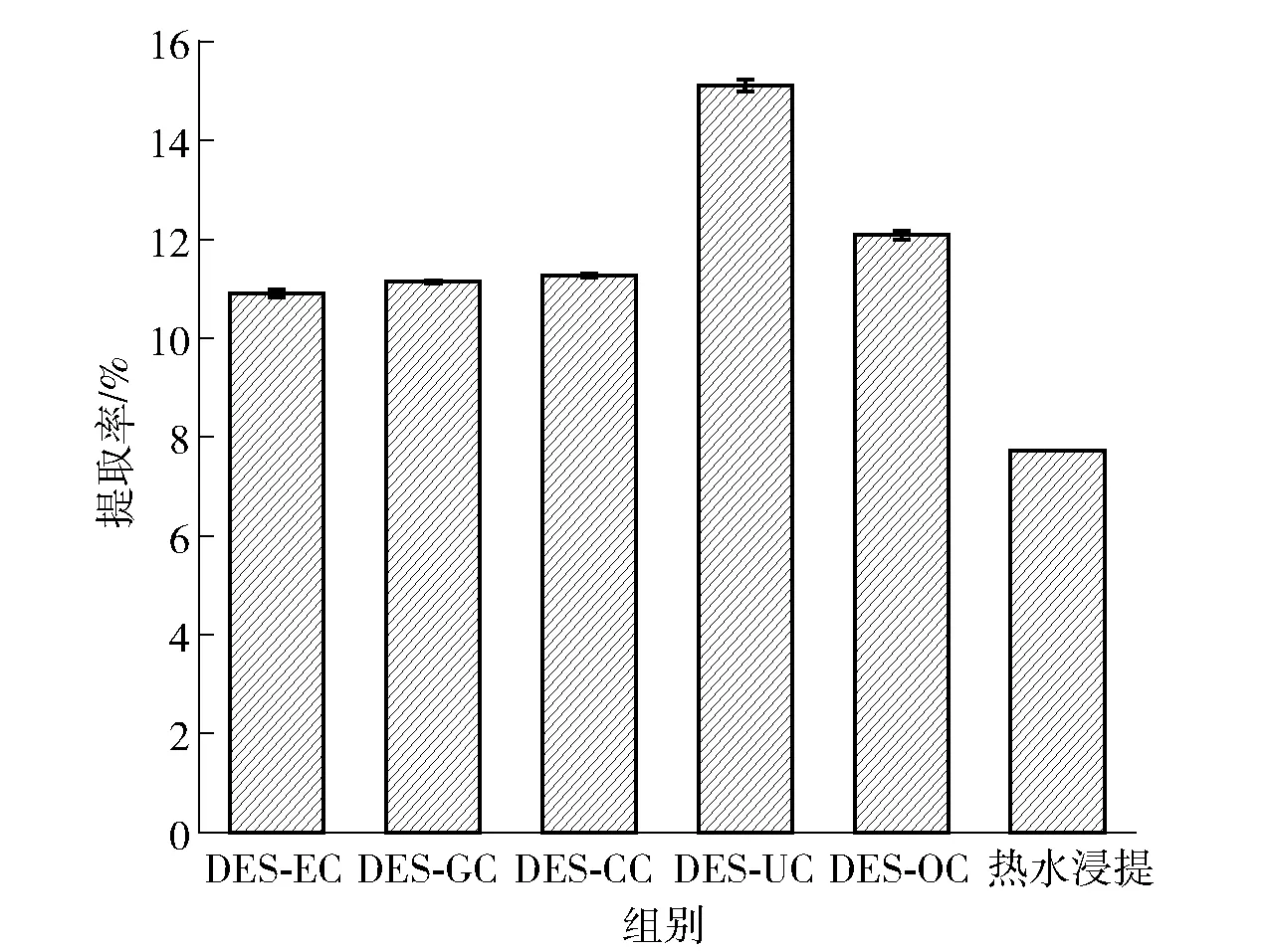
图1 DESs配位剂对PSPs提取率的影响Fig.1 Effect of DESs complexing agent on extraction rate of PSPs

图2 不同因素对PSPs提取率的影响Fig.2 Effect of different factors on extraction rate of PSPs
2.2 单因素实验结果
PSPs的单因素实验结果见图2。当尿素- 氯化胆碱物质的量比小于1.0时,液态DESs迅速凝固无法与黄精粉混合均匀,不利于PSPs的提取,所以选取物质的量比1.0、1.5、2.0、2.5、3.0为研究参数。由图2(a)可知,PSPs提取率随物质的量比的增加而减小,与DESs特定的理化性质,如酸碱度、溶解度和黏度等对黄精细胞壁的影响有关[17,25]。所以本实验选取尿素- 氯化胆碱物质的量比1.0作为后续研究参数。
当温度低于70 ℃时,DESs无法形成液态溶剂,所以选取温度70、80、90、100、110 ℃为研究参数。由图2(b)可知,PSPs提取率随温度的升高而降低,可能是温度过高使PSPs发生了降解,而且温度对DESs的黏度、导电率和酸碱度等性质也有影响。所以本实验选取温度70 ℃作为后续研究参数。
由图2(c)可知在一定的时间范围内,PSPs提取率随时间的增加而增加;当达到一定时间后,反应体系达到平衡,PSPs提取率随之降低,可能是提取时间过长使多糖分子发生了过度降解。PSPs提取率在60 min时达到最大值,所以本实验选取时间60 min作为后续研究参数。
由图2(d)可知,PSPs提取率随液料比增加呈先增加后下降的趋势,出现这种趋势与DESs的作用程度、黏度有关。液料比过大时,物质间相互作用力太小,使多糖溶出率降低,且过多的溶剂体积会对后续的处理造成困难,增加了工艺的成本;液料比过小使黏度增大,多糖分子截留在DESs中,降低了PSPs提取率。液料比为20 mL/g时,PSPs提取反应体系达到平衡,提取率最大,所以本实验选取液料比20 mL/g作为后续研究参数。
2.3 响应面试验结果
2.3.1响应面试验设计与结果
在单因素实验结果的基础上,设计了三因素三水平的响应面试验。17组试验方案及结果见表2。
2.3.2模型建立与方差分析


表2 响应面试验设计与结果Tab.2 Design and results of response surface experiment
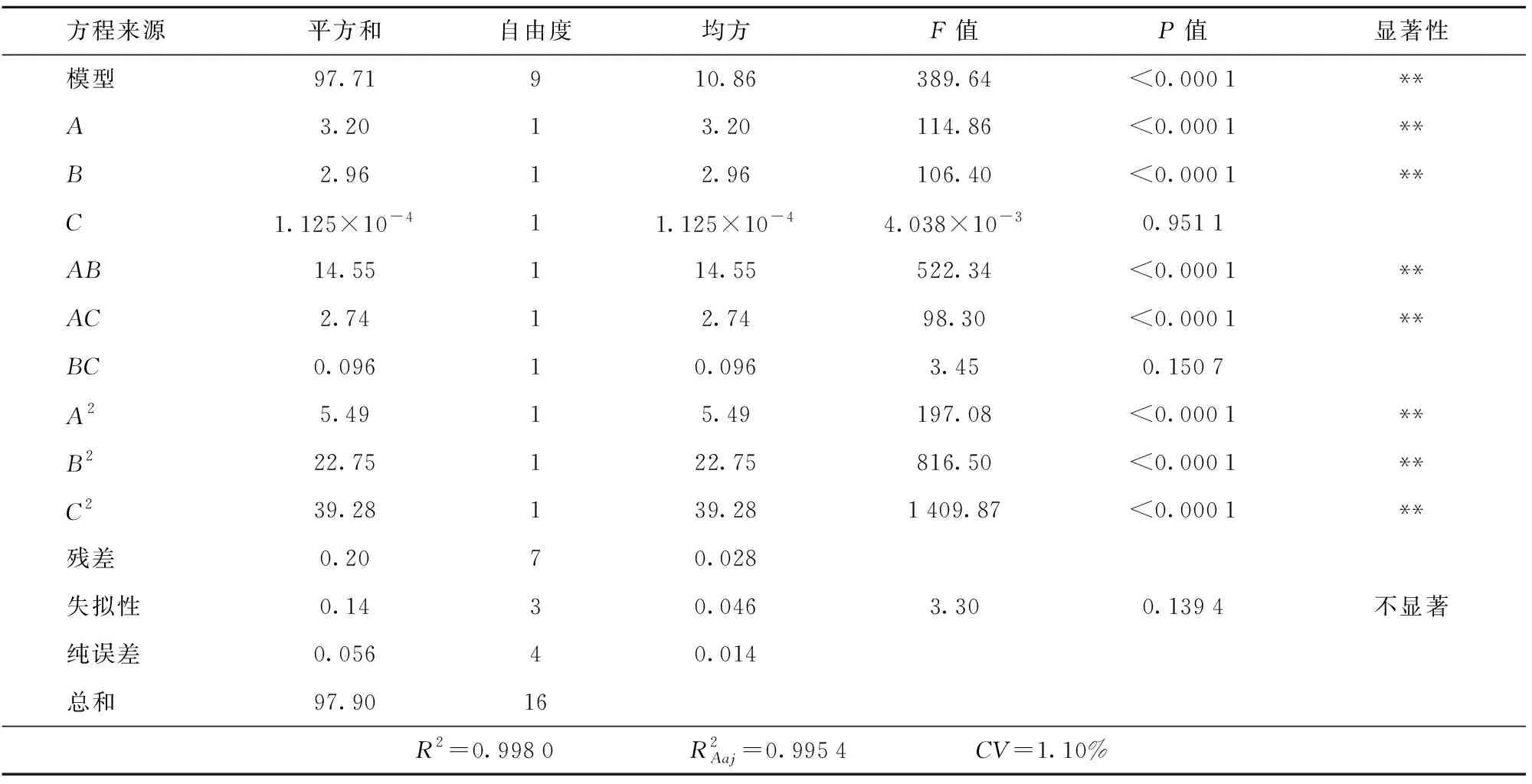
表3 回归方程的方差分析Tab.3 Analysis of variance for regression equation
2.3.3响应面分析
利用Design Expert 8.0.6软件对表2中的数据进行二次多元回归拟合,所得到的二次回归方程的响应面如图3。等高线图可以直观地反映自变量交互作用的显著性,圆形表示两者交互作用不显著,而椭圆形则表示显著。
由图3可知,时间和物质的量比交互作用的等高线呈椭圆形,表明两者交互作用对PSPs提取率有极显著影响;从三维图可以看出,随物质的量比和时间的增加,PSPs提取率呈先增大后减小的趋势。物质的量比与液料比相互作用的等高线呈椭圆形,表明两者相互作用极显著;从三维图可以看出,随物质的量比和液料比的增加,PSPs提取率呈先增加后减小的趋势。液料比与时间相互作用的等高线几乎呈圆形,表明两者相互作用不显著,这与方差分析结果一致,从三维图可以看出,响应面曲线坡度较为陡峭,表明液料比和时间对PSPs提取率的影响均较大,随液料比与时间的增加PSPs提取率呈先增加后减小的趋势。
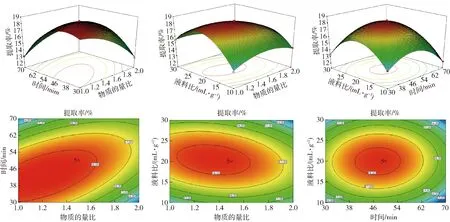
图3 各因素交互作用对PSPs提取率的影响Fig.3 Effect of interaction of different factors on extraction rate of PSPs
2.3.4响应面模型预测值验证
通过软件Design Expert 8.0.6分析得到PSPs优化提取工艺参数为物质的量比1.19、提取时间42.30 min和液料比20.75 mL/g,在此条件下PSPs提取率的预测值为18.61%。为了验证响应面结果的可靠性,对所得优化条件进行3组平行实验验证,所得PSPs提取率平均值为18.55%,与预测值接近(相对误差为2.69%),说明该模型可以准确预测PSPs提取率,优化工艺条件可靠,较传统的热水浸提增加了139.97%。
2.4 DESs重复利用对PSPs提取率及含量的影响
DESs重复使用0~5次时,PSPs提取率分别为18.81%、23.22%、23.47%、34.60%、26.23、22.34%,呈先增加后降低的趋势;在重复使用3次时PSPs提取率达到最大(见图4)。PSPs含量分别为43.25%、55.79%、56.97%、58.97%、63.48%、64.12%,呈现逐渐上升的趋势,说明PSPs纯度越来越高,充分体现了DESs经济节约、绿色环保的特点。出现以上现象可能与DESs热稳定性差有关,不断地高温反复使用,使其黏度及微观结构发生变化。在实验过程也发现重复使用的DESs物理状态发生了变化,在低温下呈液体状态,较新鲜溶剂流动性更大,但具体原因还需进一步探究。
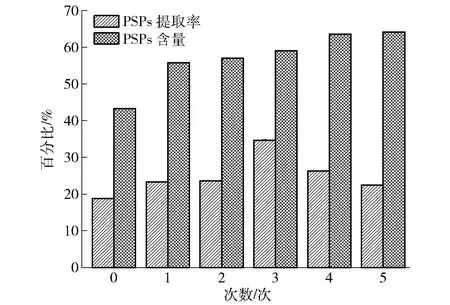
图4 重复使用DESs对PSPs提取率及含量的影响Fig.4 Effect of reuse of DESs on extraction rate and content of PSPs
2.5 PSPs的抗氧化活性分析

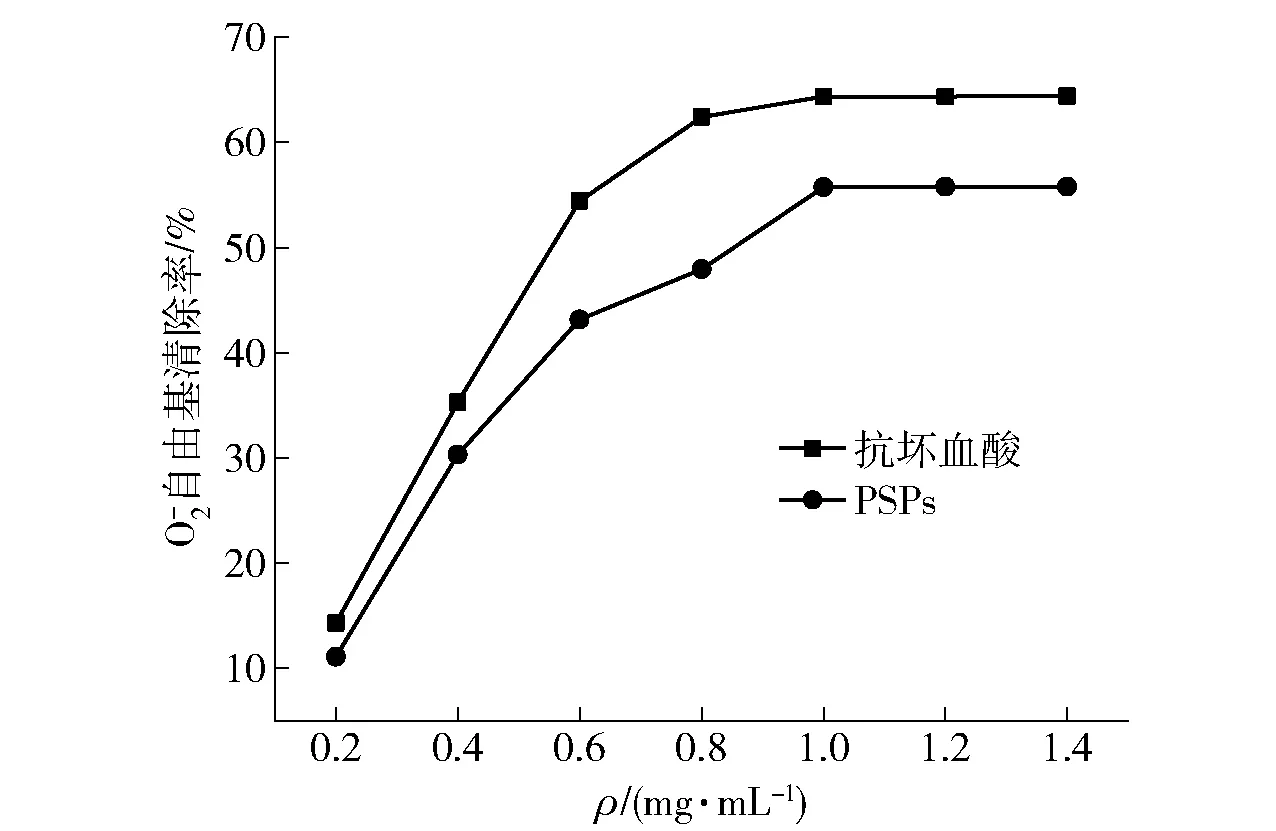
图5 PSPs对自由基清除率的影响Fig.5 Effects of PSPs on scavenging rate of free radical
2.5.2DPPH自由基清除能力分析
在测定的PSPs质量浓度范围内,DPPH自由基清除率与PSPs质量浓度具有量效关系,随质量浓度的增加而增加,说明采用DESs提取的PSPs具有一定DPPH自由基清除能力,见图6。经拟合,PSPs曲线方程为y=15.13+23.86x+8.72x2+4.86x3,R2=0.998 1,IC50=0.951 mg/mL。比较IC50可知,DESs提取的PSPs的DPPH自由基清除能力低于抗坏血酸,但显著高于传统水提醇沉法提取的PSPs的DPPH自由清除能力(IC50=19.57 mg/mL)。Zhang等[29]研究发现微波辅助处理PSPs,使其DPPH自由基清除能力增强,主要原因是清除能力最低的组分发生了降解;而DESs的性质类似于离子液,同样具有降解活性物质的能力。另外,当PSPs质量浓度为1 g/L时,DESs提取的PSPs的 DPPH自由基清除率为52.57%,而魏炜等[30]用超高压提取的PSPs的DPPH自由基清除率为34.14%,说明DESs对PSPs抗氧化能力有一定的提高。

图6 PSPs对DPPH自由基清除率的影响Fig.6 Effects of PSPs on scavenging rate of DPPH free radical
2.5.3总抗氧化能力分析
在测定的PSPs质量浓度范围内,总抗氧化能力与质量浓度具有量效关系,见图7。随质量浓度的增加,总抗氧化能力增加,0.2~1.0 mg/mL时总抗氧化能力增加较快;当质量浓度为1.4 mg/mL时,总抗氧化能力为241.2 μg/mL。PSPs的总抗氧化能力略低于同质量浓度的抗坏血酸,但仍具有一定的抗氧化能力。
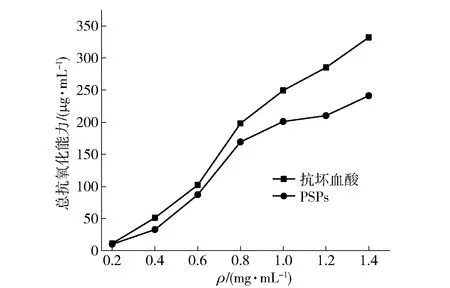
图7 PSPs的总抗氧化能力Fig.7 Total antioxidant capacity of PSPs
3 结 论