新型多巴胺荧光比率传感器构建的研究
翟 红,刘永文,宋亚萍
(山西大同大学化学与化工学院,037009)
多巴胺(dopamine,DA)是一种儿茶酚胺,对神经系统的正常运作有重要的作用。人的快乐、认知和精细运动控制均与DA 有关。DA 功能障碍是一些神经系统疾病(如帕金森病、亨廷顿病、抑郁症、精神分裂症等)的发病原,研究快速、灵敏、高选择性的多巴胺测定方法,对于生命科学、生物药物及临床检验等具有重要意义[1-2]。现有的多巴胺测定方法有比色法[3-4]、化学发光法[5]、表面增强拉曼光谱法[6-7]、电化学法[8-10]等。以上方法作为经典的检测手段被广泛应用,但是它们所需的仪器设备较昂贵,操作人员需要掌握全面的知识和技术,此外样品的前处理也很复杂,这些大大制约了它们的实用性。荧光法因其操作简单,检测速度快等,已被用于多巴胺的检测[11-13]。但只采用单一的荧光信号检测多巴胺时,由于环境、仪器等条件的改变,影响检测结果,因此,寻找合适的参比信号,构建荧光比率型传感器意义重大。我们采用谷胱甘肽作稳定剂制备荧光金簇(AuGSH),并将其与间苯二酚相结合构建了新型的荧光比率传感器用于多巴胺的准确检测。
1 实验部分
1.1 实验药品及仪器
所有试剂均为分析纯:间苯二酚购自天津市永大化学试剂有限公司;还原型谷胱甘肽(GSH)、四氯金酸三水合物(HAuCl4·3H2O)、盐酸多巴胺(DA)及三羟甲基氨基甲烷(Tris)均购自上海阿拉丁公司。主要仪器有:LS-55 荧光分光光度计(PE 公司),Lambda 35紫外分光光度计(PE 公司),ZF7-三用紫外分析仪(巩义市科瑞仪器有限公司),HC 2062 高速离心机(安徽中科中佳科学仪器有限公司),HH-2 数显恒温水浴锅(国华电器有限公司)。
1.2 实验步骤
1.2.1 荧光纳米金簇(AuGSH)的合成
将1 g HAuCl4·3H2O 溶于100 mL 超纯水中,配成浓度为0.01 g/mL 的溶液,作为贮备液。取2 mL 贮备液加入3 mL 超纯水,待用。称取0.016 9 g GSH,溶于5 mL超纯水中。将二者合并于一个干净的具塞试管(用王水浸泡24 h 后清洗烘干)中,此时HAuCl4与GSH 的摩尔比为1∶1,放置10 min,待到溶液变为无色透明,放置90 ℃的恒温水浴锅中反应7h。常温下自然冷却,加入适量无水乙醇,以10 000 r/min 离心15 min,沉淀溶于pH=7.4 的磷酸盐缓冲液(PBS)中,冷藏,备用。
1.2.2 基于间苯二酚检测多巴胺
取8 支2 mL 的离心管,加入不同浓度的盐酸多巴胺溶液(0、10、25、50、75、100、500、1 000 μmol/L)200 μL,加pH=11 的PBS 至1.8 mL,然后各加入1 mmol/L 的间苯二酚200 μL,放置反应3 min,用紫外分析仪在365 nm下观察荧光。
1.2.3 基于金簇和间苯二酚检测多巴胺
取10 支离心管,加入不同浓度的盐酸多巴胺溶液(0、10、20、40、75、100、125、150、175、200 μmol/L)50 μL,加入pH=11 的PBS 缓冲液至350 μL,再依次加入100 μmol/L 的间苯二酚50 μL,AuGSH 100 μL,使总容积为500 μL,混合均匀,放置3 min,立即测定荧光光谱。平行测定3组。
1.2.4 缓冲液的优化
取6 个离心管,分别加入不同的缓冲液(PBS pH分别为7.4、9、10、11、12;Tris pH为9)300 μL,再依次加入100 μmol/L 的盐酸多巴胺50 μL,1 mmol/L 的间苯二酚50 μL,AuGSH 100 μL,放置3 min 后,立即测定荧光光谱。平行测定3组。
1.2.5 时间的优化
取1个离心管,依次加入100 μmol/L的盐酸多巴胺50 μL,pH=11的PBS缓冲液300 μL,1 mmol/L 的间苯二酚50 μL,AuGSH 100 μL,总容积为500 μL。反应物每隔1 min测定一次荧光光谱,测至7 min。平行测定3组。
1.2.6 间苯二酚的优化
取离心管7 支,分别加入不同浓度的间苯二酚(10、300、600、1 000、2 500、5 000、10 000 μmol/L)50 μL,再依次加入100 μmol/L 的盐酸多巴胺溶液50 μL,pH=11的PBS缓冲液300 μL,AuGSH 100 μL,混合均匀,放置3 min 后,立即测定荧光光谱。平行测定3 组。
1.2.7 选择性实验
取离心管15支,加入pH=11的PBS缓冲液345 μL,60 μmol/L 的间苯二酚50 μL,AuGSH 100 μL,加入0.1 mol/L 的离子或糖类等常见干扰物溶液(空白、Na+、Mg2+、Al3+、K+、Ca2+、Fe3+、NH4+、蔗糖、乳糖、半乳糖、麦芽糖、果糖、木糖、脲酸)5 μL,混合均匀,放置3 min后,立即测定荧光光谱。平行测定3组。
2 结果与讨论
2.1 紫外吸收光谱表征与荧光表征
AuGSH在日光灯下为淡黄色澄清液体(图1 A),其紫外吸收峰位于393 nm(图2);将AuGSH置于365 nm的紫外灯下观察,发现AuGSH 显橙色荧光(图1B),其荧光峰位于588 nm(图3c)。此外,多巴胺和间苯二酚在碱性条件下可产生荧光,而且,随着多巴胺浓度的增加,其荧光强度逐渐增强(图4);将多巴胺(终浓度10 μmol/L)、间苯二酚(终浓度10 μmol/L)和AuGSH (100 μL)混合3 min 后,荧光光谱显示2 个互不干扰的荧光峰(图3d);与AuGSH荧光光谱相比,混合后金簇的荧光基本不变(图3 c,d)。因此,可将AuGSH 作为参比荧光信号,结合间苯二酚构建简单的双发射荧光比率传感器用于准确检测多巴胺。
此外,从紫外吸收光谱(图2)和荧光光谱(图3)可知,多巴胺(1 mmol/L)和间苯二酚(1 mmol/L)在380~700 nm 的范围内均无明显紫外和荧光峰,说明这两种物质不会影响多巴胺的检测。

图1 AuGSH在日光灯(A)和365nm紫外灯(B)下的照片
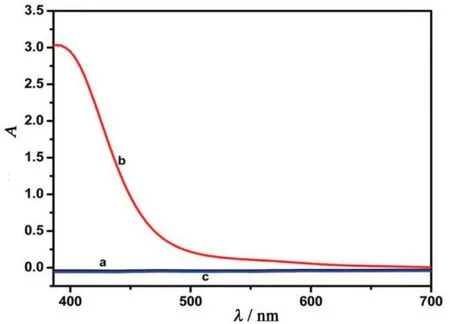
图2 多巴胺(a)、AuGSH(b)及间苯二酚(c)的紫外吸收光谱

图3 多巴胺(a)、间苯二酚(b)、AuGSH(c)及三者混合液(d)的荧光光谱
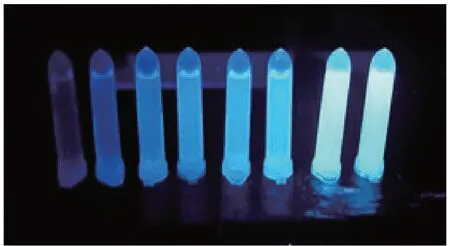
图4 间苯二酚(1 mmol/L)与不同浓度多巴胺的产物在365 nm紫外灯下的照片
2.2 基于金簇和间苯二酚检测多巴胺
间苯二酚和多巴胺的反应产物(DR)的荧光强度随着多巴胺浓度的增加而增加,而AuGSH的荧光强度基本保持不变。将AuGSH的荧光作为参比值,通过计算DR和AuGSH的荧光比率(F455/F588),并将其与多巴胺的浓度进行线性拟合,结果见图5。结果显示,荧光比率(F455/F588)和多巴胺在1~10 μmol/L 和10~20 μmol/L 2个浓度范围内呈线性相关,线性方程分别为y=0.706x+0.020及y=2.226x-16.80,相关系数(r)均大于0.98,检出限(S/N=3)为0.23 μmol/L.
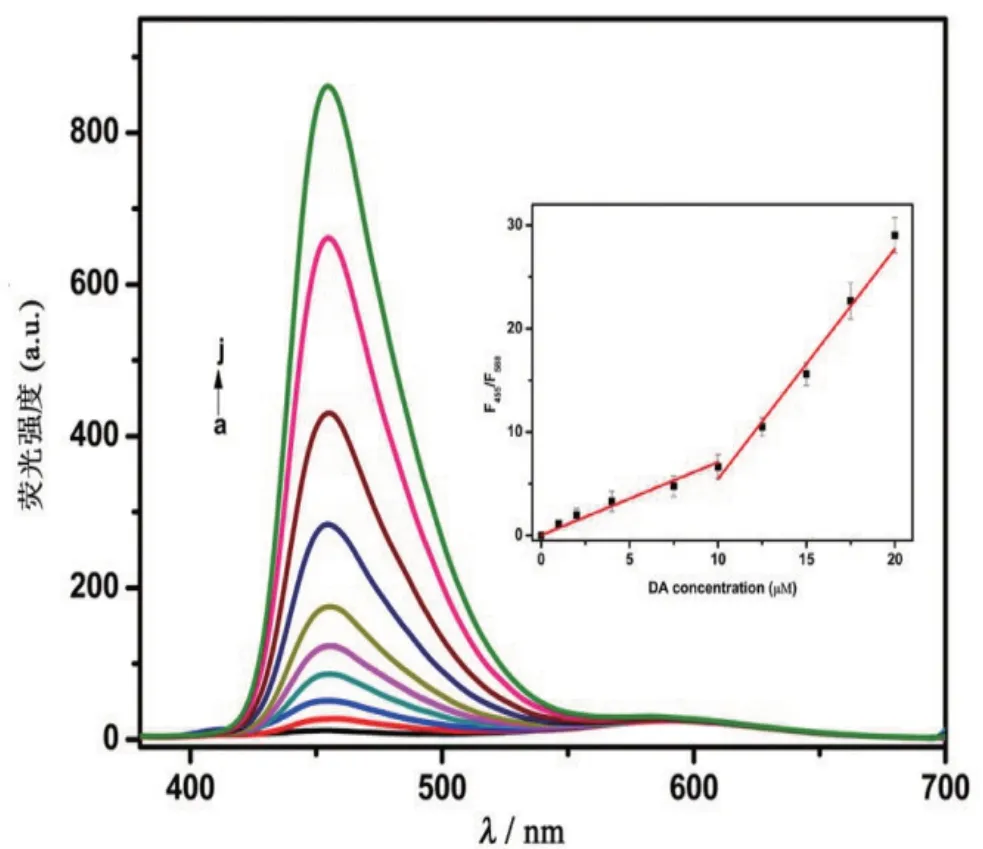
图5 检测不同浓度多巴胺时的荧光光谱图
2.3 缓冲液的优化
固定其他条件不变,选取pH=9 Tris缓冲液,pH分别为7.4、9、10、11、12 的PBS 缓冲液调节体系的酸度,以确定最佳检测条件,实验结果见图6。由图可得,随着PBS 缓冲液pH 的增大,DR 的荧光强度逐渐增大;金簇的荧光基本保持不变。当PBS 缓冲液的pH 为11 时,荧光比值F455/F588是最高的。因此,实验选择pH为11的PBS作为体系的缓冲液。

图6 金簇(100 μL)、多巴胺(10 μmol/L)和间苯二酚(100 μmol/L)混合液在不同缓冲液中的荧光光谱图
2.4 时间的优化
在对时间的优化中,固定其他条件,让其反应不同的时间(1~7 min),结果见图7。可以看出,DR 的荧光强度随着时间的增加而增加,AuGSH 的荧光强度基本保持不变,F455/F588也随着时间增加。但是,随着时间的增加,如果位于455 nm 处的荧光峰太强,导致处于588 nm 的荧光峰被遮蔽,综合考虑,反应时间选3 min为宜。

图7 在不同时间内检测多巴胺(10 μmol/L)的荧光光谱图
2.5 间苯二酚的优化
固定其他条件不变,选取不同浓度的间苯二酚(1、30、60、100、250、500、1 000 μmol/L)进行实验,结果见图8。由图可知,DR 荧光强度的总体趋势随着间苯二酚浓度的增加先升后降,在间苯二酚的终浓度达到30 μmol/L 时达到最高,AuGSH 的荧光强度基本保持不变。所以,荧光比率F455/F588也先升后降,在间苯二酚的终浓度达到30 μmol/L 时达到最高。但是,如果位于455 nm 处的荧光峰太强,会掩盖位于588 nm 处的荧光峰,综合考虑,选60 μmol/L 作为间苯二酚的最佳浓度。
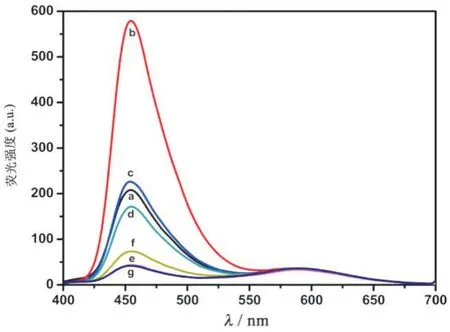
图8 优化间苯二酚浓度的荧光光谱图
2.6 选择性实验
为检验该传感器的选择性,选择常见的离子或糖等作为潜在干扰物,包括Na+、Mg2+、Al3+、K+、Ca2+、Fe3+、NH4+、蔗糖、乳糖、半乳糖、麦芽糖、果糖、木糖、脲酸,按照2.2.7 实验步骤进行测定,结果见图9。从图中可以看出,当干扰物浓度是多巴胺浓度的100倍时,检测信号仍很弱,对多巴胺的测定基本没有干扰,说明该传感器的选择性较好。
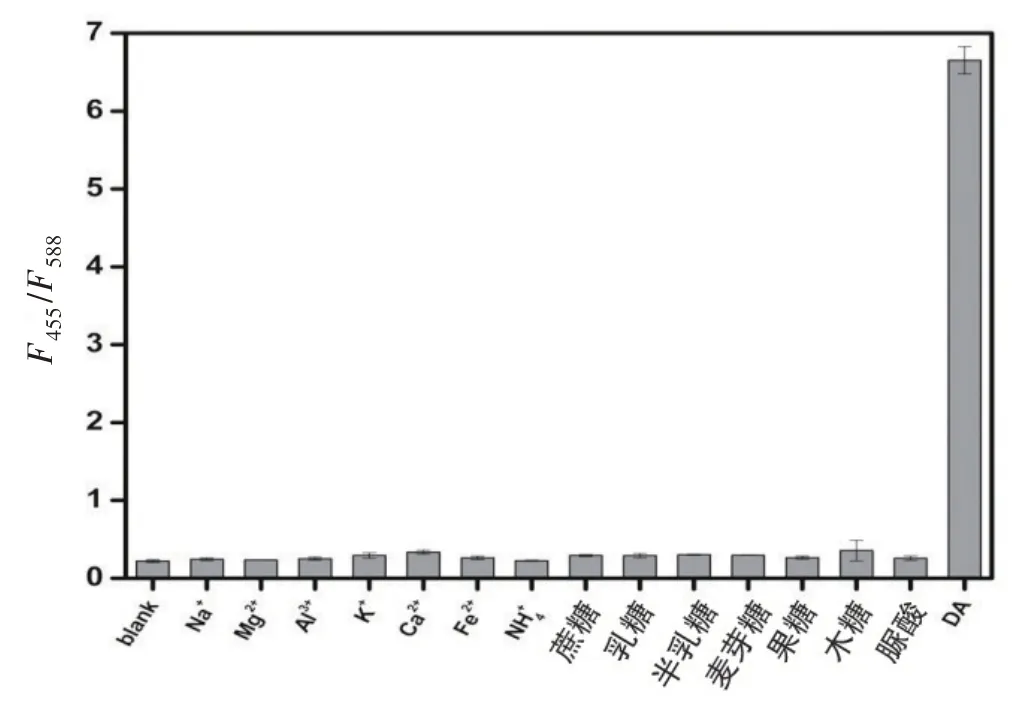
图9 常见干扰物对多巴胺测定的影响
3 结论
多巴胺和间苯二酚在强碱条件下发生反应,产物(DR)发射兰色荧光,而且兰色荧光的强度随着多巴胺浓度的增大而增大;而发射红色荧光的纳米金簇(AuGSH)在相同的条件下,荧光基本不变。因此,将AuGSH的荧光作为参比信号,DR 的荧光作为检测信号,构建简单、灵敏、准确的荧光比率传感器用于多巴胺的检测。实验对主要参数进行了优化,并考察了潜在干扰物对测定结果的影响,表明该传感器具有良好的选择性,为研制新型的多巴胺传感器提供了一定的理论基础。

