微生物环氧水解酶催化机制及应用研究进展
曹菲,李永泉,毛旭明
(1浙江大学药物生物技术研究所,浙江杭州310058;2浙江省微生物生化与代谢工程重点实验室,浙江杭州310058)
环氧水解酶(epoxide hydrolases,EHs)是一类非常重要的生物催化剂,能选择性水解外消旋环氧化物生成具有高度手性选择性的环氧化物和邻二醇[1-3],在制药工程、生物工程、化学工程等领域有广泛的应用。微生物来源的EHs大多属于α/β折叠酶[4],相比于动植物来源的EHs,它的优点是容易大量制备、催化效率高且立体选择性强[5-6],同时催化反应不需要辅酶的参与[6-7]。因此,微生物来源的EHs在生物催化领域被视为一类非常有价值的生物催化剂[8-10]。
近10年来,随着基因组学、分子生物学等领域的快速发展,又有许多微生物EHs通过基因组挖掘被发现[11-28]。同时越来越多需要EHs参与的复杂天然产物合成途径被解析[29-41]。还有部分病原微生物中也发现了新的EHs,这些EHs参与微生物生长代谢,可以作为药物靶点[42-49]。这些新发现的微生物EHs在手性化合物合成中具有潜在的应用价值。与此同时,研究者也对EHs的酶学特性、蛋白质结构与催化机理进行了深入的研究。
21世纪以来,合成生物学领域发展十分迅速,EHs作为一类重要的工程酶同时也是一类强有力的合成元件。许多研究者改变了手性药物中间体的合成思路,从简单的单酶催化到将合成元件(含EHs)流水线式组装入微生物细胞工厂,从头合成或从中间体通过一系列反应最终得到产物[50-51]。运用合成生物学理念,改变EHs应用方法,有利于降低底物成本、提高酶利用率,从而进一步降低手性药物中间体生产成本。本文作者介绍了微生物来源的EHs催化机制,总结了近10年来发现的新型微生物来源的EHs,还介绍了目前EHs在生物催化和合成生物学领域应用的进展。
1 微生物来源的环氧水解酶
1.1 酶学特性
微生物来源的EHs能不对称水解外消旋环氧化物生成有价值的手性化合物,具有优良的酶学特性,已经成为手性药物中间体合成领域重要的生物催化剂。EHs的催化效率高[5],底物区域与立体选择性高[6],反应不需辅酶或辅基参与,同时产物的手性控制强[6-7]。来源于放射形土壤农杆菌(Agrobacterium radiobacterAD1)的EH(ArEH)研究得比较透彻。1997年,Rink等[52]报道A.radiobacterAD1能在以环氧氯丙烷为唯一碳源的培养基上生长,原因是体内的ArEH能将环氧氯丙烷水解为3-氯-1,2-丙二醇,然后通过卤代醇脱卤酶将其转化为缩水甘油,缩水甘油进一步被中心代谢转化为甘油。研究者通过克隆ArEH基因,在Escherichia coliBL21(DE3)中大量表达与纯化,测定了ArEH的酶学特性。研究发现:①ArEH底物选择性高,底物谱分析表明环氧氯丙烷和环氧溴丙烷是最好的底物;②ArEH催化速率高,ArEH与环氧氯丙烷反应的Km远小于50 mmol/L,vmax约为38 U/mg蛋白,催化常数kcat值约为21 s-1。
1.2 EHs催化机理
大部分微生物EHs属于α/β折叠水解酶家族,因其含有的核心结构域和帽子结构域两个功能性的结构单元都由α螺旋和β折叠组成[53],活性位点位于核心和帽子结构域之间的主要疏水环境中。ArEH是具代表性的、研究比较透彻的一种α/β折叠型EH。以ArEH为代表的EHs活性位点由催化三联体残基构成,包括活性结构域中的亲核残基Asp、His和羧酸残基Asp/Glu;帽子结构域中Tyr为反应提供质子。现在比较公认的EHs催化的反应历程是通过两步法进行的。例如,ArEH的催化反应机理为:①Asp107亲核攻击环氧化物上的碳原子将环打开,形成共价酯中间体,Tyr152提供质子形成醇;②Asp246辅助His275活化水分子,使酯中间体水解形成邻二醇,并使产物与酶分离[54-55]。
也有一些EHs与上述ArEH有不同的结构与催化机制,例如红平红球菌Rhodococcus erythropolisDCL14来源的柠檬烯1,2-环氧水解酶(limonene-1,2-epoxide hydrolase,LEH)。LEH类EHs与α/β折叠型EHs区别是:LEH分子量较小,不具备α/β折叠结构,由α螺旋和β折叠弯曲形成疏水口袋。LEH活性位点由Arg99、Asp101和Asp132构成,其催化反应机理为:①Arg99分别与Asp131、Asp246的羧基形成氢键,稳定电荷,Tyr53、Asn55和Asp132与水分子形成氢键,将水分子定位于有利于亲核攻击底物的氧环;②Asp101为环氧化物的氧提供质子形成醇,Asp132吸引水分子中的质子,辅助亲核攻击环氧化物环碳原子直接形成二醇,而不形成酯中间体[56-57]。不同菌种来源的EHs基本都与上述两类EHs具有相似性,目前尚未有文章报道有新类型的微生物EHs。
1.3 微生物来源的新型EHs
近10年来,随着基因组学和分子生物学技术的发展,不断地有新微生物EHs被发现(表1)。2010—2019年,至少在30余种微生物中发现了新的能催化不同底物的EHs,并且至少有15个微生物EHs已经完成蛋白质结构解析。表1中总结了近10年报道的新发现的EHs或具备EH活性的菌株,罗列了EHs能催化的底物以及生成的产物。通过总结EHs来源菌株发现,挖掘新型微生物EHs的主要方法有:①筛选能催化生成手性环氧化物或二醇的菌株,并进一步鉴定相应的EHs(表1编号1~19);②表征微生物天然产物的合成途径中的后修饰酶(表1编号20~34);③分析鉴定能引起人或动物疾病的病原微生物体内的药物靶标。此外,这些EHs催化的底物既包含结构简单的环氧化物,也包含结构复杂的天然产物,说明微生物EHs具有宽泛的底物谱。这些新发现的EHs在手性药物中间体、复杂天然产物合成中具备很好的应用开发前景。
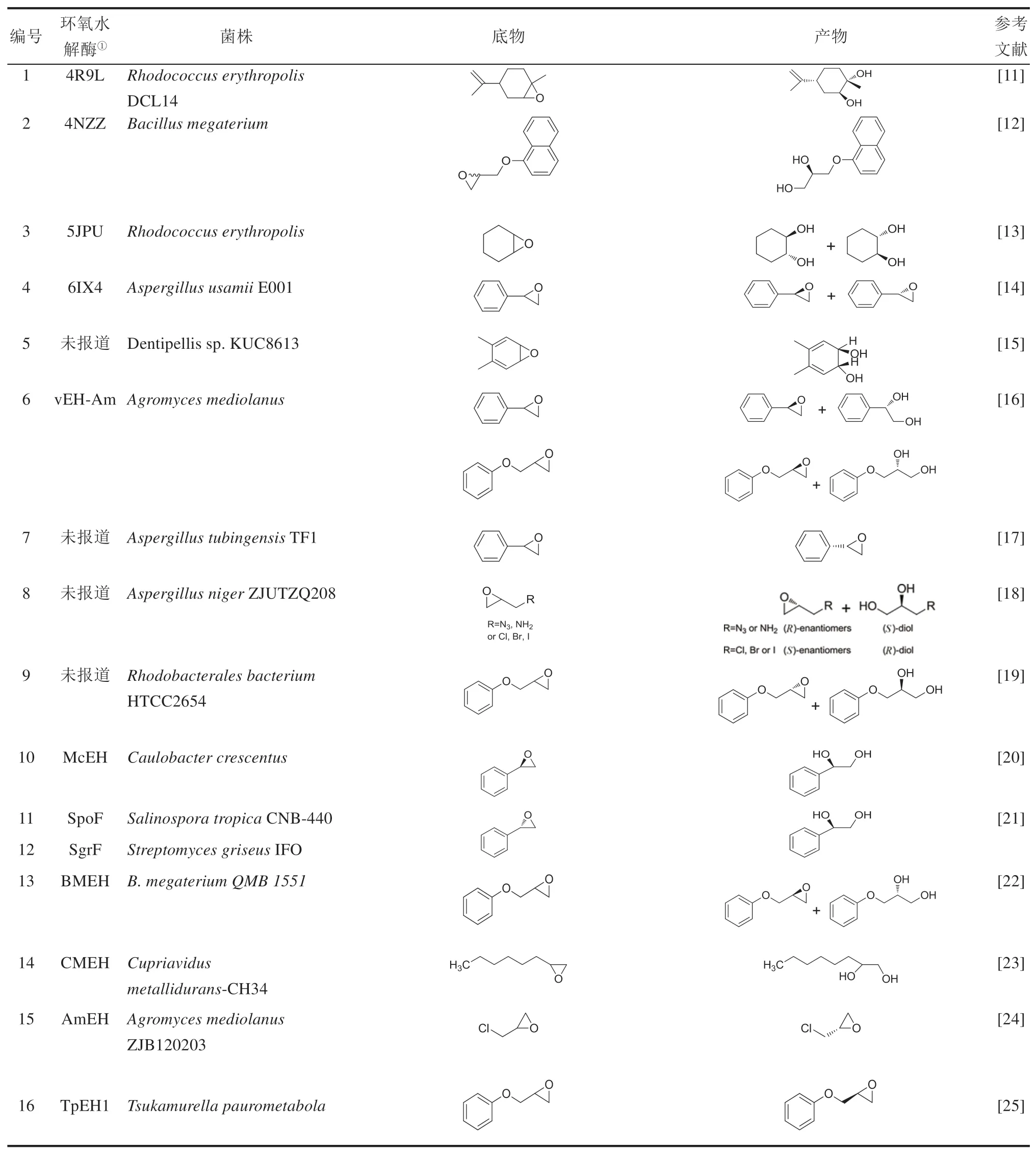
表1 2010—2019年微生物中新发现的EHsTab.1 Newly discovered microbial EHs in 2010—2019
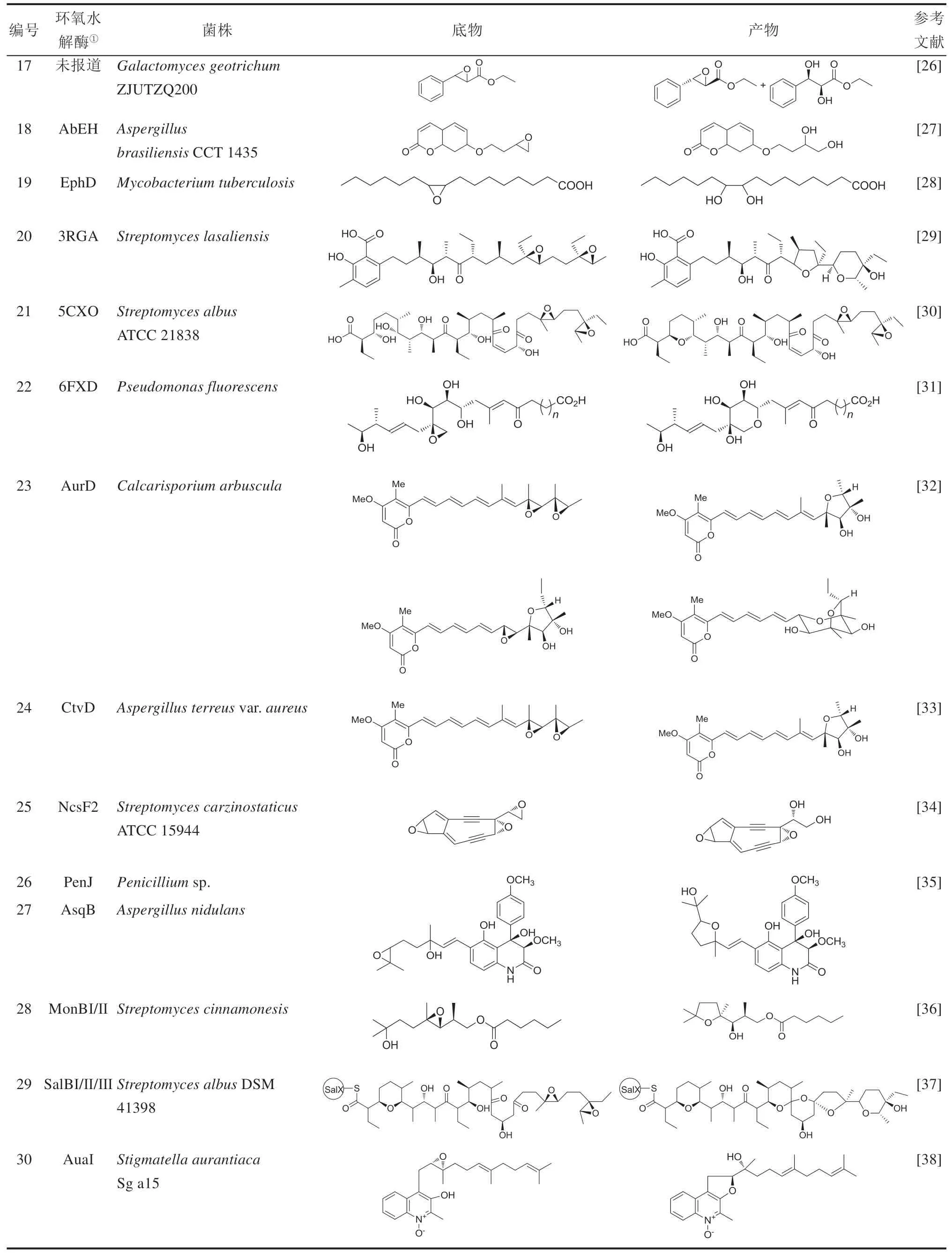
续表
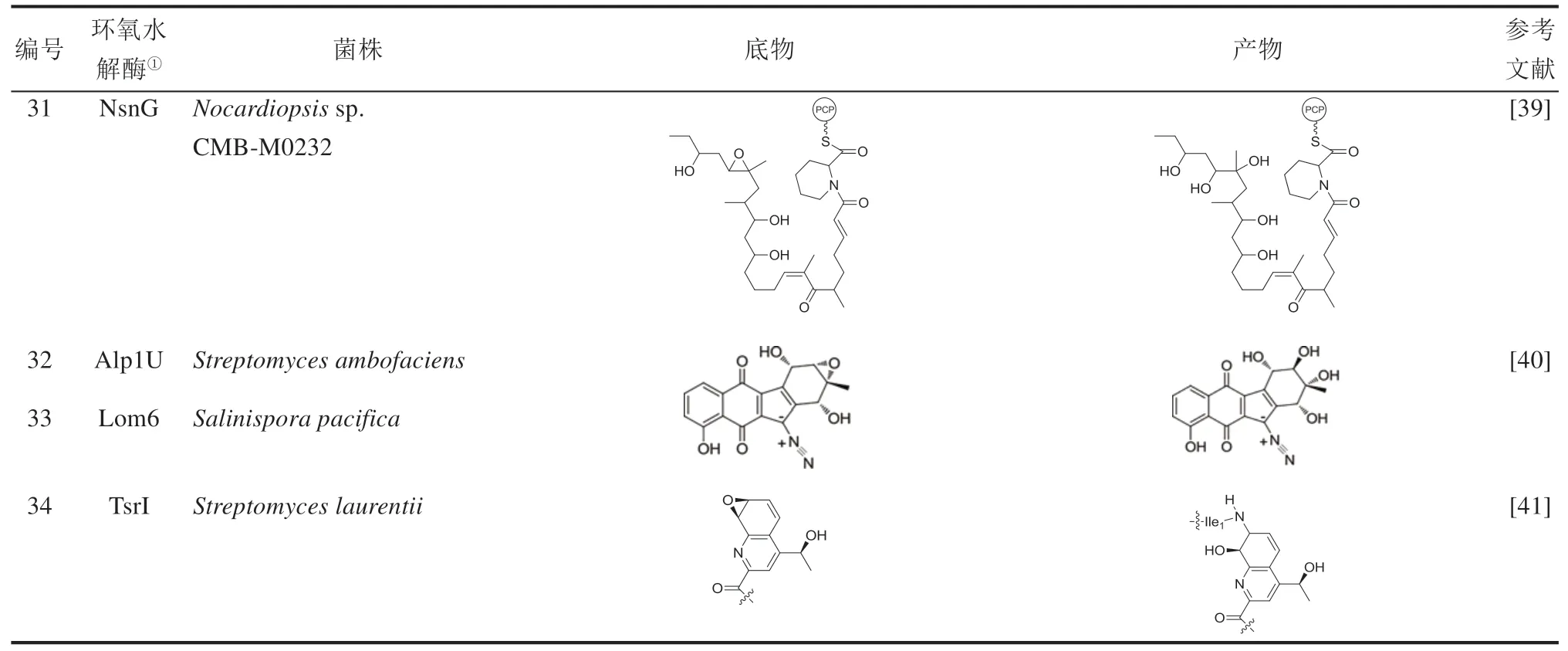
续表
2 微生物EHs的应用
2.1 基于生物转化的手性药物中间体合成
手性环氧化物及邻二醇制备主要有化学合成法[58-59]和生物催化法[60-61]。化学合成手性环氧化物目前存在着反应条件苛刻、选择性差、重金属催化剂昂贵、环境不友好等问题[62]。而微生物来源的EHs制备成本低、酶催化效率高且不需辅酶与辅基参与反应[7]。更为重要的是,EHs对对映体选择性很高,能不对称水解外消旋环氧化物制备光学纯的环氧化物和邻二醇,生成多种有重要价值的手性药物中间体[62-63],例如(R)-环氧氯丙烷[64-66]、手性苯基乙二醇[67]、(S)-芳基缩水甘油醚等[68-69]。
许多研究者通过对反应条件的摸索与优化[70],结合随机突变[71-72]、迭代饱和突变[73-74]、定点突变等[75-77]酶的定向进化技术,对不同来源的微生物EHs加以优化改造提升催化活性、对映选择性以及产 物 产 率 等 性 质。Saini等[70]从Streptomyces griseusNBRC 13350基因组中发现了一种新的EH,该EH能将消旋苯基缩水甘油醚(PGE)动力学分解为(R)-PGE。通过催化条件摸索与优化,当反应中细胞与底物比20:1(质量比)、pH 7.5、20℃、体系含10%二甲基甲酰胺(体积分数)时,(R)-PGE产率为34%,e.e.达到99%。
按照随机突变策略,Jin等[78]使用60Coγ射线和紫外线照射诱变EH生产菌株Aspergillus nigerZJB-09103,筛选到了阳性突变菌株的EH,其活性达到33.7 U/g,是野生型菌株EH活性的2.7倍。突变株催化生成(S)-环氧氯丙烷所需的反应时间缩短了2.5倍,e.e.达到99%,收率约为17.6%。运用酶的定向进化技术,Zou等[73]通过迭代饱和突变ArEH,发现T247K/I108L/D131S突变的ArEH与野生型酶相比,对环氧氯丙烷的催化效率提高了4.5倍,对环氧氯丙烷的对映体选择性提高了2.1倍,50℃条件下热稳定性提高了8倍。使用突变的ArEH对外消旋环氧氯丙烷进行动力学拆分,(R)-环氧氯丙烷收率为40.2%,且e.e.大于99.9%,生产率达到1410 g/(L·d)。
2.2 基于合成生物学理念的新型手性化合物合成方法
微生物来源的EHs不仅在手性药物中间体有重要的应用,随着近年来合成生物学领域的快速发展,EHs作为一个重要的合成元件,未来在微生物底盘细胞中重构化合物合成途径[51,79-80]、基因簇异源表达、天然产物组合生物合成[81-82]等方面展现出非常广阔的应用潜力。目前,以微生物EHs为合成元件组装化合物的生物合成途径,已经在以大肠杆菌为代表的原核底盘细胞[80]和以酵母菌为代表的真核底盘细胞中有了较好的应用[51]。
大肠杆菌蛋白表达量高,遗传操作简便。许多研究者以大肠杆菌为底盘,将EHs与其他催化元件进行串联,从而合成手性药物中间体。Yu等[80]设计了一套不对称催化串联反应,该反应路线为过氧化酶OleTJE将底物苯丙酸脱羧氧化为苯乙烯,单加氧酶P450-BM3将苯乙烯氧化成(R)-氧化苯乙烯,最后通过Aspergillus niger来源的水解酶ANEH将氧化苯乙烯开环水解生成R型苯乙二醇类产物。该串联反应可对至少9种底物实现较高的转化率和对映选择性。此外,Sun等[50]设计了一种新的三步一锅法级联系统。该系统采用环氧水解酶、甘油脱氢酶和ω-转氨酶,将外消旋苯乙烯氧化物不对称合成(R)-苯基甘氨醇。还构建了AlaDH/L-Ala的辅助因子自给系统用于再生昂贵的辅助因子NAD+和去除副产物丙酮酸,并用阳离子树脂吸附去除产物使反应的热力学平衡朝产物生成的方向发展。最终,由外消旋苯乙烯氧化物成功制备光学纯的(R)-苯基甘氨醇,产率高达81.9%,e.e.达99%。Liu等[83]开发了从(S)-环氧化物一步合成光学纯的1,2-氨基醇的方法。该研究设计了一种非天然生物催化级联反应,通过偶联环氧水解酶SpEH、酒精脱氢酶MnADH和ω-转氨酶PAKω-TA,将级联反应路线构建在大肠杆菌BL21(SGMP)体内。另外,研究者通过过表达谷氨酸脱氢酶GluDH使得细胞可以同时释放辅助因子和氨基供体,建立了胞内辅因子和供体自足系统。该工程菌SGMP催化的产物e.e.大于99%,从(S)-环氧苯乙烷到1,2-氨基醇的转化率为99.6%;另外4种(S)-环氧化物转换为1,2-氨基醇的转化率在65%~96.4%。
除了上述以大肠杆菌为底盘设计串联反应外,Yuan等[51]首次尝试在真核生物酿酒酵母体内建立以苯乙烯为中间体生产苯乙二醇的人工生物合成途径。该研究使用苯丙氨酸氨裂合酶PAL和阿魏酸脱羧酶FDC将苯丙氨酸脱氨基/脱羧生成苯乙烯;对苯乙烯进行(S)-选择性环氧化,得到(S)-苯乙烯;再用苯乙烯单加氧酶SMO催化氧化生成(S)-环氧乙烷;最后,用鞘氨醇单胞菌HXN-200或马铃薯的环氧水解酶SpEH/StEH对(S)-环氧乙烷进行区域选择性水解,生成(S)-苯基乙二醇或(R)-苯基乙二醇。该研究证明,包含立体特异性环氧水解的级联反应可以在真核宿主酿酒酵母中功能性表达。小型摇瓶研究表明,经过工程改造的酵母细胞工厂在培养96 h后,可生产约100~120 mg/L的(S)-苯基乙二醇或(R)-苯基乙二醇。
3 展望
21世纪以来,基因组学的飞速发展使人们获取了大量微生物基因组信息,而其中蕴藏着大量具有环氧水解功能的催化酶基因。经过20年左右的努力,随着生物信息学、分子遗传学等领域的发展,已有数个EHs被发掘并成熟应用于不对称催化领域。当前,利用微生物EHs生物催化合成手性药物中间体已经成为了一种主流的工业生产方法。从庞大的微生物基因组中挖掘新型EHs的工作始终在进行中,天然产物生物合成研究构筑了EHs应用于合成生物学的坚实基础。值得注意的是,近年来又有许多新颖的微生物EHs从天然产物生物合成途径中被鉴定出来。在生物合成中,EHs往往作为一种重要的后修饰酶,介导环氧底物的开环反应,开环后的产物还可以被其他后修饰酶进一步催化,从而得到结构复杂的天然产物。因此,EHs为天然产物结构多样性提供了丰富前体。此外,EHs介导的反应常常具有高度的区域、立体选择性,这相比于化学合成具有很大的优势,十分具有成为生物催化剂或合成生物学元件的潜力。因此,在未来从微生物天然产物生物合成途径中挖掘EHs仍然是一项非常具有开创性的工作,这帮助人们不断充实EHs的底物谱、扩充备选的EHs生物催化及合成生物学元件库。
EHs结构生物学方面的研究帮助研究者更加清晰地了解了EHs的催化机制,尤其是其独特的手性选择性,这为未来酶的定向改造与产业化应用提供了坚实的理论基础。目前,许多微生物EHs生物大分子结构已经被解析,几个代表性的EHs催化机理已经研究得比较清楚,例如ArEH、LEH等。然而,新颖的微生物EHs数量仍在不断增加,其中有不少EHs具备特殊的结构与功能,识别独特而复杂的底物。作为一项基础性研究工作,利用结构生物学手段解析新型微生物EHs结构仍需要研究者们不断地投入大量的工作。为了将EHs进行产业化应用,必须通过不断提高EHs催化效率、稳定性和对映体产物纯度等酶学特性来降低生产成本。研究者基于酶的定向进化策略,通过反应体系优化、随机突变、定点突变、迭代饱和突变等技术,得到了众多具有优良活性的工程酶。这项工作是EHs走上产业化之路必不可少的环节。
21世纪新兴的合成生物学研究给传统的基于生物催化生产手性药物中间体的生产方式带来了冲击。其理念是将不同来源的生物合成相关的代谢途径模块化、元件化,并在底盘细胞上组装;人工设计目的产物的生物合成途径,提高代谢途径的效率,从而实现手性药物中间体的高效生物合成和规模化生产。基于合成生物学理念,已有研究将EHs作为合成元件与上游和下游催化元件串联组装入细胞工厂(大肠杆菌、酵母等),组成一条相对完整的代谢通路,用于高效合成手性药物中间体。未来,催化元件性能的不断提升、底盘细胞内供给系统的不断优化,将会进一步提升产物生成效率,手性药物中间体生产成本会逐步降低。这可能会使合成生物学生产方法逐渐取代单酶催化法,成为手性药物中间体生产的主流方法。

