基于紫外诱变与生物合成基因簇倍增的多氧霉素高产菌株构建
刘如欣,杜磊,2,徐晓庆,丁金鹏,张伟,李盛英
(1山东大学微生物技术研究院,山东青岛266237;2山东省合成生物学重点实验室,中国科学院青岛生物能源与过程研究所,山东青岛266101;3乳山韩威生物科技有限公司,山东乳山264502)
1965年Suzuki等[1]首次从分离自日本熊本县阿苏地区土壤的可可链霉菌阿苏变种(Streptomyces cacaoivar.asoeinsis)的发酵液中检测到一种具有较强抗真菌活性的肽基核苷类抗生素,由于该抗生素的结构中含有多个氧原子,将其命名为多氧霉素。1967年我国中国科学院微生物所在安徽省合肥市的菜园土壤中分离到另一株多氧霉素的产生菌金色链霉菌(S.aureochromogenes)[2]。多氧霉素对多种真菌引起的农作物病害如黑斑病、灰霉病等具有很好的防治效果,且对动植物没有毒性,在环境中可降解,是一种理想的绿色农药。经过数十年的应用,目前多氧霉素仍然是在全球应用最为广泛的农用抗生素之一。
多氧霉素的化学结构与几丁质合成酶(chitin synthase)的底物尿苷二磷酸酯-N-乙酰氨基葡萄糖(UDP-Glc NAc)相似,因而能够竞争性抑制真菌细胞壁中几丁质的合成,导致细胞因渗透压差异而裂解[3-4]。Isono等[3,5-7]将可可链霉菌阿苏变种的发酵液进行多步分离纯化和结构鉴定,发现多氧霉素由多氧霉素A~M 13个组分组成(图1),其中A和B为主要组分,B组分的抗真菌效果尤为显著。之后Uramoto等[8]又从S.piomogenus分离得到新组分多氧霉素N,与其他多氧霉素不同,多氧霉素N是一种杂合抗生素,它由多氧霉素的肽基和尼可霉素的核苷骨架组合而成(图1)。

图1 多氧霉素的结构与组成[6]Fig.1 Composition and structures of polyoxins[6]
多氧霉素的化学结构主要由核苷骨架(nucleoside skeleton)、氨 甲 酰 多 聚 草 氨 酸(carbamoylpolyoxamic acid,CPOAA)和聚肟酸(polyoximic acid,POIA)三部分组成[9],其中核苷骨架以尿苷和磷酸烯醇式丙酮酸为前体[10],氨甲酰多聚草氨酸的合成前体为异亮氨酸[11-12],聚肟酸合成前体为谷氨酸。2009年Chen等[13]首次从S.cacaoi基因组文库中克隆到多氧霉素的完整生物合成基因簇,并成功在S.lividansTK24中进行异源表达,实现了多氧霉素H组分的产生。多氧霉素基因簇含有20个基因:polB、polA、polD、polH、polI、polJ和polK七个基因负责核苷骨架的合成[10],肽基CPOAA由polL、polM、polN、polO和polP五个基因负责组装[14],polC、polE和polF则负责另一个肽基POIA的合成[13],最后由polG基因编码的PolG蛋白负责将两个肽基组装到核苷骨架上,polQ1与polQ2编码转运蛋白,polR[15]和polY[16]为正调控基因。
物理或化学诱变育种是传统的抗生素菌种选育方法,具有速度快、方法简便等优点,缺点在于缺乏定向性,必须与大规模筛选相配合才能获得较好的效果。近年来,随着分子育种及合成生物学的快速发展,出现了一些新的策略,如增加目标产物合成基因簇的拷贝数、提高前体供应、阻断竞争通路、重整目标产物基因簇等[17]。其中,增加基因簇的拷贝数可显著提高目标化合物的产量:Yanai等[18]通过在卡那霉素链霉菌中将卡那霉素基因簇的拷贝数增加2,使卡那霉素的产量翻番。该课题组[19-20]随后又发现了由ZouA和RsA/RsB介导的基因倍增系统,并利用该系统使放线紫红素的产量提高了20多倍。芦银华等[21]利用其建立的多重整合酶-多重attB位点的方法将5-氧代米尔贝霉素的基因簇增加了3个拷贝,使其产量提高了近2倍。ExoCET直接克隆技术将核酸外切酶介导的体外同源重组和RecET介导的细胞内同源重组有效结合,可以快速、高效地对大片段DNA(如次级代谢产物基因簇)进行直接克隆,可有效用于基因簇倍增[22-25]。例如:Ongley等[26]利用直接克隆技术成功从不可培养的海洋藻青菌中克隆了lyngbyatoxin的生物合成基因簇,并在大肠杆菌中实现了异源表达,其产量为25.6 mg/L,其前体化合物indolactamV的产量达到了150 mg/L;Bian等[27]利用直接克隆技术成功从伯克菌DSM7029中克隆了一种蛋白酶抑制剂——glidobactin的生物合成基因簇,并通过在大肠杆菌中进行异源表达将其产量提高了10倍。
我国于20世纪70年代开始进行有关多氧霉素菌种选育和生产工艺的研究,但是其生产水平仍然较低、成本较高,目前主要依赖于从日本进口的含多氧霉素的农药品种宝丽安[2]。本文作者为了提高多氧霉素B的产量,从一株由本实验室自土壤环境中分离得到的多氧霉素产生菌——金色链霉菌出发,将传统的紫外诱变育种与基因工程育种相结合,首先通过紫外诱变育种初步筛选多氧霉素B高产菌株,然后通过ExoCET直接克隆技术将多氧霉素生物合成基因簇pol克隆到p15A载体上,并利用Red/ET重组工程技术对得到的重组质粒进行修饰,进而构建pol倍增菌株,成功提高了工程菌多氧霉素B的产量,期待为我国多氧霉素的工业发酵生产提供候选菌株。
1 材料和方法
1.1 材料
1.1.1 菌种、质粒和引物
本研究所用的菌株和质粒见表1。寡核苷酸引物均由生工生物工程(上海)股份有限公司合成,本研究所用的寡核苷酸序列见表2。

表1 本研究所用的菌株和质粒Tab.1 Strains and plasmids used in this study
1.1.2 培养基
LB培养基(100 mL):蛋白胨1 g,酵母粉0.5 g,氯化钠0.1 g。
MS培养基(100 mL):大豆粉2 g,甘露醇2 g,琼脂2 g。

表2 本研究所用的寡核苷酸序列Tab.2 Nucleotide sequences used in this study
孢子斜面培养基(100 mL):可溶性淀粉2 g,KNO30.1 g,K2HPO40.05 g,MgSO4·7H2O 0.05 g,NaCl 0.05 g,FeSO4·7H2O 0.001 g,琼 脂2 g,pH 7.0。
种子培养基(100 mL):酵母提取物1.0 g,胰蛋白胨1.6 g,KNO30.1 g,K2HPO40.05 g,MgSO4·7H2O 0.05 g,NaCl 0.05 g,FeSO4·7H2O 0.001 g,pH 7.0。
发酵培养基(100 mL):淀粉5 g,豆粕粉2.5 g,酵母提取物0.5 g,甘露醇0.5 g,NaCl 0.5 g,(NH4)2SO40.05 g,CaCO30.2 g,pH 7.1。
1.1.3 主要试剂和仪器
试剂:限制性DNA内切酶购自莫纳生物科技有限公司和New England BioLabs公司;T4 DNA聚合酶购自New England BioLabs公司;PrimeSTAR Max DNA聚 合 酶、DNA Marker购 自Takara公 司;RNase A购 自Omega Bio-Tek公 司;蛋白胨、酵母粉等购自Oxoid公司;琼脂粉、琼脂糖、50×TAE电泳缓冲液、10×TBE电泳缓冲液购自Solarbio公司;Buffer P1、P2、P3、DNA纯化回收试剂盒等购自天根生化科技(北京)有限公司。
仪器:赛百奥紫外诱变箱;Bruker液相色谱高分辨质谱联用仪;莱玻特瑞恒温恒湿培养箱;Bio-Rad电转化仪;Thermofisher Nanodrop微量紫外分光光度计;Tanon凝胶成像系统等。
1.2 紫外诱变初步筛选多氧霉素高产菌株
1.2.1 紫外诱变
将链霉菌孢子悬液稀释至107mL-1,取3 mL混匀的单孢子悬液置于无菌平板上,分别以不同时间(5 s、10 s、20 s、40 s、60 s)的紫外照射时间为紫外线处理剂量,放置于已预热20 min的紫外诱变箱(波长253.5 nm,强度30 W,距离30 cm)中进行诱变。紫外线诱变处理后,为防止可见光下回复突变,用黑纸包裹平板,避光静置2 h。取出后在红光下进行梯度稀释(10-1~10-5),再分别以从低到高浓度的顺序涂布于斜面培养基平板中,28℃暗处培养4~7 d。同时,未经紫外处理的孢子进行平行实验,作为对照。
致死率的计算方法:

通过计算紫外诱变致死率,确定最佳的紫外诱变参数。挑取100株突变后的单菌落,传代一次制备孢子悬液备用。
1.2.2 多氧霉素突变株的发酵和产量检测
接种不同突变株的孢子于孢子斜面培养基,于29℃培养7 d,可见明显黑色孢子生成。接种0.5 cm2到25 mL种子培养基(250 mL三角烧瓶),250 r/min,29℃,培养1 d,可见形成大量细颗粒的菌丝体。按10%接种量接种发酵培养基(25 mL/250 mL),250 r/min,29℃,培养6 d,到衰亡期停止发酵,培养过程严格控制温度不高于30℃。收集发酵液,离心去除菌体,吸取1 mL上清,加入200μL甲醇,振荡1 min,最高转速离心10 min,吸取上清进行HPLC检测。
HPLC检测条件:色谱柱为YMC-Triart C18,4.6 mm×250 mm,5μm;流动相,A相为水+0.1%甲酸,B相为乙腈+0.1%甲酸;洗脱程序为0~10 min 100%A,10~15 min 93%A,15.5~23 min 0%A,23~23.5 min 100%A,23.5~28 min 100%A;流速1 mL/min;检测波长262 nm;进样体积20μL。
标准品制备:用50%多氧霉素B粉末作为标准品,称取2 mg,加800μL水溶解,加200μL甲醇,充分振荡,最高转速离心10 min,吸取上清进行HPLC检测。
1.3 多氧霉素基因簇的直接克隆
1.3.1S.ansochromogenesPol-12基因组的提取
将50 mL培养2 d的链霉菌菌液8300g离心5 min,弃上清。用30 mL无菌ddH2O重悬菌体,涡旋混匀8300g离心5 min,弃上清。用8 mL SET溶液重悬细胞,涡旋混匀。加入10 mg溶菌酶,颠倒混匀,37℃水浴1 h,间断颠倒。加入500μL 20mg/mL的Proteinase K,颠倒混匀,加入1 mL 10%SDS,颠倒混匀。50℃水浴2 h,中间间断颠倒,直至溶液澄清。加入3.5 mL 5 mol/L NaCl,颠倒混匀。加入15 mL苯酚-氯仿-异戊醇(25:24:1),颠倒混匀,至呈乳浊状。8300g离心30 min。用去尖枪头取上清500μL分装至2 mL EP管。加入35μL 3 mol/L NaAc和1.2 mL无水乙醇,颠倒混匀。准备新的2 mL EP管,加入1.5 mL 70%乙醇,用黄枪头将絮状DNA转移至EP管中,9400g离心1 min。弃上清,倒置于吸水纸上,常温干燥30 min。用500μL ddH2O溶解DNA。
1.3.2S.ansochromogenesPol-12基因组酶切产物制备
选择合适的限制性内切酶BsrDⅠ,酶切基因组,释放基因簇片段。取浓度为200 ng/μL的基因组DNA 250μL,加入40μL 10×Cutsmart、15μL限制性内切酶BsrDI、2μL RNase A,用双蒸水补至400μL,37℃反应4 h。取10μL酶切产物跑琼脂糖凝胶电泳进行检测。检测之后用对苯酚-氯仿-异戊醇(25:24:1)抽提酶切产物除去蛋白,然后进行酒精沉淀。
1.3.3 直接克隆载体的制备
以p15Acm-PO-1和p15Acm-PO-2为PCR引物,以质粒p15A-cm-tetR-tetO-hyg-ccdB为PCR模板,进行PCR扩增。通过琼脂糖凝胶电泳检测大小为2720 bp的PCR产物p15A-cm-PO PCR,切胶回收目的片段。
1.3.4 多氧霉素基因簇的直接克隆
直接克隆载体和酶切基因组产物在体外用T4 DNA Polymerase退火:取200 ng p15A-cm-PO PCR,加入2μg基因组酶切产物、0.2μL 10×NEB Buffer 2.1、0.13μL T4 DNA Polymerase、12.87μL双 蒸 水,PCR仪 中25℃1 h,75℃20 min,50℃30 min,1个循环,4℃保温。反应完成之后将产物室温除盐30 min。将上述除盐后的产物电转化到经L-Ara诱导的感受态细胞E.coliGB05dir(含有pSC101-BAD-ETgA)中。从转化平板上挑取单菌落,小量提取质粒,进行酶切分析。
1.4 多氧霉素基因簇倍增菌株的构建
1.4.1 质粒p15A-apra-oriT-phiC31的构建
制备质粒p15A-cm-tetR-tetO-hyg-ccdB和pR6K-oriT-phiC31,用限制性内切酶AseⅠ酶切pR6K-oriT-phiC31,得到带有同源臂的酶切片段apra-oriT-phic31。将酶切产物用Omega Bio-tek DNA纯化试剂盒进行纯化。将200 ng酶切产物apra-oriT-phic31和200 ng p15A-cm-tetR-tetO-hygccdB共同电转化入经L-Ara诱导的GBred-gyrA462中。挑取单菌落,小量提取质粒,用限制性内切酶AseI进行酶切鉴定。
1.4.2 p15A-apra-Pori-pol的构建
以链霉菌S.ansochromogenesPol-12基因组DNA为模板、oripromoter-1/2为引物,进行PCR扩增,得到原始启动子的PCR产物ori-promoter PCR;以p15A-apra-oriT-phiC31为模板、p15Aapra-PO-1/2为引物,进行PCR扩增,得到PCR产物p15Aapra-PO PCR-1。以ori-promoter PCR和p15Aapra-PO PCR-1为模板,以p15Aapra-PO-3和oripromoter-1进行融合PCR扩增,得到p15Aapra-PoriPCR。制备质粒p15A-cm-pol,将500 ng p15A-apra-PoriPCR和500 ng p15A-cm-pol共同电转化入经L-Ara诱导的GBred的感受态细胞中,挑取单菌落,小量提取重组质粒,用限制性内切酶BamHⅠ进行酶切鉴定,将酶切鉴定正确的质粒p15A-apra-Pori-pol送生工生物工程(上海)股份有限公司对同源臂部分进行测序确认。
1.4.3 p15A-apra-PkasOp*-pol的构建
以p15A-apra-oriT-phiC31为模板,以p15Aapra-PO-1和p15Aapra-kasOp*-PO-2为引物,进行PCR扩增,得到PCR产物p15A-apra-PkasOp*PCR。将500 ng p15A-apra-PkasOp*PCR和500 ng p15A-cm-pol共同电转化入经L-Ara诱导的GB05red的感受态细胞中,用限制性内切酶BamHI对得到的重组子进行酶切鉴定,将酶切鉴定正确的质粒p15A-apra-PkasOp*-pol送去生工生物工程(上海)股份有限公司对同源臂部分进行测序。
1.4.4pol在链霉菌S.ansochromogenesPol-12中的整合和表达
将质粒p15A-apra-Pori-pol和p15A-apra-PkasOp*-pol分别电转化入E.coliET12567/pUZ8002中。链霉菌和大肠杆菌的接合转移参照文献[28]。多氧霉素的发酵和产量检测方法同1.2.2。
2 结果和分析
2.1 紫外诱变筛选多氧霉素高产菌株
通过1.2的公式计算紫外诱变致死率,确定最佳的紫外诱变参数为5~10 s(致死率90%~95%)。经紫外诱变和100株随机挑选的突变菌株的多氧霉素B产量比较,得到突变株S.ansochromogenesPol-12,其摇瓶发酵6 d的产量较野生型菌株提高了1.2倍。
2.2 多氧霉素基因簇的直接克隆
2.2.1 基因组提取及酶切
按1.3.1的方法制备基因组,并用限制性内切酶BsrDⅠ对基因组DNA进行酶切,释放多氧霉素基因簇,通过琼脂糖凝胶电泳对基因组的酶切产物进行检测。如图2所示,未酶切的基因组DNA为单一的条带,而BsrDⅠ酶切后的基因组DNA条带较多,并且亮度从上到下呈梯度式下降,说明得到的酶切产物DNA质量较好。
2.2.2 多氧霉素基因簇直接克隆载体的制备
PCR扩增的模板为p15A-cm-tetR-tetO-hygccdB,模板上带有ccdB反向筛选基因,可以消除筛选中由模板带来的背景菌落。PCR产物的大小与预期条带(2720 bp)的大小一致,切胶回收PCR产物(图3)。
2.2.3 多氧霉素基因簇的直接克隆
将直接克隆载体和基因组酶切产物的T4 DNA Polymerase退火产物转化至表达了RecET的大肠杆菌感受态细胞中,复苏涂板后37℃过夜培养,挑取8个转化子,进行酶切鉴定(图4),所有酶切条带大小均符合预期,然后对酶切条带正确的质粒的同源臂部分进行测序,同源臂序列测序正确,表明得到了含有pol的重组质粒p15A-cm-pol。
2.3 多氧霉素基因簇倍增菌株的构建
2.3.1 质粒p15A-apra-oriT-phiC31的构建
来源于噬菌体的Red/ET重组酶可以在大肠杆菌中介导一个线性DNA分子和一个环状DNA分子发生重组,简称线环重组(linear-circular homologous recombination,LCHR)。为了方便下一步接合转移和位点特异性元件的插入,将含有筛选标记阿泊拉霉素抗性基因apra、转移起始位点oriT、整合酶基因phiC31的片段apra-oriT-phiC31通过Red/ET重组酶介导的线环重组替换掉p15A-cmtetR-tetO-hyg-ccdB上的氯霉素抗性基因cm(图5),获得质粒p15A-apra-oriT-phiC31。通过酶切鉴定分析6个转化子的酶切条带均与预测条带相符,从中选取3个转化子进行同源臂部分测序,得到了1个同源臂序列正确的重组质粒p15A-apra-oriTphiC31。
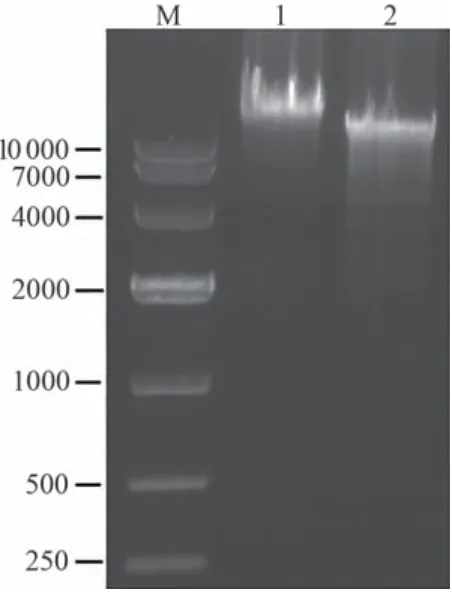
图2 链霉菌S.ansochromogenes Pol-12的基因组及其限制性内切酶BsrDⅠ酶切产物M—Takara DL10 000 DNA Marker;1—S.ansochromogenes Pol-12的基因组DNA;2—S.ansochromogenes Pol-12基因组DNA的BsrDⅠ酶切产物Fig.2 Genomic DNA of S.ansochromogenes Pol-12 and its digestion product by BsrDⅠ

图3 直接克隆载体的PCR扩增产物Fig.3 PCR amplification product of direct cloning vector

图4 多氧霉素基因簇的直接克隆Fig.4 Direct cloning of pol gene cluster
2.3.2 原始启动子、kasOp*启动子以及接合转移和位点特异性整合元件的插入
由于直接克隆得到的重组质粒p15A-cm-pol未包含启动子部分,为比较原始启动子和强启动子kasOp*对多氧霉素产量的影响,分别将原始启动子和kasOp*启动子插入基因簇第1个基因上游,通过线环重组构建重组质粒p15A-apra-Pori-pol和p15Aapra-PkasOp*-pol(图6),分别挑取了7个和15个转化子,通过酶切鉴定分析表明分别得到了1个和2个与预测条带相符的转化子,并对酶切鉴定正确的转化子的同源臂部分进行测序,同源臂序列均正确。
2.3.3 多氧霉素基因簇在链霉菌S.ansochromogenesPol-12中的整合
通过phiC31介导的位点特异性重组将构建的包含多氧霉素基因簇pol的质粒整合到S.ansochromogenesPol-12基因组上,构建多氧霉素基因簇倍增菌株。从MS筛选平板上挑取接合转移转化子进行菌落PCR验证(图7)。
2.4 多氧霉素基因簇倍增菌株的产量检测
按照1.2.2节进行菌株发酵和产量检测,多氧霉素基因簇倍增菌株发酵液进行HPLC-MS分析,根据多氧霉素B的分子量,从基峰图中提取分子量508,得到如图8所示的结果,并对样品中多氧霉素B组分的色谱峰进行积分计算峰面积,发现与S.ansochromogenesPol-12相比,插入了原始启动子调控下的pol倍增菌株M1(S.ansochromogenesPol-12::Pori-pol)多氧霉素B的产量提高了22倍,而插入了kasOp*强启动子调控下的pol倍增菌株M2(S.ansochromogenesPol-12::PkasOp*-pol)多氧霉素B的产量提高了33倍。

图5 质粒p15A-apra-oriT-phiC31的构建与鉴定Fig.5 Construction of p15A-apra-oriT-phiC31 and its verification

图6 原始启动子、kasOp*启动子以及接合转移和位点特异性整合元件的插入与鉴定Fig.6 Insertion of original promoter,kasOp*promoter,and elements for conjunction and site-specific integration as well as their verification
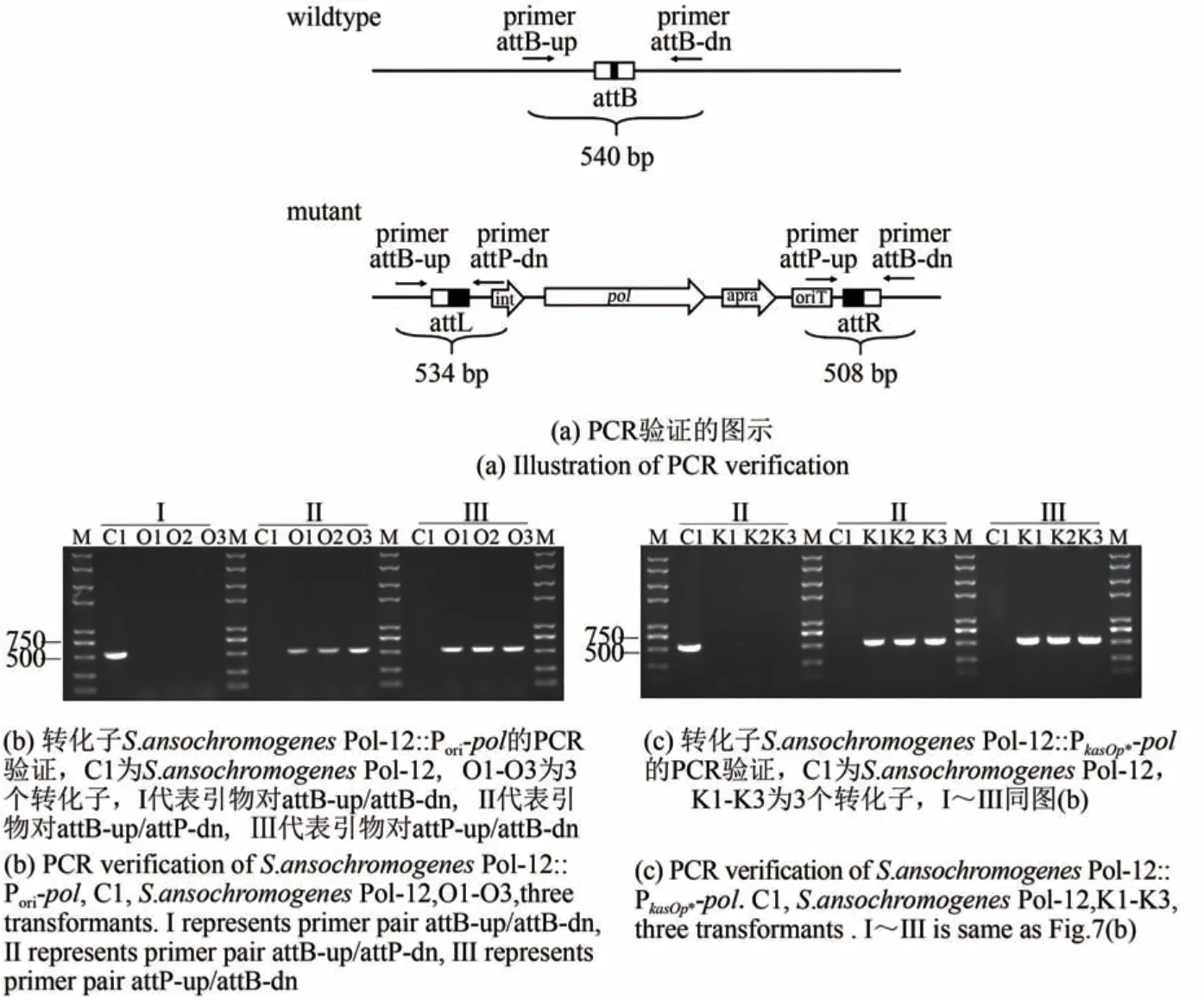
图7 多氧霉素基因簇整合入S.ansochromogenes Pol-12基因组的PCR验证Fig.7 PCR verification of pol gene cluster integrated into attB site in S.ansochromogenes Pol-12

图8 倍增菌株中多氧霉素B的产量检测Fig.8 Yield dassay of polyoxin B from the pol duplicated strains
3 结论
虽然多氧霉素已经实现商业化生产,但是我国多氧霉素B的产业化水平较低、生产成本高,因此有必要开展有关多氧霉素B高产菌株构建的研究。
本文将传统的紫外诱变育种和基因工程育种相结合,期望提高多氧霉素尤其是B组分的产量。首先通过紫外诱变初步筛选到了突变株S.ansochromogenesPol-12,然后通过ExoCET直接克隆技术成功将多氧霉素生物合成基因簇pol克隆至p15A载体上,通过Red/ET重组工程技术将启动子、接合转移元件以及位点特异性整合元件插入含有基因簇的重组质粒上,最后通过phiC31介导的位点特异性整合技术成功地将多氧霉素生物合成基因簇插入到链霉菌染色体上的attB位点,获得了pol倍增菌株M1和M2(S.ansochromogenesPol-12::Pori-pol,S.ansochromogenesPol-12::PkasOp*-pol),其多氧霉素B的产量相对Pol-12菌株分别提高了22倍和33倍,说明增加基因簇的拷贝数和运用强启动子驱动生物合成基因表达可有效提高多氧霉素的产量,本研究将为我国多氧霉素产业化水平的提升提供有益基础。
组合生物合成是一种通过对不同次级代谢产物基因簇进行遗传改造,从而获得新颖次级代谢产物或其衍生物的有效方法,Li等[29-30]通过该方法将负责多氧霉素二肽生物合成的基因导入产生尼可霉素核苷骨架的突变菌中,得到了两种比多氧霉素B具有更高抗菌活性且比尼可霉素更稳定的杂合抗生素polynik A和polyoxin N以及新的多氧霉素衍生物polyoxin O和polyoxin P;此外有文章报道将尼可霉素的相关合成基因转到多氧霉素的产生菌中进行异源表达,分离获得了6种新颖的杂合抗生素nikkoxin B~G[31-32],为研发抗菌活性更好的新型药物提供了一种高效的策略。未来可以利用更多代谢工程和合成生物学手段在高产菌株中对多氧霉素生物合成途径进行改造,精确调控多氧霉素B或其他新活性组分的定向合成,进一步特异性提高目标产物的产量和纯度。
致谢:本工作得到山东省泰山产业领军人才项目LJNY2015011的支持。感谢山东大学张友明教授实验室赠予的大肠杆菌工程菌株及质粒;感谢中国科学院微生物研究所王为善研究员赠予的kasOp*启动子元件。

