细菌群体感应系统在细胞间通讯中的应用及其合成生物学研究进展
李晓萌,姜威,梁泉峰,祁庆生
(山东大学微生物技术国家重点实验室,山东青岛266237)
生物体之间能够进行基础的交流和简单的信息交换,这是生命存在的标志。之前,人们一直认为只有多细胞生物才具备进行任何形式信息交流的能力,很少有细菌能通过特定的、可扩散的信号分子进行通讯。随着对微生物学的不断深入研究,发现微观世界的原核生物之间也可以利用不同的“语言”进行信息交流,进而以类似多细胞生物的群体模式对变化的环境做出不同的响应[1]。这种细胞与细胞间的通讯工程被称为群体感应(quorum sensing,QS),即细菌能够通过同时响应周围微生物群落的细胞密度和物种组成的变化来相应地改变行为[2-3]。群体感应涉及胞外信号分子的产生、释放和群体范围内的检测,这些信号分子被称为自体诱导物(autoinducer,AI)。AI的浓度会随着细胞密度的增加而不断提高,达到一定的浓度后,可以和胞内的受体蛋白相结合形成受体蛋白复合体,最终改变基因表达的整体模式[4]。由群体感应控制的过程包括生物发光、抗生素的合成,固氮基因调控,致病基因的表达、细菌运动和生物被膜的形成等[5]。利用单个细胞进行这些过程,成本高且低效,但利用细胞群体去进行时会有相对较高的效率[6]。已有研究表明,细菌既可以利用QS进行种内特异性交流,也可以利用QS感知周围种群细菌的数量来调控自身的行为,实现种群间的交流[7-8]。解析群体感应系统以及由其介导的跨界信息交流和信号转导机制,不仅为明确病原菌致病调控机理、阐明微生物生态竞争和动态平衡机制提供了一个全新的切入点,同时也为调控微生物生态体系和发展新的病害防控策略等奠定了坚实的基础。因此,本文作者中将会详细介绍群体感应系统的主要作用、机制以及群体感应系统在合成生物学中的研究进展。
1 自然界细菌群体感应系统及其主要作用机制
细菌之间可以通过自身合成信号分子来实现种内和种间的信息交流,使其能与多细胞生物一样,行使单个细胞无法完成的功能[9]。到目前为止,发现的自诱导物信号分子基本分为3类:N-酰化高丝氨酸内酯(N-acylated homoserine lactones,AHLs)类的信号分子;氨基酸和短肽类物质(autoinducing peptides,AIPs),这两类自体诱导物主要协助实现种内交流;而第三种信号分子则是呋喃酰硼酸二酯(furanosyl borate diester,即AI-2型信号分子),可协助实现种间交流[10]。细菌中常见的群体感应系统组成及其调控的功能可见表1。而根据细菌群体发挥功能作用的不同,可以将细菌群体感应系统分为4种类型:调控生物发光、生物被膜形成、孢子形成以及产生毒力的群体感应系统。

表1 细菌典型的群体感应系统及其功能Tab.1 Typical QS systems and functions in bacteria
1.1 调控生物发光的群体感应系统:LuxI/R、AI-2群体感应系统
20世纪60年代,曾有人对海洋鱼类的共生菌——费氏弧菌(Vibrio fischeri)的发光现象进行研究,发现费氏弧菌定植于夏威夷鱿鱼的发光器官内,其发光现象与菌群密度变化有关[11]。在海水中时,费氏弧菌浓度较低,其周围的信号分子浓度也较低,整个细菌群体呈黑色。只有当细菌密度达到一定浓度时,才会产生生物发光现象,这样会更有利于与费氏弧菌共生的海洋鱼类进行捕食和躲避天敌等活动[12]。作为互利共生的另一方,该海洋鱼类也会为费氏弧菌提供一个优越的生活环境,使其可以利用宿主体内丰富的营养物达到相当高的群落密度[13]。目前,以费氏弧菌的LuxI/R群体感应系统作为革兰氏阴性菌群体感应研究的一个经典模型(图1)。费氏弧菌的生物发光基因lux基因簇由8个基因(luxA~E、luxG、luxI和luxR)组成[14]。其群体感应系统包括两个操纵子luxICDABE、luxR。其中操纵子luxICDABE负责编码自诱导物合成酶基因(luxI)和发光基因(luxCDABEG)。LuxI合成信号分子N-3-氧-己酰高丝氨酸内酯(3-oxo-C6-HSL,OHHL)。而操纵子luxR负责编码信号分子受体蛋白LuxR。在细胞密度较低的情况下,luxI进行基础水平的转录,随着细胞密度增加,OHHL在培养基中不断积累,在达到阈值水平后会与LuxR的自诱导域结合形成复合体。然后,LuxR-OHHL复合物会结合到luxI上游的lux启动子区域(lux盒),启动荧光素酶亚基基因luxICDABEG的表达[15],实现费氏弧菌群体的发光。同时,会形成正反馈回路,进一步表达luxI并产生更多的OHHL[16]。
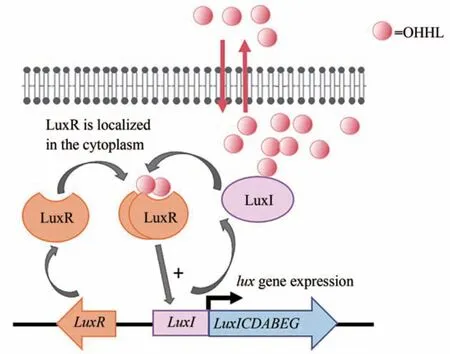
图1 LuxI/LuxR群体感应系统示意图(以V.fischeri为例)Fig.1 Schematic of LuxI/LuxR quorum sensing system(V.fischeri as an example)
除了LuxI/R群体感应系统外,海洋细菌——夏威夷弧菌(Vibrio harveyi)同时具有革兰氏阴性菌和阳性菌群体感应的调控系统以共同调控生物发光现象[17]。与其他革兰氏阴性菌一样,夏威夷弧菌会产生信号分子AHL作为自体诱导物(AI-1),但它的信号感应及传递组分则类似革兰氏阳性菌的双组分蛋白质[18]。夏威夷弧菌还会产生第2套自体诱导系统AI-2,与其他细菌中的高丝氨酸内酯类自体诱导物不同,是由LuxS蛋白合成,一般作为细菌种间信息交流的信号分子[19]。夏威夷弧菌的群体感应系统的具体调控方式如下:在细胞密度较低时,由于缺少AI-1和AI-2,LuxN和LuxQ作为磷酸激酶会将LuxN磷酸化,随后将LuxO磷酸化,磷酸化后的LuxO成为活性阻遏蛋白,间接抑制编码荧光素酶基因luxCDABE的转录,因此在细胞密度较低时夏威夷弧菌不产生荧光。当细菌种群密度达到一定阈值后,自体诱导物AI-1和AI-2会分别与LuxN和LuxPQ作用,使其在具备磷酸酶活性后将信息传递到磷酸转移蛋白酶LuxU,从而使LuxO去磷酸化成为无活性阻遏蛋白,解除对luxCDABE的抑制作用,使夏威夷弧菌发光[20]。与此机制相似,霍乱弧菌(Vibrio cholerae)也是利用磷酸化-去磷酸化这一复杂的群体感应系统来调控基因的表达[21]。
1.2 生物被膜形成的群体感应系统:Las/Rhl/喹诺酮群体感应系统
铜绿假单胞菌(Pseudomonas aeruginosa)是引起癌症、艾滋病和囊性纤维化(cystic fibrosis,CF)等疾病的重要条件致病菌,可以从土壤和水中分离得到,通过高丝氨酸内酯介导的QS系统调控其生命活动过程[22-23]。铜绿假单胞菌之所以成为一种典型的条件致病菌,主要是因为它可以协同释放毒力因子,包括外蛋白酶、脂肪酶和外毒素等,其中绝大部分毒力因子由群体感应调节[24]。此外,铜绿假单胞菌经常会黏附于人体组织表面,通过分泌一些脂质蛋白和纤维蛋白,将其自身包裹其中形成一个高度组织化的膜样聚合物,即生物被膜,从而抵御人体免疫系统以及传统抗生素的治疗[25]。群体感应系统会通过调控生物被膜结构形成、细菌黏附以及其从生物被膜上解离并重新定植等过程,进而影响铜绿假单胞菌的耐药性。研究发现铜绿假单胞菌群体形成生物被膜后,耐药性会有显著提高[26],其机制很有可能是生物被膜会阻止抗菌药物进入膜内尤其是对膜内较深层的细菌发挥作用。
铜绿假单胞菌的群体感应系统包含基于酰化高丝氨酸内酯的Las、Rhl信号系统[27]以及基于2-烷基-4(1H)-喹诺酮[2-alkyl-4(1H)-quinolone,AHQ]的喹诺酮信号系统等[28],它们共同构成了一个非常复杂的级联调控系统。之前通过大量的遗传学研究揭示了LasR/I和RhlR/I这两个群体感应系统,Las和Rhl系统的自诱导分子分别是AHL同系物3-氧十二烷酰高丝氨酸内酯[N-(3-oxododecanoyl)-Lhomoserine lactone,3-oxo-C12-HSL]和丁基高丝氨酸内酯(N-butanoylhomoserine lactone,C4-HSL)。Las、Rhl系统分别由转录激活因子lasR、rhlR和信号合成酶lasI、rhlI组成。通过这两个群体感应系统的作用,细菌可以在不同的感染阶段表达不同的毒力因子,提高毒性[29]。而喹诺酮类则包含较多的自诱导分子,2-庚基-3-羟基-4-喹诺酮(2-heptyl-3-hydroxy-4-quinolone,PQS)和其前体2-庚基-3-羟 基-4-喹啉(2-heptyl-3-hydrox-y-4-quinoline,HHQ)就是其中的两种。在Las系统中,细胞种群密度较低时,LasI会产生较低水平的3-oxo-C12-HSL。随着种群密度不断增加达到一定阈值后,3-oxo-C12-HSL会与LasR结合。它们形成的复合物LasR-3-oxo-C12-HSL会激活很多基因进行转录,包括lasB、toxA、rhlR和lasI。当复合物激活lasI后,会产生一个积极的正反馈调节通路。同时3-oxo-C12-HSL本身也具有免疫调节活性,单独的3-oxo-C12-HSL与铜绿假单胞菌的毒力有关。而当复合物激活rhlR时,则会发生Las和Rhl群体感应系统的级联效应,而且会在转录水平后期控制RhlR的活性。随后,RhlR会激活一些生产各种次生代谢物(如氰化氢)相关基因的表达。同时,RhlI/R系统可反馈调控LasI/R系统的表达。此外,喹诺酮群体感应系统的信号分子PQS与Las、Rhl系统也存在一个级联调节的关系。PQS的合成受到LasI的正调节和RhlI的负调节,同时PQS系统可以正调节RhlI、LasI的表达[30]。这3个系统互相调控,可以使细菌更好地适应环境,而且喹诺酮信号系统对细菌自身致病性和环境适应力具备更多一层的控制[31]。
1.3 孢子形成的群体感应系统:CSF群体感应系统
枯草芽孢杆菌(Bacillus subtilis)是芽孢杆菌科的模式菌株,单个细胞呈杆状,无荚膜,周生鞭毛,可产芽孢。由于其在自然界中广泛存在,具有耐高温、耐酸碱和耐挤压等特性,目前该菌主要作为产酶菌用于工业、农业、医药卫生和食品保健等领域[32-33]。在枯草芽孢杆菌群体感应系统中主要涉及两种信号分子:ComX信息素和感受态及产孢因子(competence and sporulation factor,CSF)。ComX编码含有55个氨基酸残基的Pre-ComX前导肽,Pre-ComX再经异戊二烯转化酶ComQ的处理和修饰后分泌到细胞膜外[34]。该信息素的活性由ComP/ComA双组分调节系统控制,当细菌种群密度达到阈值后,信息素会与膜上的相关受体ComP结合,激活该酶,促进其自我磷酸化;同时,磷酸化的ComP(ComP~P)会使磷酸化的ComA(ComA~P)被激活。ComA~P会直接激活相关下游基因的表达,例如激活srfA启动子,诱导枯草芽孢杆菌的亚群分化进入感受态[35-36]。CSF由基因PhrC编码,是一种物种特异性的群体感应分子,使不同菌株的枯草芽孢杆菌之间可以通过群体感应来交流。在寡肽通透酶(oligopeptide permease,Opp)的作用下,胞外CSF被转运至细胞内[37]。当胞内浓度较低时,CSF可以促进感受态的发展,其与磷酸酶RapC结合并抑制其活性,使磷酸化ComA的水平上调,促进ComS的表达。伴随着环境内条件的恶化、营养物质的消耗,胞内CSF在达到一定阈值浓度后会促进细菌亚群分化进入孢子形成阶段[38]。
1.4 产生毒力的群体感应系统:Agr群体感应系统
金黄色葡萄球菌(Staphylococcus aureus)是一种常见的人类致病菌,也是多种急慢性感染病的病原体,会分泌大量毒性因子例如毒素、溶血素和酚溶调控蛋白等。Ji等[39]研究发现,金黄色葡萄球菌致病基因的表达受细菌细胞密度影响。在Agr群体感应机制的调控下,自诱导肽作为信号分子分泌到胞外,通过响应一系列下游信号分子来驱动致病基因的表达。Agr群体感应系统的核心agr操纵子包括AIP的前体肽合成酶AgrD、负责编码加工蛋白的AgrB、编码组氨酸激酶感应器的AgrC和诱导转录的反应调节器AgrA。在这个群体感应系统中,AgrD在正常情况下会保持一个较低的表达量,在AgrB的加工下得到了信号分子AIP并不断分泌到胞外。当胞外AIP浓度达到一定阈值后会激活AgrC,使其发生自磷酸化并将反应调控子AgrA磷酸化,磷酸化后的AgrA~P会结合到agrABCD上游的启动子区域,形成正反馈,启动agrABCD基因和其他受Agr调控系统控制基因的表达[40],最终实现目的基因的表达调控。
2 参与种内细胞间通讯动态调控的合成生物学群体感应基因线路
在微生物群体中,细菌会受到与其相邻的同种或不同种细胞的相互作用以及外界环境的影响。它们之间长期共生共存,通过不断进化形成了复杂的信号分子交流系统。细菌通过群体感应调节系统产生和感应化学信号分子,以物种复杂性和种群密度依赖的方式同步调控一组基因的表达,使得细菌群体之间进行相互作用和牵制,最终达到相互适应[41-42]。目前,对群体感应系统的研究已相对透彻,作用机理也逐渐清晰,其被广泛应用于表征复杂的胞内应答机制和构建不同的群体感应基因线路,对于合成生物学发展具有深远的影响。细菌的群体感应系统主要分为种内细胞间通讯和种间细胞间通讯两大类,目前对于群体感应种内细胞间通讯的研究和综述相对较多地集中在生物被膜形成、群体感应猝灭以及环境监测等方面,而在构建生物计算工具、调控种群密度和调节代谢流等方面相对较少。因此,下文将首先着重介绍合成生物学中拨动开关、生物传感器和逻辑门近年来在群体感应种内通讯方面的主要研究成果。
2.1 拨动开关
代谢工程领域的主要目的是利用多基因重组技术来提高目标产物的产量及生产效率。该领域传统的改造方式主要是基因敲除和过表达,但基因敲除可能会导致菌体的生长状况下降[43-44]。因此,需要适时激活和关闭特定基因的表达。拨动开关就是解决这一问题的有利工具,其是一大类代谢调控开关,可被应用到合成基因线路中来提高目标产物的产量[45]。本实验室Gu等[46]通过抑制蛋白失活、阻断竞争途径和过表达关键酶,将野生型大肠杆菌BW25113的莽草酸酯产量提高到1.73 g/L。然后构建了一个可调控aroK表达的拨动开关,发现重组菌株P-9中aroK的表达在生长阶段会维持一个较高的水平,然后在适当的时间内可以通过添加最佳浓度的诱导剂降低表达水平。最终发现重组菌株P-9可以在不添加任何芳香化合物的情况下产生13.15 g/L莽草酸,证明营养缺陷型合成莽草酸盐的大肠杆菌构建成功。
现在,研究者们通过将拨动开关与群体感应系统相结合,尝试构建一系列新的基因线路来达到改造目的,实现细菌群体的种间通讯。有研究表明,群体感应通讯系统不仅会参与微生物致病基因的表达调控,也会直接影响微生物的耐药性[47-48]。由于分泌抗癌蛋白的沙门菌对肿瘤具有抑制作用,但非特异性表达会对健康组织造成伤害。因此Swofford等[49]为了构建对肿瘤敏感的基因表达开关,避免对健康组织造成伤害,他们将Lux群体感应系统和一个GFP荧光报告基因共同整合到非致病性沙门菌中。通过将QS系统和组成型的沙门菌共同注射到荷瘤小鼠体内,对小鼠体内蛋白水平的表达进行定量。同时利用免疫荧光技术对肿瘤内的细菌和荧光蛋白GFP进行定量定位,发现新构建的开关能作为一种很有用的癌症治疗工具,其可以很好地对肿瘤进行靶向治疗,同时对健康组织无任何损害。
Soma等[50]在大肠杆菌中将lux启动子和正反馈回路相结合,构建了一个合成的Lux系统作为细胞密度可调传感器。研究者利用该系统来触发代谢拨动开关(metabolic toggle switch,MTS),通过将两者整合构建了QS-MTS。利用QS-MTS在理想的细胞密度下,实现了代谢流从TCA循环到异丙醇生产的重定向,从而显著提高了异丙醇的产量。
能够实现自我调节和代谢流重新定向的工程菌株可以最大限度提高目标产物的产量,并降低对发酵过程的人为监控需要。所以研究者投入大量心血去构建一种独立于通路、诱导和干预的基因装置,Gupta等[51]设计了QS机制来调控pfk-1基因(该基因决定糖酵解和细胞生长的碳通量)的表达,从而可根据所需的时间和细胞密度来确定关闭基因表达的最佳点。当AHL不存在时,转录调节因子EsaR170V将与PesaS结合。随着细胞密度的不断增加,AHL逐渐积累后会降低EsaR170V的活性,并关闭pfk-1基因的表达。因此,大多数葡萄糖将会转移到生产途径以提高肌醇(myoinositol,MI)产量。
大多数情况下,研究者都是使用一种单一、常见的策略对代谢通量路径进行动态调控。而Doong等[52]将通路无关策略和通路特异性策略相结合,构建了涉及两个动态正交可调策略的控制机制,这种机制可实现分层调控,独立调节两种不同酶的表达,从而提高D-葡萄糖醛酸的产量。在达到AHL浓度阈值后,基于QS系统的通路无关策略会将葡萄糖的利用从糖酵解转化为D-葡萄糖醛酸的生产,从而将细胞从“生长”模式切换到“生产”模式;而通路特异性策略则是以肌醇作为中间代谢物传感器来实现动态自主控制,从而提高D-葡萄糖醛酸的产量。
目前,大多数关于QS系统的报道都依赖于基因表达的下调而非上调,极大限制了其作为调控代谢通量分子开关的潜力。Cui等[53]构建了基于两个天然启动子PabrB(Spo0A-P下调)和PspoiiA(Spo0A-P上调)的双功能模块化Phr60-Rap60-Spo0A QS系统。通过改变Spo0A-P结合位点的位置、数目和序列,构建了一个具有上调和下调能力的启动子库。然后,将双功能模块化系统运用到枯草芽孢杆菌168中menaquinone-7(MK-7)的生产,通过该动态途径调控后MK-7的产量显著提高40倍。本实验室Gu等[54]也构建了基于Esa-QS系统的双功能动态开关,能够在不同的时间和间隔上同步基因的上调和下调。将该双功能动态开关应用于5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)和聚β-羟基丁酸(polyhydroxybutyrate,PHB)的合成后发现产量分别会提高6倍和12倍。
以上研究均将QS系统与代谢拨动开关相结合,在达到细胞密度阈值后激活合成线路,从而实现自诱导代谢状态的转变。随着这一机制在代谢工程中的应用不断成熟,工程微生物群落和QS诱导的代谢开关相结合会继续为合成生物学做出新的贡献。
2.2 生物传感器
随着人们对构建具有调控细胞功能的新型生物元件的兴趣日益浓厚,人们开始对生物计算领域的创新工具进行不断的探索。而生物传感器因其易使用、成本低,在相关的生理环境条件下能提供实时数据的优良性能受到了广泛的关注[55]。例如,一种不需要蛋白转录因子参与而直接由核酸感受胞内信号分子或胞外环境变化的调控模式,即核糖开关。其是适体结构域和表达结构域的组合,可以通过感应底物浓度高低实现对基因表达的动态调节[56]。但由于缺乏对配体和适体结合方式的正确认识以及合适的筛选方法,所以对天然核糖体的改造存在一定的困难。本实验室Pang等[57]提出了N-乙酰神经氨酸(NeuAc)核糖开关在体内进化和筛选的策略。选择了一个高阈值的核糖开关对一些途径和关键酶进行优化,再以葡萄糖为唯一碳源进行试验后发现N-乙酰神经氨酸的最高产量可达14.32 g/L。
之后,有很多研究发现生物传感器与群体感应系统相结合后,可以作为一种新的微生物改造途径来实现自诱导代谢状态的转变。例如基因工程全细胞生物传感器,它是利用细菌蛋白和通路检测特定物质的有力工具,已被广泛应用于合成生物学研究中,包括对群体感应分子(quorum sensing molecules,QSMs)的检测[58]。Raut等[59]构建并优化了基于哈维弧菌BB170菌株的AI-2全细胞传感系统。当AI-2进入细胞后会与LuxP结合,LuxP在与AI-2结合时构象会发生改变,进而启动luxCDABE的转录,促进荧光素酶及其底物的表达,最终导致生物发光,依赖荧光素酶产生的光信号与细胞环境中的AI-2成正比。因此,该系统可应用于检测炎症性肠病(IBD)患者唾液、粪便和肠道样本中的AI-2水平,为炎症性肠病早期的检测和诊断提供高效、敏感度高、便利的方法。基于群体感应机制的全细胞生物传感器在医学诊断与检测方面发挥了很大的作用,在生物防治和生态环境保护方面也提供了有力的帮助。例如汞污染,汞广泛应用于化学品制造工业或电子制造领域,但是它具有很强的生物毒性。因此,研制一种经济高效、操作简便、对环境友好的重金属汞生物检测方法就显得极为重要。Cai等[60]将基于群体感应的正反馈系统与汞特异性操纵子MerR相结合,构建了一种含工程化Hg2+可调MerR蛋白的汞特异性全细胞生物传感器。通过含MerR蛋白的汞特异性操纵子来控制LuxⅠ的表达,形成的LuxR-AHL复合物会依次激活Prlux并表达RFP。同时设计了QS1、QS2和QS3三种策略来验证生物传感器的实际输出信号的放大效应,发现含有正反馈体系的全细胞探针对汞离子有很高的灵敏性。而且,把荧光信号拟合到经典的Hill方程,发现构建的探针对汞离子的响应接近于超灵敏曲线。除此之外,Thapa等[61]利用生物发光的原理研制了一种光生物传感器来检测环境中污染物的存在,将光纤技术和光电二极管结合来检测发光并将光信号转换为可测的电信号。该装置可通过基于群体感应机制的Lux操纵子来调控发光过程,从而对检测重金属具备一定的特异性。当环境中有重金属存在时细菌的发光现象会有所减弱,但当监测到钡元素时却发现发光现象既存在上升也存在下降,也就是说构建的光生物传感器可以很好地对环境中的污染物进行定性、定量的检测。
在合成生物学领域,许多的生物工程系统和生物元件被用于设计实用性强、操作方便的临床检测工具。但是,只有少数研究证明了这些检测工具在临床上的基础功能性[62-63],并未考虑到临床测试样品的复杂性以及如何达到临床检测工具的最优化。因此,研究人员开始使用无细胞蛋白质合成系统作为生物传感器来进行病原诊断和治疗[64]。Wen等[65]构建了一种在无细胞蛋白表达系统中的模块化DNA编码传感器,其可用于检测囊性纤维化疾病患者痰标本中铜绿假单胞菌感染的标志物。在优化无细胞系统后进行试验发现该生物传感系统可以在纳摩尔水平上定量检测痰样品中的群体感应信号分子3-oxo-C12-HSL,有助于提高临床诊断速度。
2.3 逻辑门
近年来,随着合成生物学的迅猛发展,在微生物中构建了具有复杂基因线路的多种逻辑门调控系统,以期实现在空间、时间和种群尺度上的精确调控。正反馈线路和负反馈线路在物理系统和生物系统中普遍存在[66],这两类系统之间的相似性以及复杂性吸引了很多的研究人员来开发生物分子计算系统,除了研究拨动开关和生物传感器,他们在逻辑门和其他生物控制线路相结合的方面也取得了丰硕的研究成果[67]。逻辑门又称“数字逻辑电路基本单元”,执行“或”“与”“非”“或非”“与非”等逻辑运算的电路。早在2002年,就有研究者构建了一种通过外源添加信号分子启动线路响应的与门系统[68]。在该逻辑门中,以外源添加IPTG和ATC作为诱导剂输入,同时响应后以激活GFP的表达作为输出。由于大多数基因线路的报告基因仅是荧光蛋白,基本都用来做信号检测。所以,之后有更多的研究者致力于在微生物中将Lux、Las和Rhl等群体感应系统与基因线路相结合,构建基于QS系统的各种逻辑门,以期在群体水平上更好地协调细胞行为,进而促进在生物医学和环境防治等诸多方面的应用。Hu等[69]在奥奈达希瓦菌(Shewanella oneidensisMR-1)mtrA基因敲除突变株中构建了一个基于Lux群体感应模块的与门系统,实现了逻辑门在微生物燃料电池(MFCs)中的应用。他们首先将IPTG应答模块、QS模块和输出模块(报告基因或靶基因mtrA)整合在一起,形成与门系统来控制细菌胞外电子转移。当Lux-AHL的浓度达到阈值后会与LuxR结合,促进Lux启动子的激活。与此同时,伴随着IPTG的加入,会解除Lacl蛋白对tac启动子的抑制。当这个与门系统的两个输入信号同时响应时,胞外电子便开始转移。
在利用群体感应系统设计与门动态调控线路中,已广泛存在多个操纵子调控单个启动子的行为。但是当细胞同时识别两个外源信号时,也有可能会启动系统中基因的表达。因此,可以结合内部信号和外部信号调控来同时驱动基因表达,其中当外源添加诱导剂时,细胞只有处于特定生理状态下才会启动基因表达。Shong等[67]已经构建并表征了两个合成的与门启动子,它们需要群体感应信号和一个外源添加的诱导剂才能启动基因的表达。LEE和TTE的基因表达都需要两种信号分子,只有一方存在时都无法观察到基因高于本底水平的表达。研究者通过添加AHL内源性产物来评估启动子以依赖QS方式发挥作用的能力,并观察到只有外源性IPTG或者ATC存在的情况下,基因表达才会随着细胞密度的增加而增加。因此,研究者所构建的与门调控系统可作为一个新调控系统的模型,将QS系统和其他基因线路相整合,以实现代谢工程应用中基因表达的动态变化。
现在已经发现QS系统在代谢工程中具有广泛应用,可以动态调控目标生产基因的表达。由于细胞的生理状态会影响代谢调控,因此本实验室He等[70]设计了一个自诱导的与门调控系统,其可通过同时感应细胞浓度和细胞的生理状态对该系统进行响应。首先进行LuxR的随机突变及luxRI启动子的优化,获得了一系列可感应不同细胞浓度的可变QS系统,同时通过检测细胞生长过程中的荧光强度,选择对应的稳定期感应系统。最终将新构建的系统应用于PHB生产中,发现PHB产量可提高1~2倍。研究者构建的合成逻辑门能够成为代谢工程的一种工具,作为一种通用的动态感应系统,无需特定的感应因子即可感应复杂的信号。
在合成生物学中每个生物元件都被当作一个乐高单元,通过改造、组合得到执行不同功能的合成基因网络。在过去的10年中,基于合成生物学背景设计的拨动开关、生物传感器以及逻辑门通过与一些生物控制线路相结合,在食品医药和环境改制方面取得了较大的成果,为防控人类微生物病害、克服微生物耐药性问题提供了有益的借鉴,促进微生物学与遗传学、植物保护学等其他学科的交叉渗透和共同发展。
3 参与种间细胞间通讯动态调控的合成生物学群体感应基因线路
在合成生物学和微生物学快速发展、交汇融合下,基于群体感应模块设计的基因合成线路已迅速发展为近年微生物学领域的研究热点。细菌的种内群体感应系统的特异性可以保证细菌在一个复杂的环境中识别自己,准确地实现信息交流。但由于细菌在自然界中并不是独立存在的,它们之间相互影响,既存在共生关系,也存在竞争关系。所以为了更好地适应复杂多变的环境,细菌可以通过种间交流的方式来启动特定基因的表达,从而控制整个群落的状态,提高整个群体的生存能力[71]。所以,下文将详细综述群体感应系统在种间细胞间通讯的应用前景。
3.1 控制种群密度
代谢工程旨在根据已有的细胞代谢网络进行设计,通过重组来再次分配所需途径的代谢通量,进而实现高价值药物、营养品和工业化学品的高产[72]。在利用底物生产理想目标产物的过程中,只依靠天然代谢途径无法达到产率最大化。所以为了重构碳代谢途径,提高产率,本实验室Wang等[73]通过将糖酵解途径、戊糖磷酸途径和“双歧分流”相结合,在大肠杆菌中构建了一个EPbifido途径。将该途径应用到PHB、甲羟戊酸和脂肪酸的生产中,发现可以很好地降低二氧化碳排放并提高产物的摩尔转化率。但An等[74]和Goo等[75]证明微生物生长环境中的营养物通常有限,而且相对拥挤的环境不利于微生物的生长和代谢。因此,调控种群密度对于提高代谢物的产量具有重要意义。Patidar等[76]以扁藻和百慕大公海橄榄菌为研究对象,采用两阶段培养模式进行共培养,评估不同胁迫条件下生物燃料的生产情况。基于共培养模式,百慕大公海橄榄菌及其代谢物可以与扁藻相互促进生长,从而提高脂质产量。HHQ和PQS通过增加百慕大公海橄榄菌的细胞丰度,在生物表面形成生物膜,介导了互惠互利的共生作用。然而,当HHQ和PQS浓度较高时,可以抑制扁藻的生长。
肠道微生物群在建立和维持宿主健康方面具有关键作用。Kim等[77]利用群体感应机制在天然大肠杆菌和减毒鼠伤寒沙门菌之间重新构建了一个信息传递系统。研究者将一个物种功能化使其产生可诱导的信号,而另一个物种则可以利用基因集成线路进行信号的检测和记录。这个新构建的信号传输系统成功实现了小鼠肠道内微生物的种内和种间信号传递,为进一步了解其他环境中细菌间的相互作用提供了一定的基础。
1.1.3 仪器:日立7020型全自动生化分析仪;Beckman-Coulter MAXM血球分析仪;电子称(常熟市双杰测试仪器厂产品);万分之一电子天平(梅特勒-托利多仪器(上海)有限公司产品);Thermo BIOFUGE PRIMO R型离心机。
Brexó等[78]发现在利用甘蔗生产生物乙醇的过程中,不可避免地会产生乳酸菌(LAB)和野生酵母。而且,乳酸菌和酵母在发酵罐中共存时产生有机酸和其他细胞外代谢物,导致乙醇产量减少。在发酵过程中细胞间的相互作用会促进细菌和酵母之间的交流,它们很有可能通过群体感应共存。因此,进一步了解基于群体感应进行共存的机制,可产生一系列相关的理论和技术支持,进而为生物燃料行业做出一定贡献。
现在,很多微生物生态学家尝试构建一些小型的合成生态系统来探索种群之间调控机制的复杂性。Scott等[79]将两个正交的QS机制和种群控制机制相结合,来控制竞争性的鼠伤寒沙门菌的种群密度。Lux-QS和Rpa-QS可以与两个裂解基因结合,在两株细菌中形成SLCs来进行调控。研究结果表明,当Lux-QS和Rpa-QS与裂解基因结合后进行共培养时,它们之间的初始种群比为100:1,在10 h后种群比就可以达到1:1。但当没有裂解基因存在时,对两株菌进行共培养后将会被Lux-QS菌株接管。即整合两个正交的QS机制以形成正交分解系统对于稳定竞争菌株的共培养具有很大优势。
3.2 振荡子
在大规模基因调控网络中,只使用少量的调控因子就可以调控相对较多的基因,进而协调复杂的细胞行为。很多的代谢活动,例如种群控制、激素分泌、昼夜节律等都与同步振荡密切相关[80-82]。所以有很多研究者对于构建振荡子模型产生了极大兴趣,构建合成基因振荡器(SGOs)也就成为合成调控研究的主要方向之一。McMillen等[83]在大肠杆菌中将由PRE启动子、基因X(cii)和基因Y(ftsh)组成的弛豫振荡器与Lux-QS机制相结合,利用细胞间信号传导机制来耦合振荡器并诱导同步振荡。蛋白Ftsh可以降解cii,而AHL与LuxR的复合物则可以激活cii的转录。当胞内AHL浓度达到阈值时,它可以与其他细胞中的另一个LuxR结合,调节其cii水平。通过对系统进行建模,也证明了新构建的机制的确会实现跨细胞群的同步行为。
虽然振荡子在合成生物学方面的应用已经取得了较大的进展,但是在一个复杂的环境中寻求构建一个稳定的基因线路还是相对较难的。这种复杂的环境会导致基因线路中相当大的细胞间差异,有可能会阻碍菌落水平上的功能。Prindle[84]等通过将遗传弛豫振荡器、群体间的气相氧化还原信号和Lux-QS系统整合在一起,在不同的菌落间形成耦合的遗传“生物混合体”。当不含亚砷酸盐时,ArsR会抑制LuxR的表达,从而无荧光和振荡的产生。但是当亚砷酸盐含量足够时,这种抑制作用会被解除,LuxR-AHL复合物将会促进荧光基因的表达和振荡产生,最终实现数千个振荡的群体在厘米尺度上的同步。
合成生物学基于振荡子的应用除了之前存在的问题,还面临一个挑战是要创造出基于种群水平行为的微生物协同系统,可利用细胞信号传导机制来调节多种细胞类型的基因表达。Chen等[85]构建了一个由两种不同细胞类型组成的微生物联合体,其中一种是“激活”菌株,另一种是“抑制”菌株。这些菌株会产生两个正交的细胞信号分子,在双菌株合成线路中调节基因的表达。激活因子产生Rhl-AHL,促进两株菌株的靶基因转录,而抑制因子会产生Cin-AHL,抑制由LacI蛋白介导的两菌株的转录。除此之外,还存在一个负反馈回路,其中AiiA蛋白可以降解这两个AHL。这两个菌株只有共培养时才会产生群体水平的振荡。通过利用多合作菌株的基因工程来调控种群水平动态的能力,为构建具有多种细胞类型的复杂合成组织和器官指明了方向。
利用细胞信号传导机制来调节多种细胞类型的基因表达已经取得了成功,但如果要在土壤或肠道微生物群等复杂环境中使用合成多细胞系统,或者说与材料学相结合,那么通过细胞间信号进行跨时间和空间的基因协调表达将会非常重要。Kim等[86]构建了一个双菌株合成菌群,这两个菌株会产生两个正交的群体感应分子,从而形成一个可以连接正反馈和负反馈的调控网络。当在微流控装置中进行共培养时,这两个菌株会产生振荡现象。在大群体中,发现整个群体暂时的协调振荡是依赖于一个内在的正反馈线路的存在,该线路会放大和传递细胞间信号。即新构建的多细胞系统可以通过利用组成细胞间的短暂、短距离的耦合来实现基因的协调表达。
3.3 混合菌种的共培养
合成生物学和代谢工程元件的不断更新与改进为构建更加复杂、高效的微生物合成系统提供了有利的基础,但有可能会受到单个细胞中可用资源和环境的限制。为了解决这个问题,研究人员提出了一个策略,即共培养发酵,通过对亚群之间的物质进行协调分配来克服这些限制[87]。
Dinh等[88]构建了一种基于群体感应的生长调节线路,该线路提供了一种额外的参数用于调节发酵过程中共培养物的组成。该线路通过降低糖酵解通量和增加细胞密度来下调生长速率,细胞密度与生长速率下调的关系可以通过改变AHL合成酶的表达水平进行调节,从而在相同的接种比例下获得不同的共培养动态。将该线路应用于柚皮苷的共培养生产过程中,通过改变菌株的接种比例就可使滴度增加60%。此外,还证明了将生长控制线路与通讯模块相结合后,其中一个亚种群的细胞密度可调控另一个模块的转录,进而协调细胞间的行为,提高柚皮苷滴度。
许多变形杆菌可以利用群体感应来调控公共产品例如抗菌剂和蛋白酶的生产,这些公共产品可以在一个微生物群落中实现共享。Evans等[89]构建了一个实验室模型去研究群体调控抗菌剂在种间竞争中的重要性。在该模型中,伯克霍尔德菌和紫花色杆菌均使用了QS机制调控的抗菌剂来抑制其他物种的生产。研究者证明了在共培养模型中,波林菌素抑制了群体感应缺陷突变体的出现,而抗菌剂生产合作者的增加使得紫花色杆菌种群变得更具竞争力,即物种间的竞争可以通过限制有群体感应缺陷的突变体来加强合作行为。除此之外,由于铜绿假单胞菌QS系统参与调控多种公共产品的生产,可以很好地作为研究微生物合作的模型。Smalley等[90]对铜绿假单胞菌和多食双歧杆菌在实验室中进行共培养,并研究了3种铜绿假单胞菌QS系统调控的抗菌剂氰化氢、鼠李糖酯和吩嗪在生物竞争中的重要性。通过研究发现,铜绿假单胞菌和多食双歧杆菌共培养时,铜绿假单胞菌会占优势,这3种抗菌剂会共同促进铜绿假单胞菌的竞争力。这两种细菌都需要铜绿假单胞菌群体调节蛋白酶来促进生长,因此QS调控的抗菌剂对于铜绿假单胞菌很重要,可以防止双歧杆菌对公共产品蛋白酶的利用。
通过对QS机制在控制种群密度、构建振荡子模型以及混合菌种共培养这3个方面进行归纳总结,对细菌群体感应通讯系统有了更进一步的认识。有助于今后创建微生物群体感应通讯系统调控的新理论和新方法,通过人为地干扰或促进微生物群体感应系统从而调控某种功能。
4 结语与展望
细菌群体感应系统是近20年微生物学研究领域的重大发现之一,目前对其已有相对全面的认识和研究。细菌广泛存在于各个群落中,其可利用一些包括复杂的信号分子、信号传感器以及信号转导机制的细胞间通讯系统来快速适应不断变化的环境。本文详细综述了调控生物发光、生物被膜形成、孢子形成和产生毒力的群体感应系统,极大增进了对各类细菌中不同群体感应系统的了解,帮助深入研究各个调控网络之间的互作关系。自然界中的微生物群体感应系统非常复杂且多样化,还有很多的信号分子尚未鉴定,信号通路及调控机理也未明晰。因此,在小分子分离鉴定和蛋白质结构分析技术逐渐成熟的时代,应该投入更多的精力去研究和发展多样化、高效化的群体感应系统,帮助揭示细菌之间互作竞争的作用机制,使其获得竞争优势,从而极大增强了细菌在环境中的生存概率。QS系统对细菌种群的社会行为产生了很大的影响,使之可以更好地适应不断变化的环境。这些研究极大增进了人们对群体感应系统在细菌种内及种间细胞间通讯应用的了解,也进一步说明了研究微生物群体感应系统的重要性和复杂性。目前很多的研究都集中在生物被膜形成、环境检测和疾病防治等方面,对于生物计算工具的构建和调节种群密度方面的研究相对少一些。因此本文详细阐释了近年来细菌在种内和种间基于群体感应机制的动态调控应用,集中讨论了群体感应系统与各类基础调控线路相结合的生物计算工具的构建,以及以群体感应为基础的基因元件在控制种群密度、调节代谢流方面的改进,努力简化发酵过程,降低成本,实现精准调控并积极地向产业化方向靠拢。
积极开展基于群体感应的合成生物学改造技术对于明晰微生物之间的信息交流以及病原菌与寄主之间的通讯系统具有重大的科学意义和应用价值:首先对于细菌的基础群体感应系统原理和机制的了解,以及对细菌的群体感应通讯系统和病原-宿主跨界通讯系统的研究会帮助研究者建立一个相对完善的微生物群体感应研究体系。不但可以提供一些基础、科学的理论指导,还有利于研究者开拓基于群体感应研究的新思路和新方法。其次,基于群体感应的微生物通讯系统会参与调控细菌的多种生活习性以及各种生理过程,QS系统很好地承担着病原菌之间以及病原菌和宿主之间沟通的角色,使其成为防治生物疾病和治疗动植物病害的新突破口,也为发展新型绿色安全农业和健全医药服务提供了有益的借鉴。除此之外,群体感应基因线路已被广泛应用于工农医科等领域,在各个领域通过合成生物学手段构建新型的基因元件及合成线路,实现了代谢流重组和产量提高,同时还促进了微生物学、遗传学和植物学等各个学科的交叉融合和共同发展。但是目前仍有一些研究存在不足或尚未明晰之处,例如基于群体感应的动态调控存在一定的泄露,无法对靶基因的表达实现严谨调控;不同调控系统之间的正交性、有关种间细胞通讯的代谢流调控、脉冲发生器等方面的应用也需要进一步研究。今后,相信基于群体感应系统来优化动态线路的策略会在生物化工等领域有更大的发展空间。

