急诊肝动脉化疗栓塞术治疗原发性肝癌破裂大出血的疗效及预后影响因素分析
刘红霞,段宝民,张丽娜,徐静
开封市中心医院急诊科,河南 开封 475000
原发性肝癌作为世界第五大肿瘤,其病死率居恶性肿瘤第三位[1]。腹腔破裂大出血是肝癌的致死性并发症,中国肝癌自发性破裂发生率为3%~15%,早期及时诊断及积极治疗虽能有效控制肝癌破裂发生,但肝癌破裂大出血仍具有较高的致死率,既往调查研究报道,其致死率高达67%,严重威胁患者生命安全[2]。原发性肝癌破裂大出血的两个重要治疗阶段是急诊治疗及后续肿瘤治疗,目前临床上采取的治疗方式包括手术切除、肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)、保守治疗等,其中手术治疗是原发性肝癌最主要的治疗方式之一[3]。随着医疗技术的发展,TACE的疗效逐渐受到肯定,该手段是不能接受手术切除的原发性肝癌患者的首选治疗方式之一,对于出血量较多、无法行手术切除的患者,其能够有效止血,为后续肿瘤治疗提供基础,从而延长患者生存期,改善预后[4]。但关于TACE与手术切除对原发性肝癌破裂大出血的疗效及预后比较尚存在争议,基于此,本研究回顾性分析80例原发性肝癌破裂大出血患者的临床资料,旨在探讨急诊TACE与手术切除治疗肝癌破裂大出血的疗效及对预后的影响,并分析影响肝癌破裂大出血预后的因素,以期为延长患者生存期提供一定参考,现报道如下。
1 资料与方法
1.1 一般资料
收集2016年1月至2018年1月开封市中心医院急诊科收治的原发性肝癌破裂大出血患者的病历资料。纳入标准:符合《原发性肝癌规范化病理诊断指南(2015年版)》[5]诊断标准;伴有不同程度腹痛;经磁共振成像(MRI)、计算机断层扫描(CT)、B超等检查确诊为肝脏内占位性病变;行急诊手术或TACE;病历资料及随访资料完整。排除标准:合并其他恶性肿瘤;门静脉主干血栓形成且无侧支循环;严重凝血功能障碍;自身免疫疾病及全身疾病;大量腹腔积液或顽固性腹腔积液;全身性感染;伴有远处转移;弥漫性原发性肝癌;动脉-门静脉、肝静脉瘘、门静脉主干或左、右主干癌栓;妊娠期或哺乳期妇女。根据纳入、排除标准,共纳入80例原发性肝癌破裂大出血患者,按治疗方式不同分为TACE组(n=37)和手术组(n=43)。TACE组中,男性22例,女性15例;年龄38~68岁,平均(54.16±6.49)岁;肿瘤直径 3~12 cm,平均(7.62±4.11)cm;病因:乙肝22例,酒精性脂肪肝13例,其他2例;巴塞罗那肝癌临床分期(Barcelona clinic liver cancer,BCLC)[6]:B期25例,C期12例。手术组中,男性26例,女性17例;年龄36~70岁,平均(55.62±7.01)岁;肿瘤直径 3~12 cm,平均(7.54±4.36)cm;病因:乙肝24例,酒精性脂肪肝16例,其他3例;BCLC:B期29例,C期14例。两组患者性别、年龄、肿瘤直径、病因及临床分期比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
两组患者入院后均予以抗休克、维持生命体征等对症处理,均接受常规影像学检查,诊断明确后依据病情及患者自身状况接受手术或TACE治疗。
手术组患者均行手术切除肿瘤,依据临床常规手术采用第一肝门阻断方法,规则性切除左肝肿瘤,不规则性切除右肝肿瘤,尽可能根治性切除肝肿瘤,确保切缘距肿瘤边缘>2 cm。若术中发现存在肝内小转移癌,则行术中B超检查。
TACE组患者均行TACE治疗,患者取平卧位,碘伏常规消毒后采用Seldinger法行股动脉穿刺,插入导管成功后进行肝动脉造影,明确肿瘤出血部分、肿瘤供血动脉,然后在肿瘤出血血管插入微导管,经导管灌注5-氟尿嘧啶和奥沙利铂,再经微导管注入碘化油3~5 ml进行栓塞。术后予以止吐、保肝、抑酸等常规对症处理。
1.3 观察指标
①比较两组患者止血成功率。②两组患者均行静脉采血3~5 ml,以3000 r/min离心(半径15 cm)10 min后收集血清,并于-20℃低温保存。采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测两组患者治疗前及治疗后7天的血 清 热 休 克 蛋 白 90α(heat shock protein 90α,HSP90α)及甲胎蛋白(alpha fetal protein,AFP)水平。③术后进行为期1年的随访,采用电话随访、门诊随访、走访等形式,每个月进行1次,以患者死亡或随访截止时间为随访终点,比较两组患者生存情况及死亡原因,并绘制生存曲线。④采用Cox回归模型分析原发性肝癌破裂大出血预后的影响因素。
1.4 统计学方法
采用SPSS 22.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,同时间点组间比较采用两独立样本t检验,不同时间点组内比较采用配对t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验或Fisher精确概率法;采用Kaplan-Meier法绘制生存曲线;采用Cox回归模型分析影响因素;以P<0.05为差异有统计学意义。
2 结果
2.1 止血情况的比较
TACE组患者止血成功率为91.89%(34/37),3例患者行TACE后未能止血成功,其中1例患者死于失血性休克,另外2例患者再次手术止血成功,但死于肝功能衰竭;手术组患者止血成功率为97.67%(42/43),1例患者在行肝动脉结扎止血时再次出血死亡。两组患者止血成功率比较,差异无统计学意义(P>0.05)。
2.2 血清肿瘤标志物水平的比较
治疗前,两组患者HSP90α、AFP水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者HSP90α、AFP水平均下降,差异均有统计学意义(P<0.05),但两组比较差异均无统计学意义(P>0.05)。(表1)
表1 两组患者血清肿瘤标志物水平的比较(ng/ml,±s)
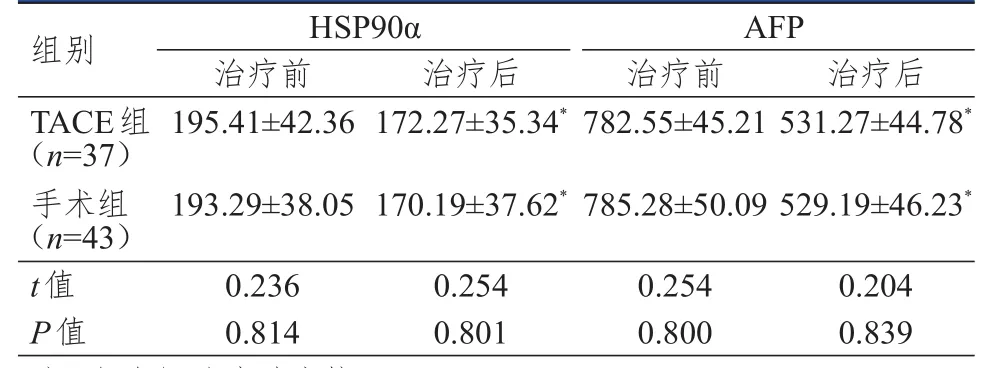
表1 两组患者血清肿瘤标志物水平的比较(ng/ml,±s)
注:*与本组治疗前比较,P<0.05
组别TACE组(n=37)手术组(n=43)t值P值195.41±42.36172.27±35.34*782.55±45.21531.27±44.78*193.29±38.05170.19±37.62*785.28±50.09529.19±46.23*0.2360.2540.2540.204 0.8140.8010.8000.839 HSP90αAFP治疗前 治疗后 治疗前 治疗后
2.3 生存情况的比较
TACE组患者中位生存时间为(8.90±3.27)个月,1年生存率为27.03%(10/37);手术组患者中位生存时间为(10.10±2.21)个月,1年生存率为30.23%(13/43);两组患者中位生存时间及1年生存率比较,差异均无统计学意义(P>0.05)(图1)。TACE组患者死亡率为72.97%(27/37),与手术组的69.77%(30/43)比较,差异无统计学意义(P>0.05)(表2)。
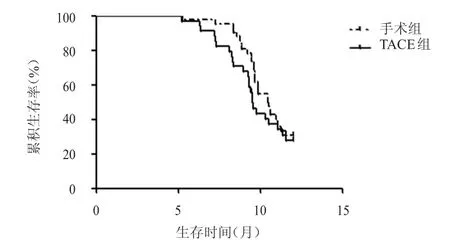
图1 手术组(n=43)与TACE组(n=37)患者的生存曲线

表2 两组患者的死亡原因
2.4 原发性肝癌破裂大出血预后影响因素的多因素Cox分析
以患者年龄(<60岁=0,≥60岁=1)、性别(男=0,女=1)、门静脉癌栓(否=0,是=1)、Child-Pugh分级(A级=0,B级=1,C级=2)、肿瘤分型(单发结节=0,多发结节=1,弥漫型=2)、分化程度(高分化=0,中分化=1,高分化=2)多个因素作为自变量纳入Cox分析模型,结果显示,门静脉癌栓、Child-Pugh分级、分化程度均是原发性肝癌破裂大出血预后的独立影响因素(P<0.05)。(表3)

表3 原发性肝癌破裂大出血预后影响因素的多因素Cox分析
3 讨论
肝癌破裂大出血是原发性肝癌的严重并发症之一,目前临床对于其发病机制尚未完全明确,但相关研究证实,肝癌破裂出血可能与下列因素存在联系:肿瘤生长太快导致破裂;肿瘤快速生长挤压正常肝脏组织表面细胞导致破裂;肿瘤癌栓阻塞静脉,导致其破裂出血;肿瘤小静脉破裂所致出血[7-8]。由此可推断,肝癌破裂大出血是由于肿瘤侵袭肝静脉导致血淤,加之肿瘤细胞生长过快导致的中心坏死与凝血功能障碍,腹内压升高、呼吸引起膈肌与肿瘤间的摩擦,此种状态下极易引起脆弱的肿瘤边缘组织破裂出血[9-10]。目前临床认为手术切除与TACE是治疗原发性肝癌破裂大出血的两种较好的方式,两种治疗方式各有优势,但临床如何选择尚且存在争议。
传统观念认为,肝癌破裂大出血患者已属于肝癌晚期,其预后较无肿瘤破裂出血的患者更差。近年来一项相关研究报道指出,原发性肝癌破裂出血患者远期生存率与非破裂出血患者相似[11]。Tarantino等[12]研究表明,约75%的肝癌破裂出血患者接受手术切除治疗后生存获益明显,且还有患者生存5年以上,认为及时治疗能够改善肝癌破裂出血患者的预后,延长生存期。针对肝癌破裂出血的治疗应先急诊止血,经评估后再考虑后续肿瘤治疗,手术切除是针对Child-Pugh A级与B级、出血量较少、肿块较小、未转移等患者的常用处理手段,能获得良好预后。既往相关研究报道,急诊手术治疗肝癌破裂出血的止血成功率可高达94%~100%[13]。TACE则是针对短期内出血量较多、Child-Pugh C级、存在合并症、机体状况较差等患者的常用处理手段,该方式是通过微创技术将导管选择性插入肿瘤出血血管中,同时向其中注入化疗药物及栓塞剂,其中化疗药物具有细胞毒性作用,通过损伤细胞遗传物质而起到诱导细胞凋亡的目的,有效发挥止血作用,从而降低病死率。相关研究报道,TACE亦具有较高的止血成功率,可高达93%~100%[14-15]。两种方式均是处理肝癌破裂出血的有效手段,临床应依据患者实际情况予以选择。
本研究中,TACE组患者止血成功率为91.89%,3例患者行TACE后未能止血成功,死于失血性休克,手术组患者止血成功率为97.67%,1例患者在行肝动脉结扎止血时再次出血而死亡,两组患者止血成功率比较无差异,说明TACE治疗原发性肝癌破裂出血与手术切除均具有较好的疗效,能够有效止血,以为后续肿瘤治疗提供基础。同时,本研究通过随访比较两组患者的生存情况,TACE组患者中位生存时间为(8.90±3.27)个月,1年生存率为27.03%(10/37),手术组患者中位生存时间为(10.10±2.21)个月,1年生存率为30.23%(13/43),两组中位生存时间及1年生存率比较均无差异,亦证实上述研究结果,TACE与手术切除均能够使患者获得较好预后,且延长生存期相近。而分析两组患者死亡率及死亡原因可知,肝癌破裂出血常见的死亡原因包括失血性休克、腹腔感染、肝衰竭、肝性脑病等,而既往相关研究报道,手术切除治疗肝癌破裂出血患者预后优于TACE[16],认为原因是手术切除患者本身肝功能及身体状况优于TACE治疗患者,同时手术切除能够最大限度阻止肿瘤细胞生长及转移,与本研究结果略有不同,推断可能与样本量较少、患者个体差异等因素相关。
HSP90α对于生理、病理状态下的细胞具有重要的维持作用,但相关研究证实,HSP90α还可表达于细胞表面,并分泌到细胞外发挥作用,而分泌型HSP90α则可在肿瘤患者的血液中检测到,其水平与肿瘤恶性程度呈正相关,与肝细胞侵袭、转移及微血管浸润等密切相关[17]。AFP则是临床常用的肝癌相关特异性肿瘤标志物实验室指标,既往研究指出,肝癌患者的AFP水平明显高于正常人,猜测其与肿瘤的发生、发展均具有一定联系[18]。因此HSP90α、AFP可作为评估肝癌病情严重程度及疾病转归的重要血清标志物。本研究中,两组患者治疗后HSP90α、AFP水平均下降,说明手术切除与TACE均对肝癌破裂出血患者具有一定疗效,能够改善血清肿瘤标志物水平,但治疗后两组患者HSP90α、AFP水平比较无差异,提示两种方式疗效相近,对于改善肝癌破裂出血病情、抑制肿瘤生长转移均具有一定作用。原发性肝癌破裂大出血预后影响因素的多因素Cox分析显示,门静脉癌栓、Child-Pugh分级、分化程度均是原发性肝癌破裂大出血预后的独立影响因素,说明门静脉癌栓、分化程度、肝功能分级与患者生存期密切相关。国外相关研究指出,门静脉存在癌栓会影响原发性肝癌破裂出血患者生存时间;而Child-Pugh分级会直接影响患者治疗方式的选择,从而可能影响预后[19-20]。由此可见,门静脉不存在癌栓、分化程度越高、肝功能分级越好的患者,获得长期生存时间的可能性越高。综上所述,急诊TACE与手术切除治疗原发性肝癌破裂出血均具有较高的止血成功率,能使患者生存获益,对预后影响相近,但实际临床选择治疗方式应依据患者肝功能、出血量、机体状态等具体情况而定;且门静脉癌栓、肝功能分级、分化程度均可能会影响肝癌破裂出血患者的预后。

