计算机断层扫描联合血清肿瘤标志物检测在胰腺癌诊断中的应用价值分析
康鑫崴,李祥哲,刘杰
周口市中心医院放射科,河南 周口 466000
胰腺癌是一种消化系统肿瘤,恶性程度高,发展迅速,预后极差,近年来国内外的发病率逐年增高[1]。由于早期胰腺癌患者缺乏典型的临床表现,肿瘤会逐渐生长并较早转移,因此临床初次诊断为胰腺癌的患者中有90%以上属于中晚期,错过最佳治疗时间,5年生存率很低[2]。胰腺癌的早期发现、早期诊断和早期治疗是降低患者病死率和改善患者生活质量的关键。因此,有必要提高胰腺癌在影像学和分子生物学中的认识和诊断能力,以便及时进行综合治疗,提高患者的生存率。计算机断层扫描(CT)具有较高的空间分辨率,并且价格较低、扫描时间短,是诊断胰腺疾病最常用的成像方法[3]。肿瘤标志物是指特征性存在于恶性肿瘤细胞或由恶性肿瘤细胞异常产生的物质,或是宿主对肿瘤的刺激反应而产生的物质,并能反映肿瘤发生、发展,监测肿瘤对治疗反应的一类物质。肿瘤标志物可以用于胰腺癌的早期诊断检查,其中以血清糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)和癌胚抗原(carcinoembryonic antigen,CEA)的阳性率最高[4]。本研究探讨CT联合肿瘤标志物CA19-9、CEA在胰腺癌诊断中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年1月至2019年12月在周口市中心医院治疗的胰腺癌和肿块型胰腺炎患者的病历资料。纳入标准:①胰腺癌、肿块型胰腺炎均经病理学检查确诊;②年龄<80岁;③在周口市中心医院接受CT检查;④CT检查前未行放化疗等治疗;⑤临床资料完整。排除标准:①CT图像质量欠佳;②合并其他系统恶性肿瘤。根据纳入、排除标准,共纳入胰腺癌患者95例及肿块型胰腺炎患者70例。胰腺癌患者中,男性62例,女性33例;年龄34~71岁,平均(54.40±7.20)岁;体重指数 19.72~23.30 kg/m2,平均(21.15±2.01)kg/m2。肿块型胰腺炎患者中,男性44例,女性26例;年龄32~74岁,平均(55.12±7.80)岁;体重指数19.50~23.55 kg/m2,平均(21.20±2.00)kg/m2。胰腺癌和肿块型胰腺炎患者性别、年龄、体重指数比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 CT检查方法
增强扫描采用GE 16层螺旋CT扫描仪。在扫描之前患者保持空腹,并在检查前30 min,口服500 ml水充盈胃肠道后进行扫描。扫描参数:厚度3 mm,准直2.5 mm,间距1 mm,电源120 kV,200 mAs,0.5 s,矩阵重建512×512,所有患者均接受上中腹部平扫三相增强扫描,每次扫描时间为6~8 s,动脉期扫描延迟时间设置为23 s,门脉期扫描延迟时间设置为60 s,胰腺期扫描延迟时间设置为40 s。造影剂碘海醇注射液300 mgI/ml,90~100 ml,通过前臂静脉团注,速率为3.0 ml/s。扫描后,根据原始数据进行薄层重建,重建层的厚度为1.25 mm,使用图像工作站生成图像进行图像分析。最终诊断结果由中级及以上职称影像科医师进行诊断。
1.3 血清肿瘤标志物检测方法
清晨采集患者5 ml空腹静脉血,3000 r/min离心5 min,通过免疫放射法进行检测,仪器为罗氏E170自动生化分析仪,诊断试剂盒购自德国罗氏(ROCHE)公司。
1.4 统计学分析
采用SPSS 22.0软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;采用灵敏度、特异度、阳性预测值和阴性预测值分析诊断价值,灵敏度=真阳性例数/(真阳性+假阴性)例数×100%,特异度=真阴性例数/(真阴性+假阳性)例数×100%,阳性预测值=真阳性例数/(真阳性+假阳性)例数×100%,阴性预测值=真阴性例数/(真阴性+假阴性)例数×100%;以P<0.05为差异有统计学意义。
2 结果
2.1 CT征象的比较
胰腺癌患者胰管扩张、血管受累和胰源性门静脉高压比例明显高于肿块型胰腺炎患者,胰管贯穿征比例明显低于肿块型胰腺炎患者,差异均有统计学意义(P<0.01);胰腺癌和肿块型胰腺炎患者病灶大小、病灶边界不清晰、病灶内囊变坏死、病灶内钙化和病灶不均匀强化比较,差异均无统计学意义(P>0.05)。(表1)
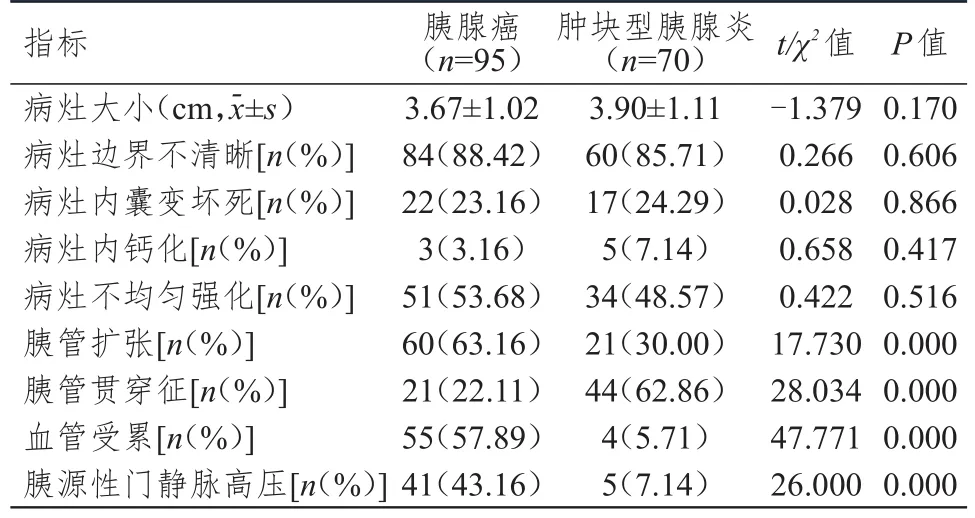
表1 胰腺癌和肿块型胰腺炎患者CT征象的比较
2.2 CT值的比较
胰腺癌患者病灶动脉期CT值明显低于肿块型胰腺炎患者,差异有统计学意义(P<0.01);胰腺癌和肿块型胰腺炎患者平扫、门静脉期和延迟期CT值比较,差异均无统计学意义(P>0.05)。(表2)
表2 胰腺癌和肿块型胰腺炎患者CT值的比较(HU,±s)

表2 胰腺癌和肿块型胰腺炎患者CT值的比较(HU,±s)
组别胰腺癌(n=95)36.89±6.0250.20±9.8972.20±11.4378.92±12.12炎35.44±7.1061.18±10.1274.50±12.2180.20±11.54 1.416-6.979-1.241-0.684 0.1590.0000.2160.495肿块型胰腺(n=70)t值P值平扫 动脉期 门静脉期 延迟期
2.3 血清CA19-9、CEA水平的比较
胰腺癌患者血清CA19-9和CEA水平均明显高于肿块型胰腺炎患者,差异均有统计学意义(P<0.01)。(表3)
表3 胰腺癌和肿块型胰腺炎患者血清CA19-9、CEA水平的比较(U/ml,±s)

表3 胰腺癌和肿块型胰腺炎患者血清CA19-9、CEA水平的比较(U/ml,±s)
组别胰腺癌(n=95)肿块型胰腺炎(n=70)t值P值170.28±67.7011.28±2.92 89.39±22.316.80±2.40 9.61310.487 0.0000.000 CA19-9CEA
2.4 CT及CT联合CA19-9、CEA对胰腺癌的诊断价值
CT联合CA19-9、CEA诊断胰腺癌的灵敏度高于CT检查,差异有统计学意义(P<0.05);CT联合CA19-9、CEA及CT单独诊断胰腺癌的特异度、阳性预测值、阴性预测值比较,差异均无统计学意义(P>0.05)。(表4)
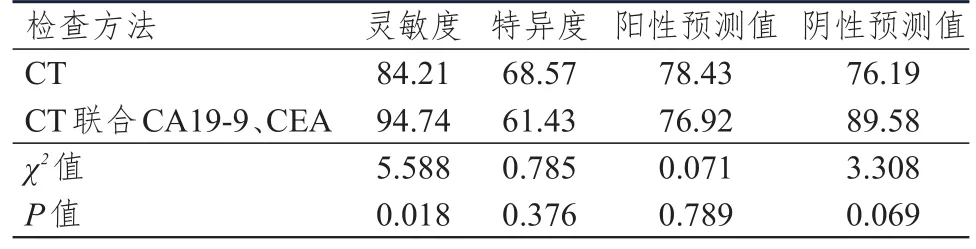
表4 CT及CT联合CA19-9、CEA对胰腺癌的诊断价值(%)
3 讨论
胰腺癌是高度恶性的消化道肿瘤,预后差,主要是胰头癌,约90%是起源于导管腺上皮的导管腺癌,在男性患者中更为常见[5]。胰腺癌的早期诊断有一定困难,一旦发现,通常处于晚期,预后极差。肿块型胰腺炎是一种特殊类型的慢性胰腺炎,是由各种胰腺炎症引起的炎症迁延不愈导致胰腺局限性肿块形成[6-8]。肿块型胰腺炎患者的主要临床症状是恶心、呕吐、腹胀等,而组织病理学常表现为腺泡萎缩、炎症、假性囊肿等[9]。慢性胰腺炎和胰腺癌的临床表现和病理变化相似,容易发生临床误诊。CT是目前认为辅助诊断胰腺疾病的有效方法,使用CT鉴别诊断两种疾病具有较高的应用价值[10]。
在胰腺癌早期诊断过程中发现,胰腺炎与胰腺癌的CT表现相似,但它们也有各自的特征[11-12]。本研究结果显示,胰腺癌患者胰管扩张、血管受累和胰源性门静脉高压比例明显高于肿块型胰腺炎患者,胰管贯穿征比例明显低于肿块型胰腺炎患者,说明以上CT征象可以用于胰腺癌早期诊断中。胰管贯穿征是指主胰管穿过病灶呈光滑的狭窄性改变或无异常,在患有肿块型胰腺炎的患者中,胰管大部分贯通,病灶对胰管呈压迫性改变,肿瘤处的胰腺管在压力下变窄。本研究中,肿块型胰腺炎血管受累少见且程度轻,仅当病变较大时才能移动或包绕血管生长。那些具有血管压迫或炎性浸润的患者伴有管径变窄、管壁粗糙、血管通畅、无肿瘤血栓形成。胰腺癌是嗜血管生长的肿瘤,胰周血管经常参与肿瘤血栓的形成,门静脉系统的分支静脉受累继发胰腺门静脉高压,侧支循环开放。当在胰腺周血管中形成肿瘤血栓时,管腔明显变窄甚至闭塞,可以清楚地诊断为胰腺癌。
本研究胰腺癌患者病灶动脉期CT值明显低于肿块型胰腺炎。胰腺癌的正常胰腺实质完全被肿瘤细胞所取代,基质富含纤维结缔组织,增强扫描显示血液供应不足;基质中的密集纤维化将导致对比剂缓慢进入,并且肿瘤呈渐进性强化。尽管肿块型胰腺炎伴有纤维化,但腺泡细胞仍正常,其增强作用比胰腺癌更为明显。肿块型胰腺炎的间质纤维化较松散,对比剂进入更快。动脉期胰腺癌病变平均增强程度明显低于病变以外正常胰腺组织的平均增强程度,这也表明胰腺癌是血液供应不良的肿瘤。
大多数肿瘤周围都有炎症变化,导致肿瘤边界不清楚;胰腺癌的血液供应不足使肿瘤组织发生坏死、液化,并且密度低于正常的胰腺组织[13-14]。基于上述病理特征,CT检测诊断胰腺癌具有很高的灵敏度,但特异度较低[15]。肿瘤标志物检测在胰腺癌的筛查、诊断后的术后复发转移的监测以及胰腺良恶性肿瘤的鉴别中起着重要的作用[16]。目前,CA19-9和CEA普遍应用于临床。CA19-9在具有较高分子量黏蛋白的碳水化合物部位表达,不具有器官特异性,可以在多种腺癌中升高,但是在胰腺癌的检测中具有很高的灵敏度,是胰腺癌较为可靠的标志物[17-18]。CEA主要存在于胚胎胃肠道黏膜上皮和某些恶性组织的细胞表面,是一种可以在胰腺癌中升高的糖蛋白,但其特异度不高[19-20]。本研究中,胰腺癌患者血清CA19-9和CEA水平均明显高于肿块型胰腺炎患者,说明血清CA19-9和CEA检测对胰腺癌的早期诊断具有一定的临床价值。但是其只能作为辅助方法,只有在影像学方法提示可疑的胰腺癌时,结合血清肿瘤标志物筛选才能提供更好的诊断帮助。因此本研究也显示CT联合CA19-9和CEA对胰腺癌的诊断灵敏度大大提高。
临床诊断中应用影像技术对于病变的发现、位置和形态学的描述尤为重要,但很难对恶性病变进行定性。血清肿瘤标志物具有较高的检测灵敏度,但特异度低,定位性较差。两者结合可以从更微观的角度揭示宏观影像表现的多样性和复杂性,显著提高检测特异度和灵敏度,比单独应用具有更高的诊断价值。综上所述,CT联合CA19-9、CEA诊断胰腺癌有较好的应用价值,值得临床推广。

