miR-34a靶向调控SOX7表达抑制垂体腺瘤细胞增殖
张笑天,张莉莉,孙苏安
(南京医科大学附属淮安第一医院病理科,江苏 淮安 223300)
垂体腺瘤多见于30~60岁女性,约占颅内肿瘤的22.5%,仅次于脑胶质细胞瘤和脑膜瘤。其因为影响内分泌系统,常引起全身代谢紊乱。同时,肿瘤浸润、破坏、压迫颅内腔,可导致严重功能障碍[1]。近年来,越来越多的研究表明,微小RNA(miRNA)靶向调控相关蛋白表达在控制肿瘤细胞增殖中起重要作用[2-4]。研究表明,miR-34a通过靶向调控血小板生长因子-β受体、MET原癌基因、TGF-β2受体,进而抑制肿瘤细胞的增殖、侵袭及转移[5-6]。Y性别决定区基因7(sex determining region Y-box 7,SOX7)在肿瘤的发生及抑制中发挥重要作用[7-8]。本研究主要探讨miR-34a及SOX7在垂体腺瘤细胞增殖方面的作用及上下游关系。
1 材料与方法
1.1 材料
大鼠垂体瘤GH3细胞株(通派生物科技有限公司);马血清、胎牛血清、F12K无血清培养基(Gibco公司);MTT细胞活力检测试剂盒、碘化丙啶(PI)细胞周期检测试剂盒(碧云天生物技术有限公司);LipofectamineTM2000脂质体、Trizol试剂盒、PCR试剂盒(大连宝生物有限公司);miR-34a mimics、NC-miR-34a、NC-SOX7、siRNA-SOX7(上海吉玛制药技术有限公司);兔抗鼠SOX7多克隆抗体(Abcam);兔抗鼠GAPDH单克隆抗体(Abcam);山羊抗兔二抗(Proteintech);引物序列(日本TaKaRa公司);迷你双垂直电泳仪、迷你转印电泳仪(北京六一仪器厂);ChemiDocTM XRS凝胶成像系统(Bio-Rad公司);FACS Calibur流式细胞仪(BD公司);酶标仪(Thermo Scientific MultiSkan Go);TS100倒置荧光显微镜(Nikon公司);PCR仪(苏州东胜兴业科学仪器有限公司)。
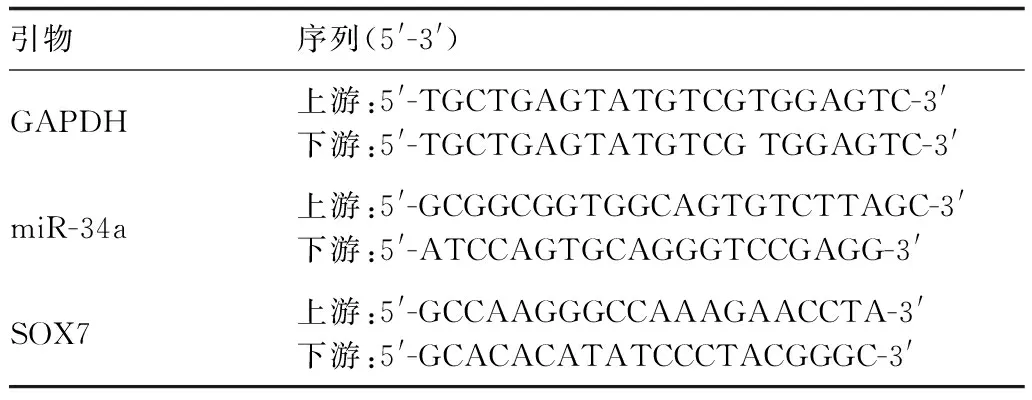
表1 各引物序列
1.2 细胞培养
CH3细胞株在含有15%马血清和2.5%胎牛血清的82.5%F12K培养基中进行培养,培养箱环境控制在37 ℃,5%CO2,100%湿度。每2~3天更换1次培养液,5~6天传代1次。
1.3 细胞转染及分组
按照文献[9]的方法进行细胞转染,当GH3细胞汇合度大约达到50%时,利用LipofectamineTM2000脂质体转染试剂盒分别转染不含miR-34a的空质粒(NC-miR-34a转染组)、含有miR-34a基因片段的质粒(miR-34a mimics转染组)、不含有SOX7的空质粒(NC-SOX7转染组)、SOX7小RNA干扰(siRNA-SOX7组),另取未转染CH3细胞作为未转染组,转染6 h后,将培养液换成含10%血清的F12K培养基,培养48 h后,进行下述实验。
1.4 MTT法检测细胞活力[9]
将GH3细胞接种于96孔板中,按“1.3细胞转染”步骤进行转染,利用LipofectamineTM2000脂质体转染试剂盒将含有基因片段或空载体导入细胞内,然后进行实验,48 h后,舍弃培养液,每孔加入20 μL终浓度为0.5 g/L的MTT,37 ℃继续培养4 h后,舍弃上清液,每孔加入150 μL的DMSO,通过震荡使紫色结晶物充分溶解,使用酶标仪于560 nm波长处测OD值。
1.5 Annexin V-PI染色检测细胞凋亡率[10]
(1)将GH3细胞接种于6孔板中,按“1.3细胞转染”步骤进行转染;(2)48 h后,用无EDTA胰酶消化细胞,将细胞收集到离心管中,1 000 g离心3 min,吸出上清液;(3)再加入1 mL预冷的PBS,重悬细胞,并转移至1.5 mL离心管中,离心,吸出上清;(4)加入195 μL结合液,重悬细胞,再加入5 μL Annexin V-FITC,轻轻混匀后,再加入10 μL PI染液,轻轻混匀,室温避光孵育15 min;(5)用流式细胞仪检测。
1.6 流式细胞术检测细胞周期
(1)将GH3细胞接种于6孔板中,按“1.3细胞转染”步骤进行转染。(2)48 h后,用无EDTA胰酶消化细胞,将细胞收集到离心管中,1 000 g离心3 min,吸出上清液。(3)再加入1 mL预冷的PBS,重悬细胞,并转移至1.5 mL离心管中,离心,吸出上清。(4)加入1 mL预冷的70%乙醇,混匀,4 ℃固定2 h,离心,吸出上清液。(5)再加入1 mL预冷的PBS,混匀,离心,吸出上清。(6)每管细胞样品加入0.5 mL PI染色液,充分重悬混匀细胞沉淀,37 ℃避光孵育30 min。(7)使用流式细胞仪进行细胞周期检测分析。
1.7 荧光定量PCR检测miR-34a mRNA及SOX7 mRNA含量
采用TRIzol试剂法提取各组细胞中的总RNA,随后采用相关试剂盒对样品RNA进行反转录,进一步对cDNA进行扩增。引物序列如表一所示。扩增条件是:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火32 s,72 ℃延伸30 s,共计50个循环反应。采用2-ΔΔCT法计算相对表达量。△△Ct计算公式:△△Ct=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组。
1.8 Western blot检测细胞中SOX7蛋白表达
Western blot主要步骤为:将各组细胞加入细胞裂解液裂解细胞,低温离心,取上清液采用BCA试剂盒进行蛋白定量;配制SDS-PAGE凝胶,上样后,进行电泳、转膜、封闭;在4 ℃条件下兔抗鼠SOX7多克隆抗体(1∶1 000),过夜;在室温条件下孵育山羊抗兔二抗(1∶4 000);使用ChemiDocTM XRS凝胶成像系统成像,并用Image J进行半定量分析。
1.9 统计学方法
2 结 果
2.1 细胞活力测定结果
与未转染组或NC-miR-34a转染组比较,miR-34a mimics转染组细胞OD值显著降低;与NC-SOX7转染组比较,siRNA-SOX7组细胞OD值显著降低,上述结果表明上调miR-34a或下调SOX7表达均可降低垂体腺瘤细胞活力(表2)。
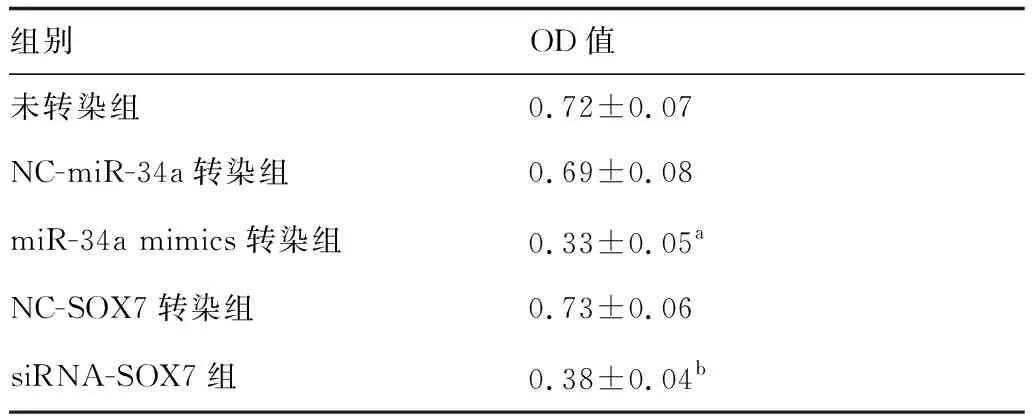
表2 各组细胞活性比较
2.2 细胞凋亡率
采用流式细胞术Annexin V-PI染色检测细胞凋亡率,结果显示,与NC-miR-34a转染组比较,miR-34a mimics转染组细胞凋亡率增加,与NC-SOX7转染组比较,siRNA-SOX7组细胞凋亡率增加。上述结果表明上调miR-34a或下调SOX7表达均可增加垂体腺瘤细胞凋亡率(图1,表3)。
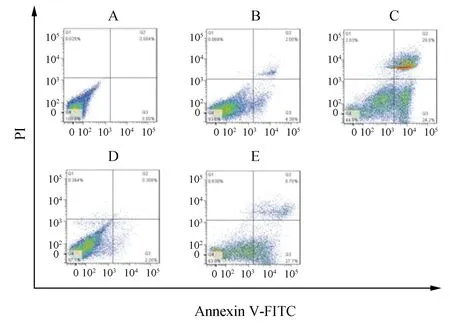
图1 流式细胞术Annexin V-PI染色A:未转染组;B:NC-miR-34a转染组;C:miR-34a mimics转染组;D:NC-SOX7转染组;E:siRNA-SOX7组
2.3 细胞周期分布
采用流式细胞术PI染色检测细胞周期,结果显示,与NC-miR-34a转染组比较,miR-34a mimics转染组细胞G1期延长,S、G2期缩短,差异有统计学意义(P<0.05)。与NC-SOX7转染组比较,siRNA-SOX7组细胞G1期延长,S、G2期缩短,差异有统计学意义(P<0.05)。上述结果表明上调miR-34a或下调SOX7表达均可延长垂体腺瘤细胞G1期,缩短S期和G2期(表4)。
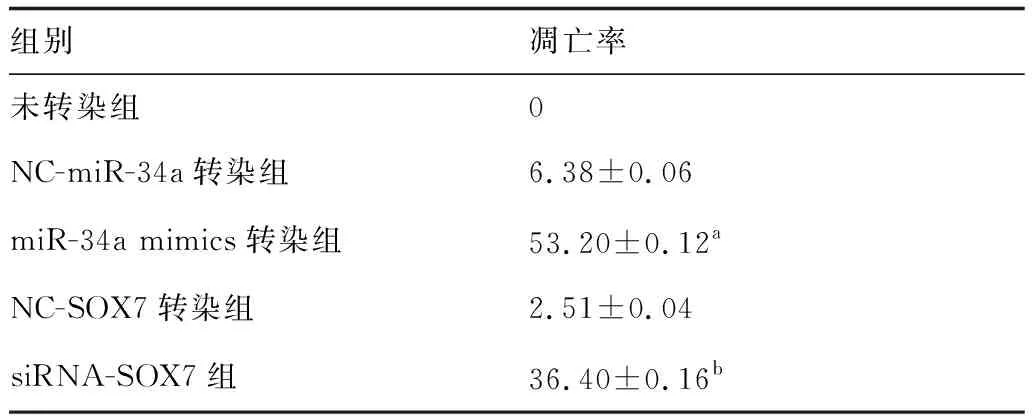
表3 各组细胞凋亡率比较 (%)
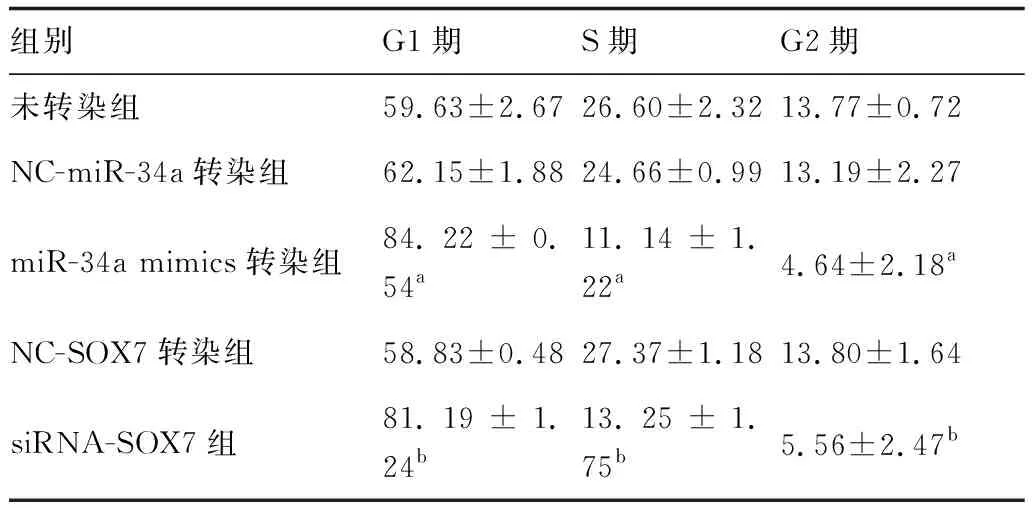
表4 流式细胞术检测各组细胞周期结果 (%)
2.4 miR-34a mRNA及SOX7 mRNA含量
如表5所示,与NC-miR-34a转染组比较,miR-34a mimics转染组细胞中miR-34a mRNA含量增多,SOX7 mRNA含量减少。与NC-SOX7转染组比较,siRNA-SOX7组细胞中SOX7 mRNA含量减少。上述结果表明,上调miR-34a表达可抑制垂体腺瘤细胞SOX7 mRNA表达。
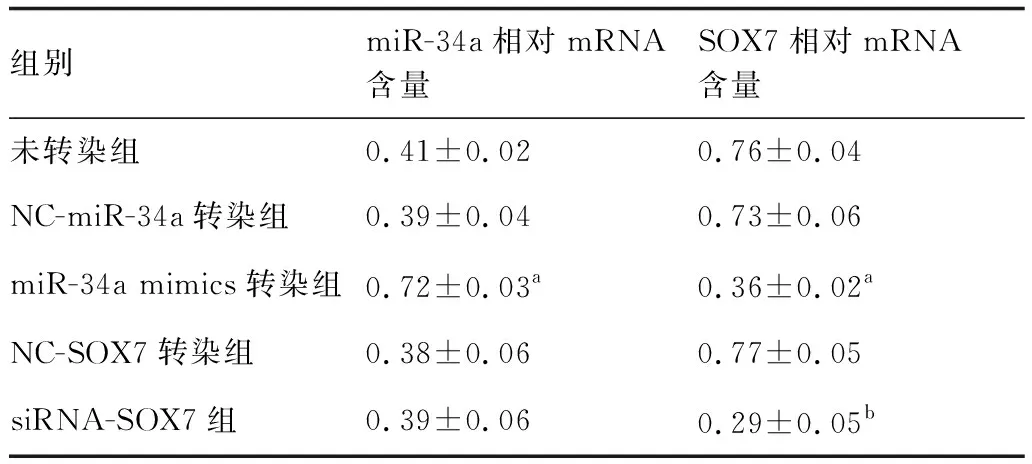
表5 PCR检测miR-34a及SOX7相对mRNA含量
2.5 细胞中SOX7蛋白表达水平
Western blot检测SOX7蛋白表达见图2,其相对表达量见表6,与NC-miR-34a转染组相比,miR-34a mimics转染组细胞中SOX7蛋白的相对表达量降低。与NC-SOX7转染组比较,siRNA-SOX7组细胞中SOX7蛋白的相对表达量降低。上述结果表明上调miR-34a表达可抑制垂体腺瘤细胞SOX7蛋白表达。
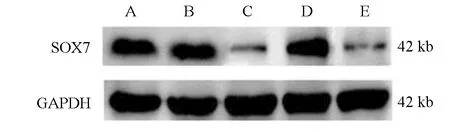
图2 各组细胞SOX7蛋白A:未转染组;B:NC-miR-34a转染组;C:miR-34a mimics转染组;D:NC-SOX7转染组;E:siRNA-SOX7组
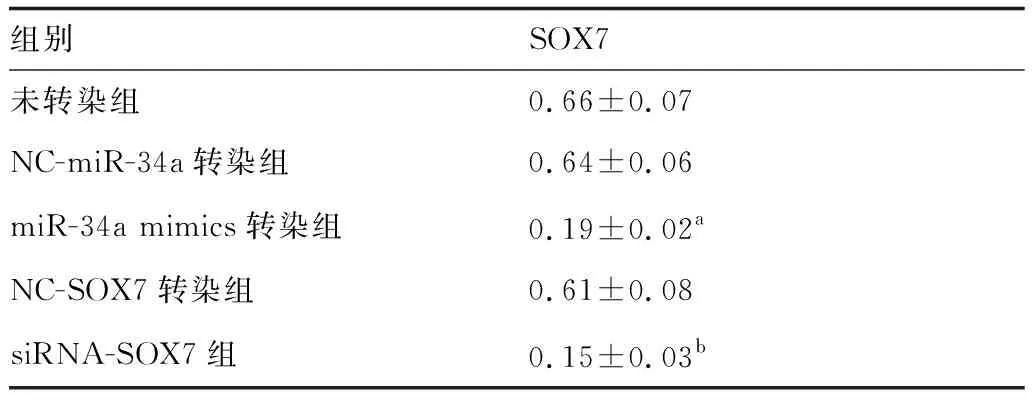
表6 SOX7蛋白的相对表达量
3 讨 论
miRNA参与多种生物学过程,例如,转录调节、细胞分化和肿瘤增殖。相关研究[10]表明,miR-34a可能通过调节PI3K/Akt和MAPK信号通路,从而抑制肿瘤细胞的增殖。研究表明,在乳腺癌和肺癌中已经发现miR-34a表达异常[11-12]。迄今为止,关于miR-34a对于垂体腺瘤细胞的生物学作用及作用机制的研究较少。SOX7的表达与许多肿瘤的发生有关,在前列腺癌及乳腺癌中SOX7mRNA表达水平降低[13-14];但在胰腺癌中SOX7mRNA表达水平升高[15]。上述结果表明:SOX7在不同的肿瘤细胞中的表达具有差异性。因此,本研究主要就miR-34a及SOX7在垂体腺瘤细胞增殖方面的作用及上下游关系进行一系列的研究。
本研究将miR-34a mimics及siRNA-SOX7转染到细胞内时,细胞经MTT染色后,miR-34a mimics转染组和siRNA-SOX7组细胞活力OD值分别低于NC-miR-34a转染组和NC-SOX7转染组,该结果提示上调miR-34a或下调SOX7表达均可降低垂体腺瘤细胞活力。通过Annexin V-PI染色分析上调miR-34a或下调SOX7表达对垂体腺瘤细胞凋亡的影响,结果显示miR-34a mimics转染组和siRNA-SOX7组细胞凋亡率分别高于NC-miR-34a转染组和NC-SOX7转染组,该结果表明上调miR-34a或下调SOX7表达均可增加垂体腺瘤细胞凋亡率。用流式细胞术检测细胞周期,结果显示miR-34a mimics转染组和siRNA-SOX7组S期、G2期分别低于NC-miR-34a转染组和NC-SOX7转染组,G1期分别高于NC-miR-34a转染组和NC-SOX7转染组,上述结果表明上调miR-34a或下调SOX7表达均可延长垂体腺瘤细胞G1期,缩短S期和G2期,进而抑制细胞分裂增殖。
通过实时荧光定量PCR和蛋白质免疫印迹法分别检测上调miR-34a表达或下调SOX7表达对垂体腺瘤细胞SOX7基因及蛋白表达的影响,结果显示miR-34a mimics转染组细胞中SOX7 mRNA相对表达量和SOX7蛋白水平均低于NC-miR-34a转染组,该结果与siRNA-SOX7组结果一致,上述结果提示上调miR-34a表达可抑制SOX7表达,从而发挥其抑制垂体腺瘤细胞增殖的作用。既往研究[6]结果显示miR-34a可靶向TGF-β2受体抑制非小细胞肺癌细胞的增殖,促进细胞凋亡,但在本研究中miR-34a是否通过靶向TGF-β2受体下调SOX7表达,亦或通过下调SOX7表达靶向TGF-β2受体抑制垂体腺瘤细胞增殖仍有待开展试验进一步研究。
综上所述,miR-34a mimics能够通过靶向负调控SOX7表达,诱导垂体腺瘤GH3细胞凋亡,并抑制细胞增殖,使细胞周期阻滞在G1期。其机制还需进一步研究。

