幽门螺杆菌Tipα通过Wnt/β-catenin通路诱导胃癌细胞EMT
曾莎莎,肖玲巧#,唐 瑶,段 洁,张洁雅,李 蕊,郭开云,张 艳*
(南华大学 1.衡阳医学院病原生物学研究所,特殊病原体防控湖南省重点实验室,2.护理学院,湖南 衡阳 421001)
肿瘤坏死因子-α诱导蛋白(tumor necrosis factor-α-inducing protein,Tipα)是幽门螺杆菌(Helicobacter pylori,H.pylori)分泌的一种毒素,因能诱导胃黏膜上皮细胞分泌肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α),故名[1]。胃黏膜上皮细胞表面的核仁素是Tipα的受体,Tipα与核仁素结合后进入细胞,活化核因子κB(Nuclear factor kappa-B,NF-κB)信号通路从而诱导TNF-α和趋化因子的分泌,促进胃癌的发生、发展[2]。研究发现,Tipα能够通过白细胞介素6(interleukin-6,IL-6)/信号转导与转录激活因子3(signal transducers and activators of transcription 3,STAT3)信号通路促进胃癌细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)[3],从而促进肿瘤的侵袭转移,但是否还有其它信号通路参与尚不清楚。Wnt/β联蛋白(β-catenin)信号通路参与了多种肿瘤细胞的增殖、分化、EMT及侵袭转移等过程[4],但该信号通路是否参与调控Tipα诱导的胃癌细胞EMT的形成尚未见报道。本研究旨在探讨Wnt/β-catenin信号通路在Tipα诱导的胃癌细胞EMT形成过程中的作用,以进一步阐明Tipα的致病机制,并为H.pylori相关性疾病的治疗提供实验依据。
1 材料与方法
1.1 材料
SGC7901细胞系(中国科学院上海细胞研究所);Tipα原核表达蛋白系课题组前期制备并纯化[5]。Trizol(Invitrogen);cDNA反转录试剂盒Synthesis Kit(Themoscience);荧光定量试剂盒(天根生化科技有限公司);RIPA Lysis和Extraction Buffer、BCA试剂盒(碧云天生物技术有限公司);超敏ECL化学发光检测试剂盒(优宁维生物科技有限公司);β-catenin、p-β-catenin(Ser675)、p-β-catenin(Ser552)、紧密连接蛋白(Zonula occludens-1,ZO-1)、波形蛋白(Vimentin)、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、β-actin、c-myc和cyclin D1抗体均购自CST;RT-PCR引物由上海生工合成;其它化学试剂购自上海生工生物工程公司。
1.2 方法
1.2.1 细胞培养和Tipα刺激 采用含10%胎牛血清(fetal bovine serum,FBS)的高糖DMEM培养基常规培养(37 ℃、5%CO2培养箱)SGC7901细胞并传代。待细胞处于对数生长期时,胰酶消化,调整细胞密度至108个/L,根据实验要求分别接种于6,24或96孔板中。刺激前更换培养基为无FBS的高糖DMEM,根据课题组前期结果,以Tipα蛋白最佳刺激浓度和时间(100 μg/mL、12 h)刺激SGC7901细胞,设置PBS组为阴性对照,每组设3个复孔。在进行抑制试验时,培养板中的细胞先用抑制剂XAV939(1 μmol/L)预处理1 h,再用Tipα刺激。于不同时间点收集细胞,提取细胞RNA和蛋白用于后续实验。
1.2.2 qRT-PCR检测EMT标志物mRNA表达 Trizol法常规提取各组细胞总RNA,核酸蛋白仪测定总RNA浓度与纯度,鉴定RNA完整性;根据反转录试剂盒说明书进行cDNA合成;取反转录后的cDNA进行实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR),以β-actin为内参;于定量PCR仪上进行循环扩增,PCR反应条件如下:95 ℃预变性300 s,后以95 ℃ 10 s、60 ℃ 20 s、72 ℃ 15 s循环40次。按以下公式计算各基因(E-cadherin、ZO-1、N-cadherin、Vimentin、c-myc和cyclinD1)mRNA表达:目的基因的相对表达量=2-△△CT,其中△△CT=(待测样本目的基因CT-待测样本内参基因CT)-(对照样本目的基因CT-样本内参基因CT)。
1.2.3 Western blot检测EMT标志物及β-catenin磷酸化蛋白 提取各组细胞总蛋白,BCA试剂盒测定蛋白浓度,Western blot检测EMT标志物(E-cadherin、ZO-1、N-cadherin、Vimentin)、β-catenin(Ser675和S552)、c-myc和cyclinD1的蛋白表达。
1.2.4 免疫荧光检测β-catenin的核转位 将细胞爬片放入24孔板,接种SGC7901细胞1×105个/孔,37 ℃、5%CO2孵箱中培养过夜;用Tipα刺激SGC7901细胞12 h,经过4%多聚甲醛固定、0.04% Triton X-100透膜、10%FBS DMEM封闭、PBS洗涤等步骤,加入10% BSA稀释的β-catenin一抗,4 ℃孵育过夜;PBS清洗细胞爬片5 min×3次;加入10% BSA稀释的二抗(Cy3标记)和DAPI,37 ℃孵育1 h;PBS洗涤,在暗室中用荧光显微镜观察、拍照。
1.2.5 划痕实验 调整细胞浓度为1×105/mL,吸取1 mL细胞悬液接种于6孔板,每组3个平行样本。37 ℃、5% CO2温箱培养,直至形成细胞单层。用10 μL Eppendorf Tip在细胞板上划痕,无血清培养液洗3次,加新鲜无血清培养基,用100 μg/mL Tipα处理细胞,常规培养48 h。观察细胞的迁移情况,于倒置显微镜下拍照;计算出Tipα诱导之后与之前划痕区间的面积比。
1.2.6 Transwell实验 取对数生长期细胞,胰酶消化,终止消化后吹打混匀,1 000 rpm离心5 min;重悬细胞,使细胞浓度为5×107/mL。在Transwell小室上室加入200 μL不含FBS的高糖DMEM培养基,并在其中接种1×105个SGC7901细胞,以100 μg/mL Tipα刺激;在Transwell小室下室中加入600 μL含10% FBS的培养基;常规培养24 h后,用镊子将小室取出,弃去溶液,PBS清洗3次;加入90%的甲醛固定10 min;用棉球轻轻擦去上室中的残存细胞,注意不要破坏聚碳酸酯膜;用1%结晶紫染色20 min后,PBS洗涤3次;于倒置显微镜下观察,100倍视野下取5个视野计数、拍照。
1.3 统计学方法
实验均独立重复3次,结果以均数±标准差表示。采用SPSS20.0统计分析软件,配对组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 Tipα对SGC7901细胞β-catenin磷酸化的影响
以Tipα处理SGC7901细胞1、2、4、6 h,提取细胞总蛋白,Western blot检测细胞β-catenin Ser675和Ser552磷酸化情况,一抗为抗-p-β-catenin(Ser675)和抗-p-β-catenin(Ser552)兔单抗,以β-actin为内参。结果显示:Tipα可以促进β-catenin C-端Ser675和Ser552的磷酸化,且磷酸化作用具有时间依赖性(6 h最明显)(图1A)。用Wnt/β-catenin通路抑制剂XAV939预处理细胞,再用Tipα刺激,结果显示XAV939可以抑制Tipα诱导的β-catenin Ser675和Ser552的磷酸化(图1B)。
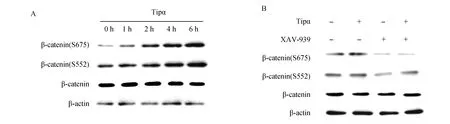
图1 Tipα对β-catenin Ser675和Ser552磷酸化的影响A:β-catenin在不同时间点的磷酸化(Ser675 and Ser552)水平;B:抑制剂XAV939对β-catenin磷酸化(Ser675 and Ser552)水平的影响
2.2 Tipα对SGC7901细胞β-catenin核转位的影响
免疫荧光结果显示,未用Tipα刺激时,β-catenin主要定位于SGC7901细胞质,细胞为椭圆或圆形,而用Tipα刺激细胞12 h后,β-catenin发生核转位,且细胞变为长梭形;当加入Wnt/β-catenin通路抑制剂XAV939后,核转位现象受到抑制(图2)。
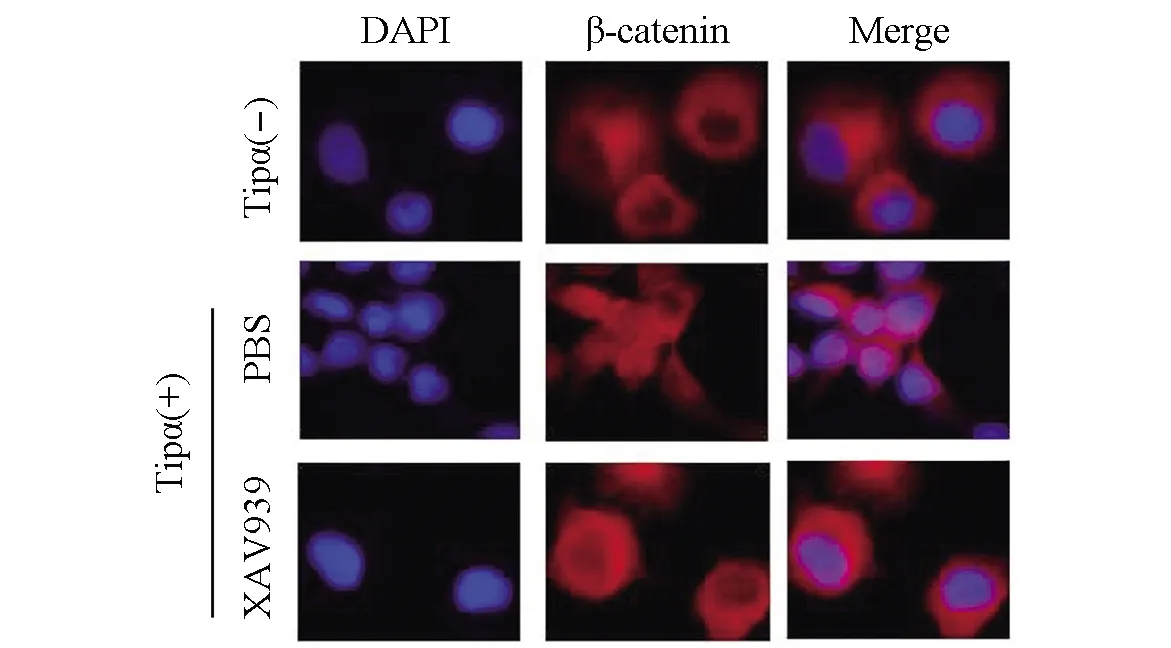
图2 Tipα对SGC7901细胞β-catenin核转位的影响
2.3 Tipα对SGC7901细胞EMT标志物表达的影响
用Tipα刺激SGC7901细胞12 h,qRT-PCR和Western blot分别检测EMT标志物的mRNA和蛋白表达。结果显示:上皮标志物(E-cadherin、ZO-1)的mRNA和蛋白表达均降低(P<0.01),而间质标志物(N-cadherin、Vimentin)的mRNA和蛋白表达均升高(P<0.01),XAV939预处理能够逆转Tipα诱导的这种表达变化(图3)。

图3 Tipα对SGC7901细胞EMT标志物表达的影响A:Tipα对EMT标志物mRNA表达的影响,与PBS组比较,*P<0.01;B:Tipα对EMT标志物蛋白表达的影响
2.4 Tipα对SGC7901细胞c-myc和cyclinD1表达的影响
用Tipα刺激SGC7901细胞12 h,qRT-PCR和Western blot分别检测Wnt/β-catenin通路下游靶基因c-myc和cyclinD1的mRNA和蛋白表达情况。结果显示:Tipα可以促进c-myc和cyclinD1的mRNA和蛋白表达(P<0.05),而用抑制剂XAV939预处理之后,c-myc和cyclinD1的表达受到抑制(图4)。
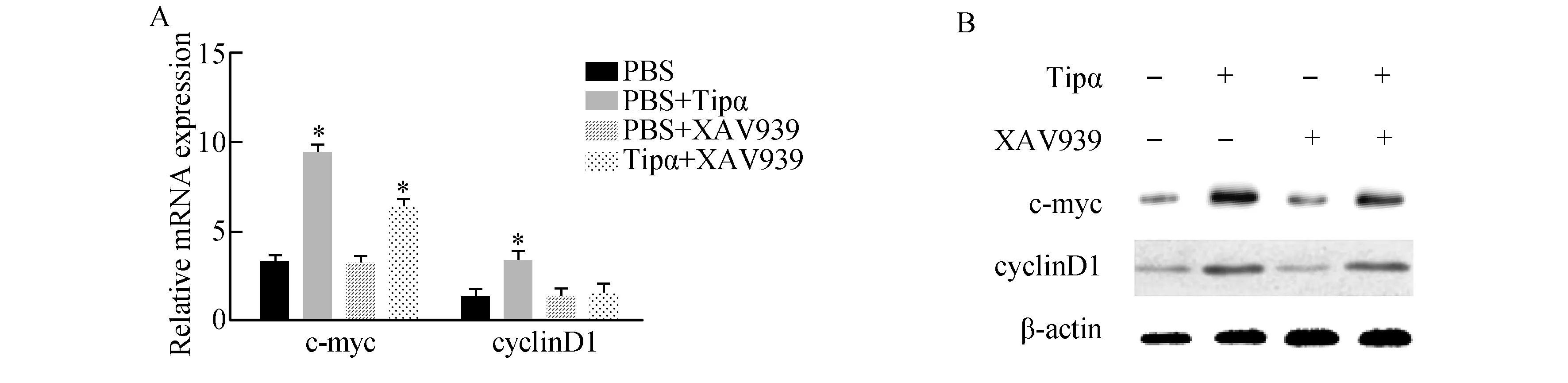
图4 Tipα对SGC7901细胞c-myc和cyclinD1表达的影响A:Tipα对c-myc和cyclinD1 mRNA表达的影响,与PBS组相比,*P<0.05;B:Tipα对c-myc和cyclinD1蛋白表达的影响
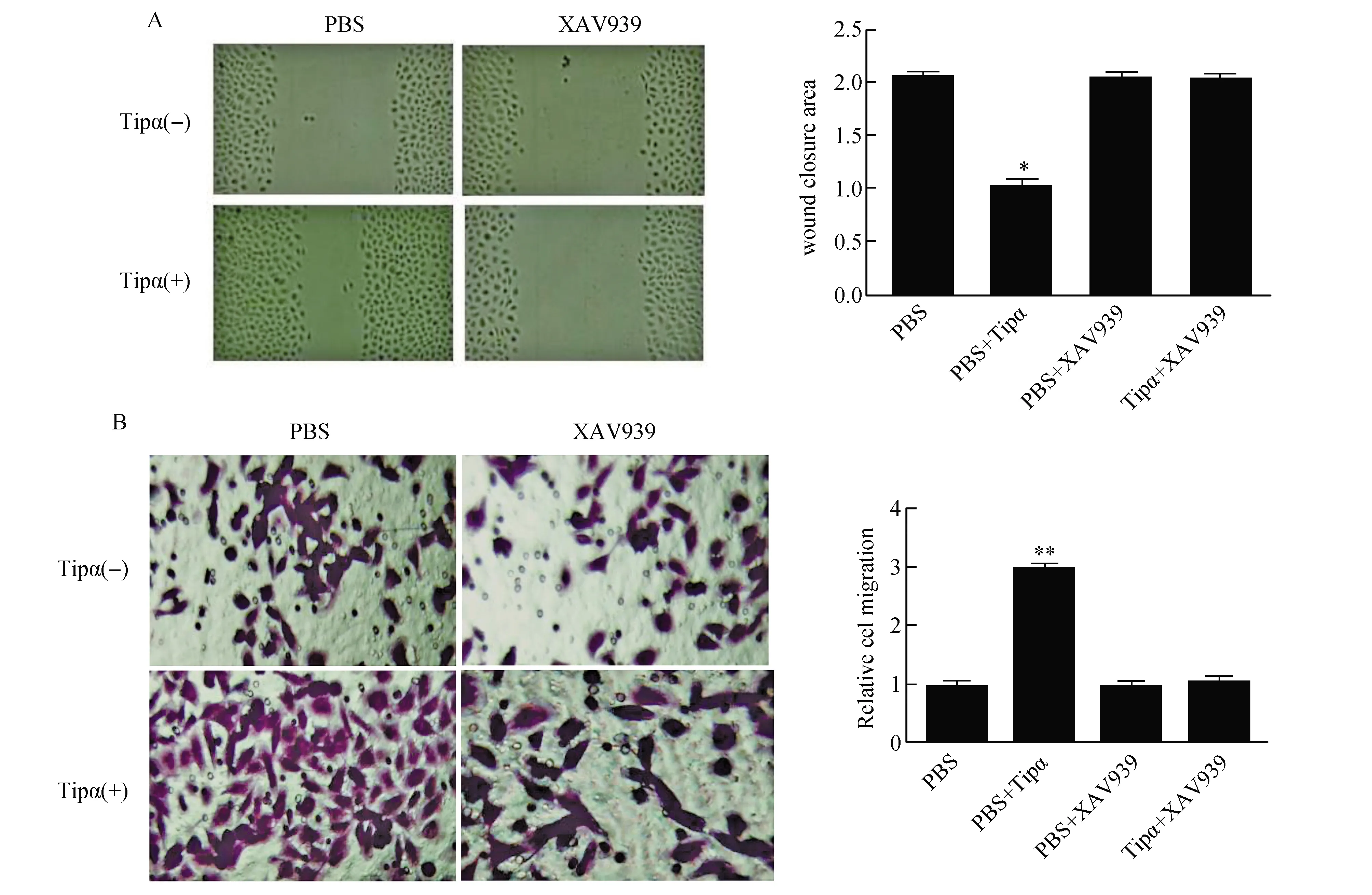
图5 Tipα对SGC7901细胞迁移能力的影响A:划痕实验检测SGC7901细胞的迁移能力;B:Transwell实验检测SGC7901细胞的迁移能力与PBS组比较,*P<0.05,**P<0.01
2.5 Tipα对SGC7901细胞迁移能力的影响
使用Tipα处理细胞,于划痕实验48 h后进行拍照,比较细胞迁移能力的变化。结果表明:与对照组相比,Tipα可使SGC7901迁移能力提高(P<0.05),而用XAV939预处理后Tipα诱导的细胞迁移能力受到抑制(图5)。Transwell实验结果与划痕试验结果一致(P<0.01)。
3 讨 论
H.pylori被国际癌症研究机构于1994年列为Ⅰ类致癌原,其可充当胃癌发生的“启动子”的作用[6]。Tipα是H.pylori分泌的新型致癌因子[1],其可通过激活NF-κB来诱导TNF-α表达,而TNF-α是“炎-癌”转变过程中的重要调节因子[7]。此外,Tipα能够诱导胃上皮细胞发生EMT从而促进肿瘤进展[3]。在本研究摸索出的最佳浓度和时间(100 μg/mL、12 h)基础上,用Tipα处理SGC7901细胞,发现Tipα能够诱导SGC7901细胞上皮表型分子E-cadherin和ZO-1表达水平降低,而间质表型分子N-cadherin和Vimentin表达水平升高,证实了Tipα能够诱导胃癌细胞发生EMT。
研究发现,Wnt信号通路与肿瘤转移早期的EMT现象密切相关[8]。经典Wnt/β-catenin信号通路由胞外的Wnt蛋白、膜受体Frizzled、胞质内的β-catenin以及下游的靶基因组成[9-10]。当缺乏Wnt信号时,胞质中的β-catenin主要是与E-cadherin、α-catenin等结合形成E-cadherin/catenin复合体并锚定在细胞骨架上,调控细胞的黏附与稳定,少部分游离的β-catenin则被磷酸化,进而降解;当信号被激活时,β-catenin转位到细胞核,与转录调控因子T细胞因子/淋巴增强因子(T cell factor/lymphocyte enhancer factor,TCF/LEF)相结合,启动下游靶基因c-myc、cyclinD1和Snail等的转录。c-myc和cyclinD1等原癌基因被激活后可转化为癌基因,刺激细胞增殖,引起肿瘤发生;Snail等转录因子可以通过转录抑制E-cadherin的表达,上调间质标志分子表达,启动EMT过程[10]。此外,c-myc基因过表达可以下调E-cadherin的表达,上调N-cadherin的表达[11]。
本文研究结果显示Tipα可以使β-catenin Ser675和Ser552发生磷酸化,且呈时间依赖性。β-catenin C-端Ser675和Ser552磷酸化能够促进其核内的聚集和转录活性。同时,Tipα刺激SGC7901之后β-catenin发生了核转位,Wnt/β-catenin信号通路下游靶基因c-myc和cyclinD1表达上调;而用该信号通路抑制剂XAV939预处理细胞后,上述磷酸化、核转位现象及靶基因的表达均受到抑制,表明Tipα可以激活Wnt/β-catenin信号通路。XAV939预处理可以逆转Tipα诱导的上皮标志物(E-cadherin、ZO-1)和间质标志物(N-cadherin、Vimentin)表达变化,并抑制Tipα的促细胞迁移能力。本文研究结果证实了Wnt/β-catenin信号通路参与了Tipα诱导的胃癌细胞EMT形成。
Tipα能够诱导TNF-α的产生,而TNF-α能够上调人胃癌细胞Wnt/β-catenin通路中促癌基因WNT10B的表达,从而促进胃癌的发生[12]。此外,巨噬细胞源性的TNF-α能够激活Wnt/β-catenin信号通路从而促进小鼠胃黏膜肿瘤的发生[13]。最新研究也表明,Wnt/β-catenin通路是TNF-α的下游靶点,TNF-α可通过该信号通路促进肝癌细胞的EMT[14]。Tipα是通过直接或间接机制激活Wnt/β-catenin信号通路尚待进一步研究。
H.pylori及其毒力蛋白体外细胞共培养模型研究中,常用人AGS、MKN-45、SGC7901、KATO III等胃癌细胞系[15-16]。SGC7901来源于胃腺癌淋巴结转移灶,属于低分化细胞系,为了让实验结果更具有代表性和科学性,本课题组成员拟进一步使用H.pylori Tipα刺激其它胃癌细胞系,观察Wnt/β-catenin通路激活情况。
综上,Wnt/β-catenin信号通路参与了Tipα诱导的胃癌细胞EMT的形成,阻断该信号通路有可能成为胃癌治疗的策略之一。本研究为进一步阐明Tipα的致癌机制提供了实验依据,同时也为H.pylori相关性疾病的防治提供了新的方向。

