PCDH8基因甲基化在诊断甲状腺乳头状癌的价值
谢小红,蔡伟奕,聂芙蓉,魏洪发,刘 丹,宁 洁
(深圳市龙华区中心医院内分泌科,广东 深圳 518110)
自从食盐加碘政策实行以来,缺碘性甲状腺肿发生率已经显著下降,但整体的甲状腺疾病患病率仍高达30%以上,目前甲状腺癌已成为代谢内分泌科中最常见的恶性肿瘤,约占全身恶性肿瘤的1%,其全球发病率均呈上升趋势[1-2]。这其中又以甲状腺乳头状癌(papillary thyroid carcinomas,PTC)发病率增长为主,约占成人的70%及几乎儿童的全部,PTC生长缓慢,预后最好,但易发生早期淋巴结转移及术后复发。目前国内外对PTC相关基因的研究常见的有:CK19、34BE12、HBME-1、VEGF、PTEN、Survivin、COX-2、Galectin-3、TPO、RET等[3-6]。众多研究结果显示这些肿瘤相关基因在PTC的诊断与鉴别诊断方面具有一定的价值。探讨PTC的发生机制,寻找特异性肿瘤标志物,对于PTC的早期诊断、治疗和预后具有非常重要的现实意义[7]。
原钙粘蛋白8(protocadherin8,PCDH8)是黏附素蛋白家族中最大的亚家族—原钙黏附素的家族成员[8]。近年研究发现,DNA的甲基化引起的表观遗传沉默与肿瘤的发生发展有密切的关系,而甲状腺乳头状癌在基因DNA甲基化相关研究仍不多,本研究探讨PCDH8基因的DNA甲基化及其对PTC诊断价值及应用前景。
1 材料与方法
1.1 数据库分析
本研究采用从癌症基因组图谱(the cancer genome atlas,TCGA)网站(https://www.cancer.gov/)下载得到的相关数据集,入选样本采用统一的标准:(1)甲状腺癌患者经病理确诊;(2)预后随访资料及临床资料完整。最终确定了565名甲状腺癌患者。下载数据集包括:(1)甲状腺癌的临床预后数据;(2)基于TCGA网站获得PCDH8基因上20个不同cg位点的甲基化数据,PCDH8基因上每个cg位点的坐标基于UCSC Genome Brower GRCh37(图1)。考虑到单个cg位点的甲基化水平难以代表基因的甲基化水平,我们用PCDH8基因20个cg位点的甲基化的β平均值代表PCDH8基因甲基化水平。β值通过公式β=U/(M+U+1)计算得到,其中U值为未甲基化探针的信号值,而M值为信号强度。
1.2 PCDH8基因甲基化位点选择
从NCBI数据库中检索人源性PCDH8序列,设计引物时需将模板中的非CG位点的C转换成T,且引物不能包含CG,后续采用巢式PCR扩增。外引物:PCDH8-mF 58.5:5′-GTTAAGGAAGTTTTTTTTGGTTTTTAG-3′,PCDH8-mR 57.3:5′-CCAACTCCTCTACATACAAAATACTAAC-3′;内引物PCDH8-F:5′-GG AAGTTTTTTTTGGTTTTTAGG-3′,PCDH8-R:5′-CCCC TCTAAACCTTTCCACTTA-3′
原始序列:GCTAAGGAAGTCTTCTCTGGTTTCCAGGTCGGGCGTCAGTCTCAGGCTCTCGGAATCACGCTCTTTGCGAGCCCTGTGCGGGAGAAGTCTGCGGGTAGCAGCTCCGAGCCTCCAGCGGGCTCTGAGGACGCGCGGACCCGCCCTCACTCTGCGCCTCTCCGTCTCTTACAGAAGCTGCGCCGCCTCGCGCCGCCTTTGCCTTTATAGCCGCCGATATGCTAATCACCCGAGCCGGGTAGCCAATGGCCGCCTCCCCCTCGCGTCGCCCCTCCGCCTGCCTCTGACAA;转化后序列:GTTAAGGAAGTTTTTTTTGGTTTTTAGGTCGGGCGTTAGTTTTAGGTTTTCGGAATTACGTTTTTTGCGAGTTTTGTGCGGGAGAAGTTTGCGGGTAGTAGTTTCGAGTTTTTAGCGGGTTTTGAGGACGCGCGGATTCGTTTTTATTTTGCGTTTTTTCGTTTTTTATAGAAGTTGCGTCGTTTCGCGTCGTTTTTGTTTTTATAGTCGTCGATATGTTAATTATTCGAGTCGGGTAGTTAATGGTCGTTTTTTTTTCGCGTCGTTTTTTCGTTTGTTTTTGATAA
1.3 DNA提取步骤
通过Sanger技术分别检测临床病理标本甲状腺乳头状癌组织33例、结节性甲状腺肿组织30例、甲状腺腺瘤组织42例及其癌旁正常样本20例的PCDH8基因表达情况。DNA提取试剂盒:QIAgen FFPE DNA kit(50)石蜡包埋组织DNA纯化试剂盒(50)货号:No.56404。
将石蜡切片放于2 mL离心管中,向样品中加入1 mL二甲苯进行石蜡溶解。向沉淀中加入1 mL无水乙醇,并通过震荡混匀10 s,然后15 000×g离心2 min。将沉淀重悬于180 μL Buffer ATL和20 μL蛋白酶K,混匀涡旋震荡。将离心盖盖紧,放于恒温箱或水浴锅中56 ℃孵育1 h,56 ℃孵育结束后进行90 ℃孵育1 h。90 ℃孵育结束后立即取出离心管,短暂离心,使液体聚集,置于室温使其恢复到室温。向样品中加入200 μL Buffer AL,并通过涡旋充分混合。然后加200 μL无水乙醇,通过涡旋再次彻底混合。短暂离心,使液体聚集,将所有液体转移至QIAamp MinElute柱。6 000 g离心1 min。将QIAamp MinElute柱置于新的收集管中,去除收集管,将吸附柱转移到一个新的灭菌1.5 mL离心管中,向吸附柱加入20~100 μL Buffer ATE在膜的中央,同时覆盖膜。盖上盖子室温静置1 min,然后20 000 g离心1 min,获得DNA溶液。
1.4 重亚硫酸盐转化
1.4.1 重亚硫酸盐缓冲液的配制 (1)使用微量称量仪称取0.033 g的C6H6O2(对苯二酚,生工,lot:RS0301B1013J),移入2 mL的EP管中,加入双蒸水使其定容到1.5 mL。上下颠倒溶解混匀,室温放置;(2)使用微量称量仪称取2.375 g Na2S2O5(生工,lot:YK1204B2012J),移入15 mL离心管中,加入双蒸水使其定容到2 mL;(3)然后将步骤①和步骤②的溶液轻轻混匀,避免气泡至完全溶解。加入双蒸水定容至5 mL,混匀。
1.4.2 PCR扩增和测序 (1)取重亚硫酸盐缓冲液处理基因组样本DNA 1 μg至200 μL PCR管中,加入双蒸水补齐10 μL。(2)加1.11 μL 3 mol/L的NaOH,程序设置为42 ℃ 20 min,95 ℃ 3 min,结束后立即放置冰上。(3)加89 μL上面配制的重亚硫酸盐缓冲液,混匀,加两滴石蜡油至液面。程序设置为55 ℃ 3 h;95 ℃ 3 min,55 ℃ 3 h,4个循环;4 ℃维持,后续将采用巢式PCR扩增、Sanger测序,特异位点甲基化率=(C/C+T)×100%。
1.5 统计学分析
对所有数据进行正态性检验,若服从正态分布数据以均数±标准差表示,若不服从正态分布,数据以中位数表示。服从正态分布的数据两组间比较采用两独立样本t检验,否则采用Mann-WhitneyU非参数检验。用Kaplan-Meier法绘制生存曲线,用Log-rank检验进行两组或多组生存曲线的比较。统计检验均为双侧检验,P<0.05时差异有统计学意义。
2 结 果
2.1 纳入分析的人群基本特征及与PCDH8相关性分析
本研究从TCGA中共计纳入615例样本。其中515例为甲状腺癌组织(病例组),100例为癌旁组织(对照组)。男性患者116例,女性患者449例,297例患者确诊时平均年龄为(47.19±15.81)岁,对PCDH8甲基化位点进行检测发现cg07202976在甲状腺癌患者中高表达。随访队列中最长随访时间为5423天,有22例死亡,593例存活,11例失访,中位生存期为957天。PCDH8甲基化水平高的患者其存活时间较甲基化水平低的患者短(图1)。
2.2 与甲状腺癌相关的cg位点
本研究用位于PCDH8基因的20个cg位点的β值的均值代表PCDH8甲基化水平,结果发现癌组织PCDH8基因甲基化水平高于癌旁组织(0.222±0.242 vs 0.202±0.210,P<0.01)。对PCDH8基因甲基化位点进行差异性检验,发现cg22763718、cg20366906、cg14950829、cg18002116的甲基化水平在甲状腺癌组织与癌旁组织之间的差异具有统计学意义(表1)。
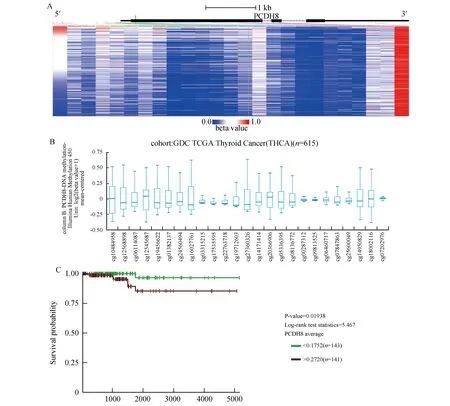
图1 PCDH8各甲基化位点在甲状腺癌患者中分析A:PCDH8各甲基化位点在甲状腺癌患者中表达量;B:CDH8各甲基化位点在甲状腺癌患者中差异性分析;C:生存曲线分析

表1 PCDH8基因的20个cg位点的β值的比较
2.3 临床样本PCDH8基因甲基化Sanger测序
本研究收集临床样本125例,病例80例,其中男性20例,女性60例,平均年龄(40.51+12.87)岁。甲状腺乳头状癌样本33例、结节性甲状腺肿样本30例、甲状腺腺瘤样本42例及其癌旁正常组织样本20例。经Sanger测序发现,甲状腺乳头状癌、结节性甲状腺肿、甲状腺腺瘤患者PCDH8基因甲基化水平高于癌旁正常组织,差异具有统计学意义(t=2.325,P=0.034)(表2)。
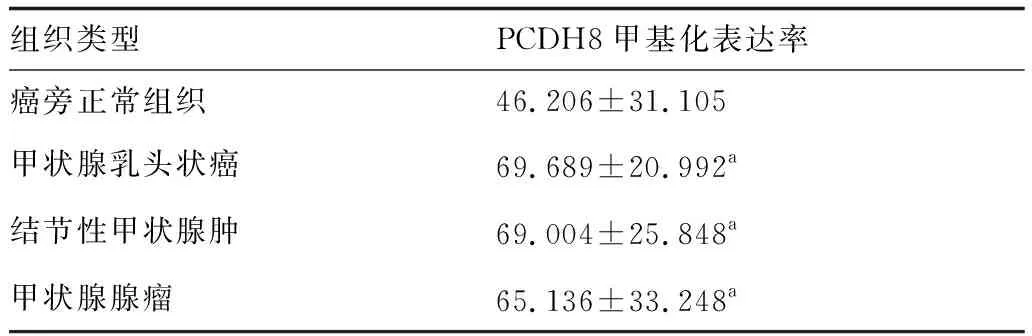
表2 PCDH8基因在不同组织中的甲基化表达率 (%)
3 讨 论
DNA甲基化是表观遗传学的主要修饰方式之一,与基因表达调控、胚胎发育调节、基因组印记、女性X染色体失活和细胞分化及增生等方面有密切关系。现有研究已证实,DNA的甲基化引起的表观遗传沉默在肿瘤的发生发展起重要的作用[9]。肿瘤细胞的甲基化特点表现为基因组DNA总体甲基化水平通常低于正常细胞,针对DNA甲基化对PTC相关基因进行检测具有潜在的研究意义。
本研究对TCGA数据库进行挖掘,初步发现PCDH8基因20个cg位点里面有4个位点甲基化水平在病例对照组之间存在差异。选择位于PCDH8基因的20个cg位点的均值来代表其总体甲基化水平,发现癌组织PCDH8基因甲基化水平高于癌旁组织。我们对甲状腺癌患者PCDH8基因甲基化水平与生存相关性分析,发现PCDH8基因甲基化水平越高的患者生存时间越短。我们同时对正常组织和癌组织的20个位点甲基化水平进行分析,发现PCDH8基因的cg22763718、cg20366906、cg14950829、cg18002116位点的甲基化水平与甲状腺癌预后存在显著关联。
基于上述分析,我们于2017年8月至2019年3月收集甲状腺乳头状癌样本33例、结节性甲状腺肿样本30例、甲状腺腺瘤样本42例及其癌旁正常组织样本20例。选择上述差异性位点基因对样本进行Sanger测序,结果显示,甲状腺乳头状癌、结节性甲状腺肿、甲状腺腺瘤患者PCDH8基因甲基化水平显著高于癌旁正常组织。
近几年已经有研究发现PCDH8在某些肿瘤中基因组发生异常甲基化,导致PCDH8基因发生突变或表观遗传性沉默,而外源性表达PCDH8基因可抑制肿瘤细胞增殖和转移,这些肿瘤包括结直肠癌、乳腺癌、袖套淋巴细胞瘤、肾细胞癌等[10]。PCDH8基因在某些胰腺癌细胞株上发生甲基化,而基因mRNA水平下降或消失也有被证实[11]。最近,研究已经证实PCDH8基因在胰腺癌细胞发生异常甲基化,并导致基因表达缺失,参与胰腺癌的发生发展过程,通过基因功能恢复,可能具有抑制肿瘤生长的作用,与国外研究结果类似[12]。
综上所述,PCDH8作为新型抑癌基因参与了甲状腺乳头状癌的发生发展过程,PCDH8基因甲基化水平对诊断甲状腺乳头状癌具有重要意义。