脓毒症患者高密度脂蛋白胆固醇水平的变化及其对患者预后的影响
于凡,韩双剑,张宁,刘超,赵文静
(徐州医科大学附属医院重症医学科,江苏 徐州221000)
脓毒症是宿主对感染反应失衡引发的危及生命的器官功能障碍[1],是危重症患者的主要死因。目前,世界范围大约有3000万的脓毒症患者,其中死于脓毒症的约600万人,这些数字每年继续增加1.5%~8.0%[2]。早期评估患者预后,积极调整治疗措施,才能提高治疗效果,降低死亡率,节省医疗资源。许多生物标志物,如CRP、PCT、IL-6、可溶性髓系细胞表达触发受体-1等有助于评估病情及预后,但准确性或特异性不高[3-4],识别高死亡风险患者仍面临挑战。高密度脂蛋白胆固醇(high-density liptein cholesterol,HDL-C)是血清蛋白的一种,有研究表明患者发生脓毒症后脂蛋白水平将迅速下降到正常浓度的50%,主要是HDL-C[5]。而且脓毒症患者HDL-C较正常人显著下降。此外,体外实验证实炎症反应时细胞因子也能够减低肝细胞合成或分泌载脂蛋白[6]。一项前瞻性队列研究和病例对照分析血HDL-C有保护作用,每增加0.026 mmol/L,可使住院期间严重脓毒症的发生率降低3%[7]。目前HDL-C在成人脓毒症危重患者的早期变化特点以及对脓毒症患者预后影响研究的文献较少,并局限于单一时间点,未能动态检测HDL-C。本研究旨在比较脓毒症组与对照组,死亡组与存活组HDL-C水平以及其他生化指标,探讨脓毒症HDL-C的变化和其死亡危险因素,为临床治疗提供指导。
1 对象与方法
1.1 研究对象
采用前瞻性研究方法,选择2018年12月至2019年5月期间徐州医科大学附属医院重症监护病房收治的脓毒症患者。
1.1.1 入选标准 (1)年龄≥18岁,性别不限;(2)符合2016年发表的《脓毒症和脓毒性休克定义的第三次国际共识(sepsis-3.0)》为诊断标准,由2个及2个以上临床医师(主治以上)共同诊断为脓毒症患者。
1.1.2 排除标准 (1)肝硬化、终末期肾病、晚期癌症、高脂血症史或采血时接受全肠外营养;(2)使用影响脂质代谢的药物(降脂剂、皮质类固醇、非甾体类抗炎药);(3)甲状腺代谢紊乱患者;(4)免疫抑制情况(即艾滋病、中性粒细胞减少症、化疗。ICU入院前进行血液透析,营养不良);(5)未签署知情同意书。
1.1.3 剔除标准 (1)入院24 h死亡或者放弃治疗者;(2)研究期间失访。
1.1.4 伦理学 本研究符合医学伦理学要求,通过医院伦理委员会批准(审批号:XYFY2019-KL067)并于中国临床实验中心进行了临床实验注册(注册号:ChiCTR1800019793),病例入选前经家属或患者同意,并签署知情同意书。
1.2 分组
按照脓毒症及脓毒性休克第3次国际共识定义(Sepsis-3)标准将研究对象分为脓毒症组和对照组;随访脓毒症患者28 d,根据脓毒症患者存活情况将患者分为存活组和死亡组。
脓毒症患者65例,其中男性34例,女性31例;年龄28~90岁,平均(54.46±12.27)岁,感染部位:肺部感染36例、腹腔感染13例、泌尿系感染8例、其他感染8例。
同期对照组65人,男性26人,女性39人,年龄28~88岁,平均年龄(48.0±14.6)岁,均身体健康。
1.3 观察指标
收集对照组基本资料、HDL-C、低密度脂蛋白(low density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterol,TC)、甘油三酯(Triglyceride,TG)。收集脓毒症组基本资料、入ICU 24 h内HDL-C、LDL-C、TC、TG、急性生理学与慢性健康状况评分(acute physiology and chronic health evaluation,APACHE Ⅱ)和序贯器官衰竭评分(sequential organ failure assessment,SOFA)、降钙素原(procalcitonin,PCT)、C反应蛋白(C-reactive protein,CRP)、血乳酸、胆红素,第3天、第5天血HDL-C水平以及28 d预后。
1.4 仪器与试剂
TG、TC、HDL-C、LDL-C、PCT及IL-6指标采用罗氏分析仪cobas c 701,配套试剂均由罗氏诊断产品(上海)有限公司提供。CRP由全自动血液细胞分析仪BC-5390(深圳迈瑞)及配套试剂检测。
1.5 统计学处理
2 结 果
2.1 对照组与脓毒症组临床资料比较
2组患者性别、年龄比较差异无统计学意义(P>0.05),说明2组资料均衡,具有可比性。脓毒症组HDL-C、LDL、TC水平明显低于对照组(均P<0.05),而2组间TG差异无统计学意义(P>0.05;表1)。

表1 对照组与脓毒症组临床资料比较
2.2 不同预后脓毒症患者资料比较
脓毒症患者死亡19例(29.2%),存活46例(70.8%)。2组患者年龄、性别、BMI比较差异无统计学意义(P>0.05)。死亡组与存活组TC水平比较差异无统计学意义(P>0.05);但死亡组患者APACHE-Ⅱ评分、IL-6、血乳酸、CRP、PCT水平高于存活组,且第1 d HDL-C,第3天HDL-C,第5天HDL-C、TG、LDL-C水平均低于存活组(均P<0.05;表2)。
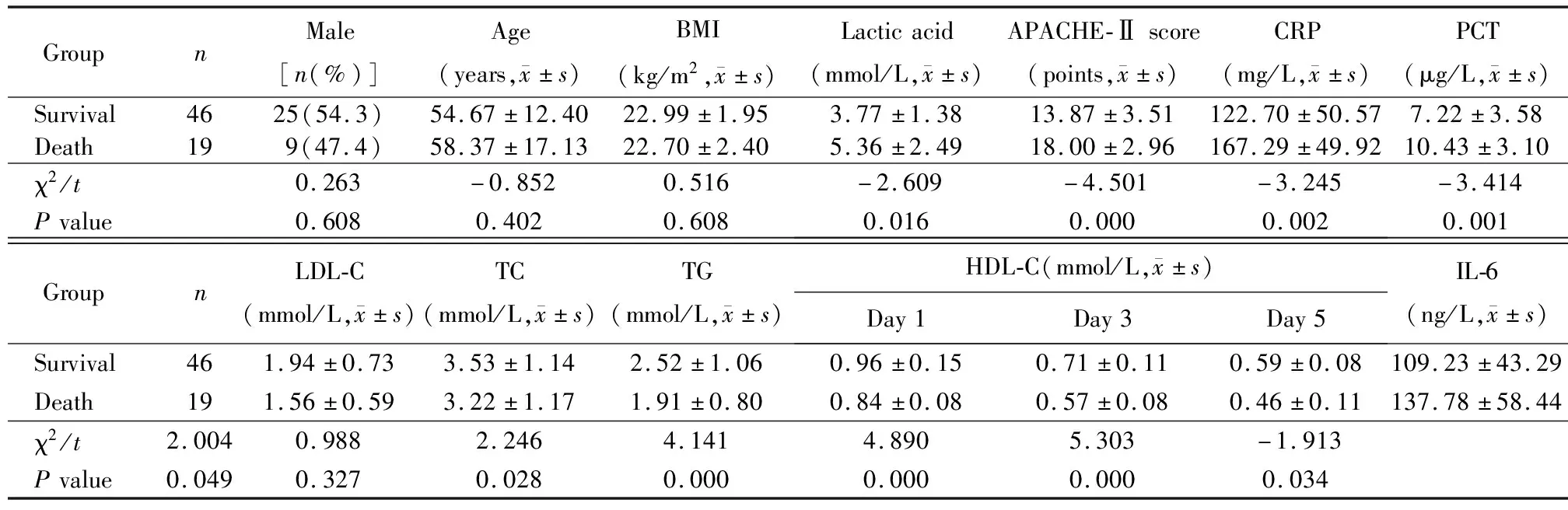
表2 死亡组与存活组临床资料比较
2.3 2组患者血HDL-C动态变化比较
不同预后2组入ICU 1 d时血HDL-C水平均较低,存活组和死亡组分别为0.96 mmol/L和0.84 mmol/L。随时间延长,存活组和死亡组血HDL-C水平均呈下降趋势。死亡组1、3、5 d时血HDL-C水平均低于存活组(均P<0.01)。
2.4 脓毒症患者血HDL-C水平与各指标的相关性
脓毒症患者血清HDL-C水平与PCT、CRP、APACHEⅡ评分、SOFA、IL-6评分均呈明显负相关(r分别为-0.780,-0.697,-0.773,-0.778,-0.561,均P<0.05)。
2.5 多因素logistic回归分析
将IL-6、CRP、PCT、T1 HDL-C、T3 HDL-C、T5 HDL-C、乳酸、APACHE-Ⅱ评分纳入logistic多因素回归分析,结果显示乳酸为脓毒症死亡的危险因素,而第5 d的HDL-C则是保护性因素(表3)。
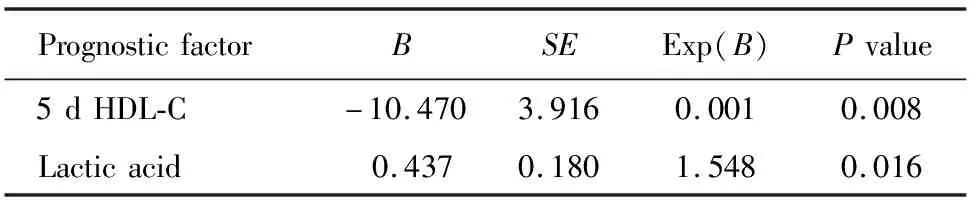
表3 脓毒症患者预后多因素logistic回归分析(Wald法)
2.6 第5天HDL-C水平和乳酸对判断脓毒症预后价值的比较
ROC曲线分析显示,第5天血HDL-C对脓毒症患者28 d病死率的预测价值较大,曲线下面积为0.833(P<0.01);乳酸对脓毒症预后也具有一定的预测价值,曲线下面积为0.708(P<0.01),但两者的差异无统计学意义(Z=1.214,P=0.22)。以第5天血HDL-C<0.485 mmol/L作为预测28 d死亡临界值时,敏感度为93.5%,特异度为73.7%;以乳酸3.805 mmol/L作为截断值时,灵敏度为78.9%,特异度为56.5%。详见图1。
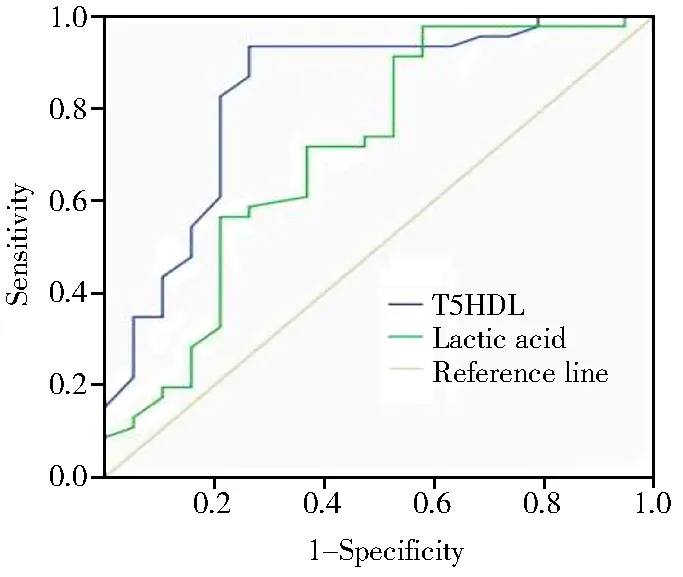
图1 第5天HDL-C水平和乳酸对脓毒症患者 28 d 死亡的预测价值
3 讨 论
脓毒症是一种急性炎症反应失调的综合征,其特点是过度炎症,与全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)和内源性炎症介质释放有关,引起代偿性抗炎反应综合征(compensatory anti-inflammatory response syndrome,CARS)[8-9]。SIRS和CARS之间的不平衡导致炎症反应异常,加重全身损伤,引起血流动力学不稳定、代谢紊乱和稳态失衡,并造成多器官损伤甚至死亡。脓毒症患者的临床状况变化迅速,病情严重程度波动幅度大,因此需要有疾病特异性和敏感性的生物指标来反映治疗疾病严重程度指导治疗。
HDL-C是人类血浆中主要的脂蛋白,载脂蛋白A1是其主要的结构载脂蛋白。在脓毒症等病理状态下,HDL-C的代谢、蛋白质成分、结构等发生重大变化。研究发现,患者发生脓毒症后脂蛋白水平将迅速下降到正常浓度的50%,而其中主要是HDL-C。本研究亦发现,脓毒症患者的HDL-C浓度明显低于对照组。此外,从研究进入到第5天的连续血液样本显示,脓毒症患者的HDL-C水平仍不断下降,且存活脓毒症患者的HDL-C水平比非幸存者高。其可能的机制为在急性时相反应中,sPLA 2表达上调,血浆水平显著升高。sPLA 2增加HDL载脂蛋白和HDL胆固醇酯的分解代谢,从而降低HDL-C血浆水平[10]。
现已经证实的参与脓毒症炎症反应的炎性介质主要有肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)和白细胞介素-6(interleukin-6,IL-6)等[11]。van der Westhuyzen等[12]研究表明于感染时机体产生CRP、IL-1、TNF-α等促炎细胞因子影响脂类代谢。有学者研究证实,脂蛋白可中和及结合革兰阴性(G-)微生物来源的脂多糖(lipopolysaccharide, LPS)和革兰阳性(G+)微生物来源的脂质酸,有效封闭内毒素生物效应部位,阻断其激活炎性细胞的作用[13]。血中HDL-C水平可能密切反映炎症的存在和严重程度以及对治疗的反应。本次研究中也发现脓毒症患者血HDL-C与炎症指标IL-6、CRP及PCT均呈良好的负相关性,且与SOFA评分、APACHEⅡ评分负相关。我们认为,在脓毒症的早期阶段,血清HDL-C水平反映了脓毒症患者的病情严重程度,因此HDL-C水平升高意味着病情的加重或恶化。
只有少数研究了脂类浓度对危重病和严重脓毒症患者预后的预测能力。Cirstea 等[14]已经证明,在脓毒症患者中,较低的HDL-C水平与死亡率的增加和不良的临床结果显著相关。Lekkou等[15]进行的一项前瞻性研究表明脓毒症患者第3天的IL-10水平(OR=0.92;95%CI0.85~0.99;P=0.027)是预后不良的独立预测因素;而入院时HDL-C水平(OR=1.3;95%CI1.03~1.63;P=0.021)是严重脓毒症患者生存的良好预测指标。HDL-C可能具有抗炎特性,因为它具有结合及中和革兰阴性菌的LPS和革兰阳性菌的磷脂壁酸的能力。
本研究对比死亡组与存活组不同时间点的HDL-C水平发现,2组患者血HDL-C起始水平均小于正常值,第3天HDL-C水平下降幅度最大,都呈现了下降的发展趋势。存活组各时间点HDL-C均高于死亡组,提示动态监测血HDL-C水平能使临床医师及时了解脓毒症患者的病情变化,为评估预后提供依据。进一步通过logistic回归分析显示,乳酸和第5天HDL-C是影响患者死亡的危险因素,乳酸水平越高患者死亡风险越大,而HDL-C则是一种保护性因素,故可认为监测HDL-C有助于评估病情及预后。进一步ROC曲线分析显示第5天血HDL-C水平对脓毒症患者28 d病死率的预测价值较大,AUC为0.833(P<0.01);乳酸对脓毒症预后也具有一定的预测价值,AUC为0.708(P<0.01);但两者的差异无统计学意义(Z=1.214,P=0.22)。以第5天血HDL-C<0.485 mmol/L作为预测28 d死亡临界值时,灵敏度为93.5%,特异度为73.7%。
APACHEⅡ评分、CRP、PCT广泛应用于评判病情严重程度和预后,其既可以预测重症监护病房患者预后,又可以预测脓毒症患者预后[16-17]。本研究中死亡组APACHEⅡ评分、CRP、PCT明显高于存活组,提示与脓毒症患者病情和预后密切相关。
本研究仍有局限性,这是一个小规模的试点试验,只有有限数量的患者,且是单中心研究,且患者入组前真实血脂水平难以判定,缺乏对患者胃肠功能的评估,可能会对结果产生影响,还需开展进一步研究。
综上所述,在危重患者中,血清HDL-C是一种与脓毒症预后有关的临床指标,有助于医师及时调整治疗策略,减少患者死亡率。

