原发性血小板增多症致门静脉高压一例并文献复习
李健,蒋瑜,任瑾,闫晨薇,呼圣娟*
(1西北民族大学第一附属医院·宁夏回族自治区人民医院腔镜中心,银川750000;2宁夏医科大学,银川750000)
1 临床资料
患者,女,65岁,于2019年12月13日收住于宁夏人民医院总院。患者7年前因胃胀就诊于外院查外周血血小板增多;末梢血涂片示中性分叶核粒细胞89%,淋巴细胞6%,单核细胞1%,血小板小簇分布,可见大血小板,红细胞大小及形态正常,部分粒细胞浆中可见空泡;骨髓穿刺示粒系、巨核系增生明显活跃;腹部彩超提示脾大,未见门静脉增宽,患者未进一步就诊。后于2016年11月13日就诊于我院,行骨髓活检提示CMPD(粒系、巨核系两系增生),送检JAK2/V617F基因阳性,BCR/ABL融合基因阴性,明确诊断为原发性血小板增多症(essential thrombocythemia,ET),查腹部彩超提示肝大、脾大(脾厚7.9 cm,下极达盆腔),门静脉增宽(2.1 cm),院外曾口服羟基脲及皮下注射干扰素30万单位(具体不详),未规律复诊。2019年5月20日该患者因消化道出血就诊我院消化内科,查腹部CT提示门静脉增宽,直径约1.7 cm,脾静脉增粗,食管、胃部静脉曲张,直肠、肛静脉增粗迂曲,脾大,肝脏各叶比例不协调(图1,2);查肝炎全套、自身免疫学检查、肝纤维化四项均未见异常。2019年12月13日患者再次出现呕血,呈鲜红色,呕血约6次,解暗红色大便,就诊于我院。既往史无特殊。入院查体:脉搏150次/分,血压80/62 mmHg(1 mmHg=0.133 kPa),全身皮肤、睑结膜苍白,全腹部压痛阳性,肝肋下约3 cm,脾脏肋下约20 cm,肝脾肋下无叩击痛。实验室检查:白细胞62.91×109/L,血红蛋白90.0 g/L,血小板1 698×109/L;肝功能:丙氨酸氨基转移酶24.9 U/L,门冬氨酸氨基转移酶24.5 U/L,白蛋白34.0 g/L;腹部彩超:肝弥漫性病变,肝内钙化灶,门静脉增宽,脾大(脾厚5.3 cm,长径20.7 cm),脾脏回声增粗,脾静脉增宽(1.4 cm)。双下肢血管未见血栓及血管炎。急诊胃镜下可见食管静脉重度曲张并出血,胃底静脉曲张(图3)。

图1 全腹增强CT冠状面显示脾大;水平面显示静脉期肝门静脉增宽,门静脉高压
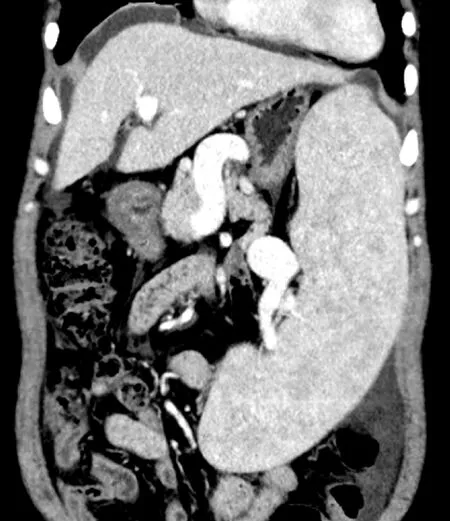
图2 全腹增强CT矢状面显示脾大
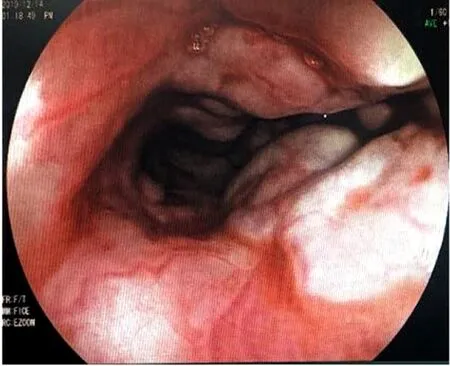
图3 硬化治疗前食管静脉曲张伴出血
患者既往无感染性及自身免疫性肝炎病史,结合患者血常规、骨髓检查,考虑为ET导致继发性门静脉高压及食管胃底静脉曲张。予以硬化剂注射止血(图4)、抑酸、降低门静脉压力、改善循环等治疗后,复查血小板659×109/L,无新发出血,患者自动出院。
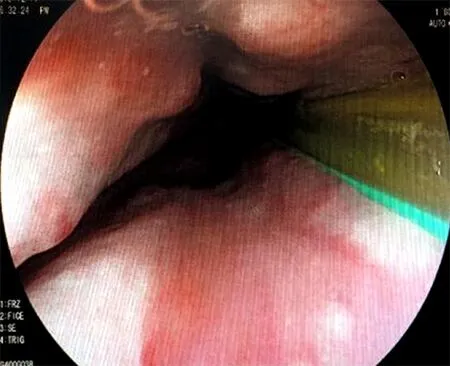
图4 治疗后食管静脉曲张基本消失
2 讨 论
ET是一种慢性骨髓增殖性肿瘤(myeloproliferative neoplasm,MPN),以小或大血管栓塞和出血为特征,后期有向骨髓纤维化(myelofibrosis,MF)或急性髓细胞性白血病(acute myeloid leukemia,AML)转化的危险。据估计,美国每年的ET发病率为2.5/10万人[1,2]。女性发病率高于男性(比例约为2∶1)[3,4]。目前我国尚缺乏相关流行病学资料。研究发现ET患者普遍存在基因突变。2005年首次报道了JAK 2 V617F,作为最常见的突变,约占ET患者50%~60%[5,6]。2006年观察到骨髓增生白血病(myeloproliferative leukemia,MPL)病毒癌基因(位于染色体1p34上)的突变,该基因编码血小板生成素(thrombopoietin,TPO)受体,约占ET患者的5%[7,8]。JAK2和MPL(即MPL W515L/K)突变均通过JAK-STAT通路的本构激活导致细胞因子依赖性信号的异常,这些酪氨酸激酶的突变导致与生长因子效应无关或对生长因子效应过敏的骨髓增生,特别是TPO。最近的研究发现,在20%~25%的ET(缺少JAK2/MPL突变)患者中除JAK2和MPL之外还包括钙网蛋白(calreticulin,CALR,位于19p13.2号染色体上)的突变[9,10]。与JAK2和MPL W515L/K不同,CALR突变几乎发生在所有具有血小板增多症患者中。
ET临床症状缺乏特异性,常见为头痛、头晕、昏厥、肢体感觉异常及不典型的胸痛等,多数患者以其他系统临床症状就诊或体检时发现血小板增高。本例患者以门静脉高压为主要临床表现,易掩盖ET疾病本身。
目前关于ET的诊断,主要根据2016年世界卫生组织诊断标准[11]。该患者满足WHO的4项主要诊断标准,已明确诊断为ET,排除其他肝硬化因素,结合腹部彩超及全腹部增强CT,考虑为ET导致继发性门静脉高压。然而引起门静脉压力升高最常见的原因为肝硬化,ET致门静脉高压相对罕见。关于ET导致门静脉高压的原因并不是很明确。目前比较公认的机制为:(1)脾大导致门静脉系统血液循环量增加,是形成高循环动力的主要因素;(2)髓外造血、肝窦状隙纤维化改变引起肝内阻塞,导致门静脉系统阻力升高;(3)JAK2基因加重血管内皮损伤,导致门静脉、脾静脉血栓形成,引起门静脉高压[12-14]。
血栓是ET的常见并发症,同时也是门静脉高压形成的危险因素。阿司匹林作为降低血栓形成风险的治疗基石。根据国际原发性血小板增多症中血栓形成的国际预后评分。在没有心血管危险因素的情况下,低风险患者可以单独观察来处理;中度风险患者建议使用低剂量阿司匹林治疗;对于高风险患者,尤其是具有JAK2 V617F突变的人,羟基脲和低剂量阿司匹林(81 mg/d)相结合是治疗的标准[13]。最新研究数据表明[15],推荐每天2次阿司匹林能有效抑制血小板凝集。这是由于ET中血小板更新加快,每天1次小剂量阿司匹林不足以产生足够的(24 h)血小板血栓烷A2合成抑制作用。因此预防门静脉血栓形成是降低门静脉压力的有效方法之一。该患者根据评分(表1)虽为高风险,但考虑合并消化道出血,同时凝血功能异常,未给予抗血小板治疗。对于合并急性消化道大出血,内镜下治疗及静脉给予药物可有效达到止血目的,缓解期可选择口服药物降低门静脉压力预防出血。脾脏切除亦可降低门静脉压力,但切除后的并发症,一方面可能会导致造血功能障碍,另一方面可引起继发性血小板增高。可见选择合适的治疗方式,需根据患者自身情况评估获益及风险。预后方面,ET通常是一种惰性疾病,大多数患者的预期寿命与普通人群无显著差异[16]。但该患者因门静脉高压导致多次消化道出血,提示预后可能不良。

表1 预测每年血栓形成风险的IPS ET-Thrombosis评分
总之,对于ET合并门静脉高压的患者主要治疗目标是降低血栓形成、降低门静脉压力,减少出血并发症的风险。重要的目标是将其转化为急性白血病或ET后骨髓纤维化的风险降至最低,并控制全身症状,保证生活质量。

