乳腺腺样囊性癌超声与病理特征
徐巧阳,黄必飞,张小伟,胡桂女
(东阳市人民医院,浙江 东阳322100)
乳腺腺样囊性癌(adenoid cystic carcinoma,ACC)较罕见,占所有乳腺癌1%以下,该乳腺癌常阴性表达雌激素、孕激素和表皮生长因子受体2,但ACC的预后比一般的浸润性乳腺癌好,局部复发和远处转移少见,无病生存期较长,与常见三阴性乳腺癌预后差的特点正好相反[1]。本文对4例ACC患者的临床资料进行分析,以便临床上对其有更深入的认识。
1 资料与方法
1.1 一般资料 收集本院2011年3月-2019年10月收治的4例发生于乳腺的ACC。4例均为女性,年龄35-55岁,其中绝经前、后各2例;左乳3例,右乳1例;位于外上象限2例,外下象限1例,内上象限1例;3例因乳房无痛性肿块就诊,1例因乳房超声检查异常就诊。4例均行手术治疗,其中3例行保乳扩大切除术加前哨淋巴结活检,1例行乳房单纯切除术加前哨淋巴结活检;术后2例ⅡA期患者行辅助性化疗,分别行脂质体阿霉素+环磷酰胺化疗或环磷酰胺+氟尿嘧啶+表柔比星化疗;2例Ⅰ期患者未行化疗。术后随访10~96个月均未见复发或远处转移。
1.2 方法
1.2.1 超声检查 仪器与方法:采用Siemens Acuson S2000型彩色多普勒超声诊断仪,探头频率6~18 MHz。取仰卧位,双手置于枕后,充分暴露双侧乳腺及腋窝,分别行纵、横和扇形切面扫查乳房各个象限,注重腋尾部,并扫查腋窝。观察肿块的位置、内部回声、大小、形态、生长方向、边界、边缘、钙化等情况。使用彩色多普勒血流显像检测肿块血流情况。以脉冲多普勒取样,测量肿块动脉血流收缩期峰值流速、阻力指数。扫查双侧腋窝有无肿大淋巴结,最后依据BI-RADS-US分级标准对病灶进行评估。
1.2.2 病理检查 标本经4%中性甲醛固定,常规脱水,石蜡包埋,常规切片,苏木素伊红染色。免疫组化采用EnVision二步法,切片浸于3% H2O2溶液中3分钟,高压抗原修复10分钟,冷却至室温,充分水洗,磷酸盐缓冲液(PBS)浸洗,3分钟重复3次;甩去多余液体,加入一抗4℃过夜,PBS浸洗,3分钟重复3次;甩去多余液体,滴加通用型二抗-HRP聚合物,37℃,30分钟;二氨基联苯胺(DAB)显色2分钟,在显微镜下观察显色情况,苏木素复染,0.1%盐酸乙醇分化,PBS冲洗返蓝,乙醇脱水、透明中性树胶固封。
2 结果
2.1 超声表现 4例中肿块形态规则、边缘清楚1例,形态不规则、边缘不清3例;呈低回声2例,呈高回声、囊实混合性回声各1例;CDFI示4例肿块内未见明显血流信号或仅见少许血流信号;3例BI-RADS评估4A级、1例BI-RADS评估3级。详见图1。

图1 乳腺ACC超声表现,见左乳高回声团,边界清楚,内部回声不均匀,CDFI示内未见明显血流信号。
2.2 病理表现 (1)大体表现:瘤体最长径分别为0.8cm、1.2cm、2.5cm、3.0cm,边界均较清楚,剖面灰白或灰红,质较硬。(2)镜下表现:肿瘤细胞围绕小的囊状腔隙分布(图2A),形成两种腺腔,一种为真性腺腔,内含嗜伊红分泌物,为PAS阳性的中性黏液;另一种为假性腺腔,肿瘤细胞呈筛状、小管状结构生长(图 2B)。 (3)免疫组化:全部病例 ER(-),PR(-),CerbB-2(-),CK5/6(+)(图 2C),Calponin(+),P63(+)(图 2D),Ki-67(+)<10%。(4)肿瘤分期。术后病理分期:2 例 PT1N0M0,2 例 PT2N0M0;临床分期:2例Ⅰ期,2例ⅡA期。
3 讨论
3.1 临床表现 乳腺ACC为低度恶性肿瘤,其组织学表现类似于发生于涎腺的相关肿瘤。ACC可发生于具有管状腺泡结构的外分泌性腺体的部位和器官,如涎腺、泪腺、汗腺、鼻腔、支气管、乳腺等[1]。临床常见症状为乳腺可触及肿块,偶可有疼痛或者压痛,临床表现缺乏特异性,以中老年女性多见,中青年女性也并不少见,本组4例均为女性,年龄35-55岁,其中无痛性肿块3例。文献中有极少数儿童及男性乳腺ACC的报道[2]。乳腺ACC常为单发,双侧受累罕见,偶可伴其他类型乳腺癌或为其他乳腺癌中的灶性成分[3]。本组均为单发。
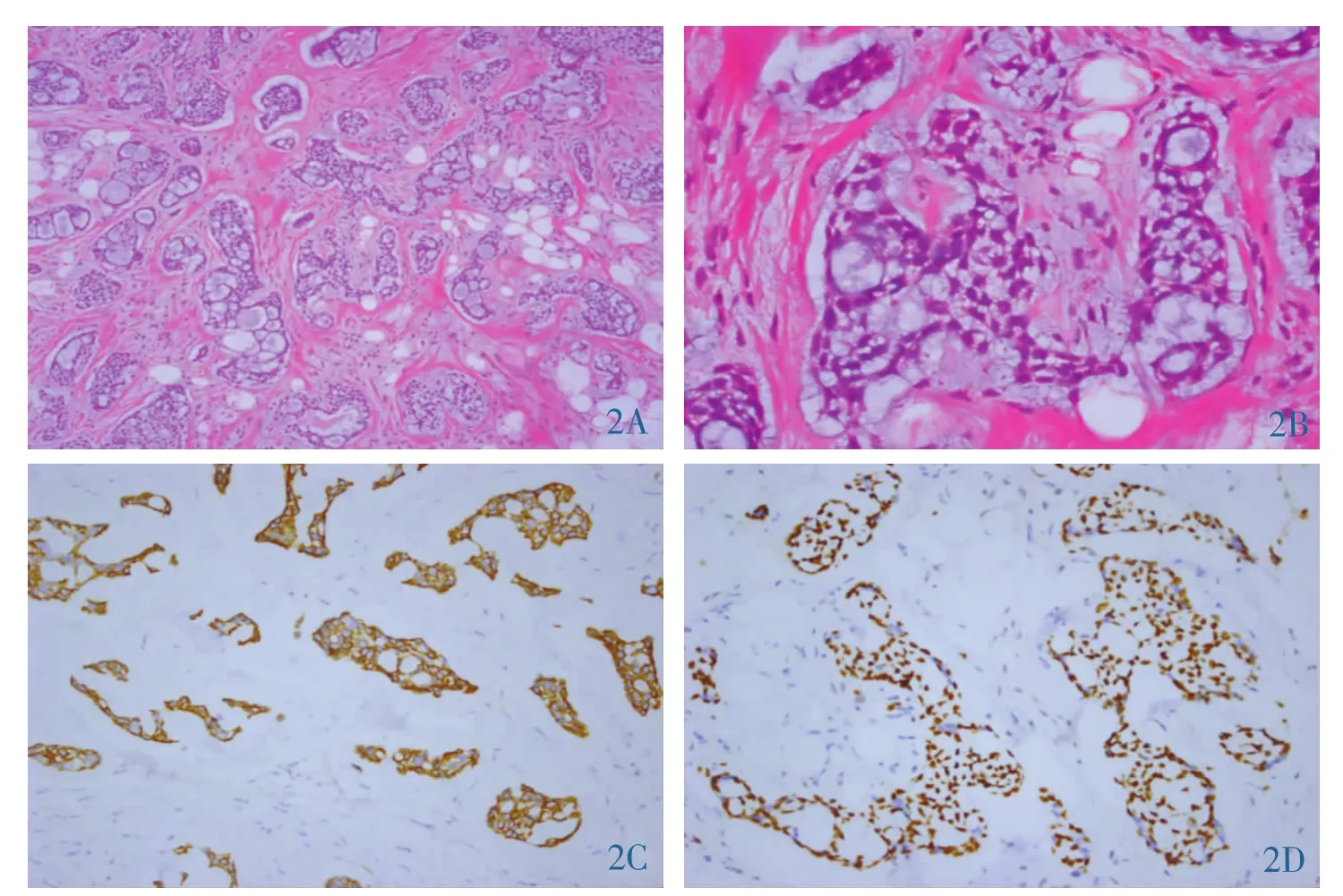
图2 乳腺ACC病理表现。2A:显微镜下示肿瘤细胞围绕小的囊状腔隙分布,形成筛孔状(HE×100);2B:高倍镜下见肿瘤细胞大小较一致,异型性小(HE×400);2C:免疫组织化学CK5/6胞浆强阳性(EnVisoin×200);2D:免疫组织化学P63核强阳性(EnVisoin×200)。
3.2 影像学表现 (1)常规表现:不规则等密度或略高密度占位性病变,边界清楚或不清,可有分叶,或表现为局部的不对称致密影,钙化不易见。(2)超声表现:多为不均质的低回声占位,根据其他表现可分为边缘毛糙型和边缘规整型。边缘毛糙型形态不规则,内部回声不均,边界不清,边缘毛糙,与常见乳腺癌声像图相似;边缘规整型形态规则,类似良性肿瘤声像图,血流信号多为少血供表现。李娜等[4]研究认为,乳腺ACC超声图像规整型肿块的病理类型以管状型或筛状型为主,超声图像毛糙型肿块病理类型以实体成分为主。本组肿块超声下形态不规则、边缘不清3例;呈低回声2例,呈高回声、囊实混合性回声各1例;CDFI示肿块内未见明显血流信号或仅见少许血流信号,与文献报道基本相符。
3.3 病理表现 病理诊断是确诊乳腺ACC的金标准,但术中冰冻快速切片不易诊断,本组快速冰冻切片诊断浸润性癌(首先考虑腺样囊性癌可能)2例,浸润性癌1例,不除外腺样囊性癌1例,术中快速冰冻切片均未明确诊断为ACC。病理大体检查:肿瘤多数境界清楚,最长径0.7~12.0cm,切面灰白或灰红,质较硬,部分病例可见大小不等的囊腔结构。显微镜下乳腺腺样囊性癌类似于发生于涎腺的相关肿瘤,具有三种结构,即筛状、小梁-管状及实性结构。筛状型最常见也最具特征性,肿瘤细胞围绕小的囊状腔隙分布,形成两种腺腔,一种为真性腺腔,内含嗜伊红分泌物,一般为PAS阳性的中性黏液;另一种为假性腺腔,为间质内折所致多呈圆形,内含均质性物质,可呈嗜酸性透明样或呈嗜碱性,本组真、假性腔均可见,免疫组化方面4例ER(-)、PR(-)、CerbB-2(-),P63(+)、Calponin(+),E-cadherin(+)。有学者将腺样囊性癌分为3级,其预后存在差异。1级:无实性区域;2级:实性区域不足30%;3级:实性区域大于30%[5]。术后随访10~96个月均未见复发或远处转移。
3.4 分子病理表现 乳腺ACC中可检测到t(6;9)(q22~23;p23~24)基因易位导致 MYB-FIB 融合,激活MYB癌基因,MYB-NFIB融合基因与乳腺ACC的发生发展密切相关。PTEN与PIK3A共存突变、EZH2高表达以及IMP3过表达对研究乳腺ACC转移性方面有意义,可用于提示疾病预后并指导手术范围[6]。本组未行分子病理检查。
3.5 鉴别诊断 (1)胶原小体病。为一种良性病变,往往不形成肉眼可见的肿块,而ACC为肉眼可见肿块,形态学上表现为无细胞成分的嗜酸性无定形物质充填于增生的小叶腺泡及小导管中,Ⅳ型胶原抗体染色呈阳性,结合大体检查、组织形态学及免疫组化特点可鉴别两者。(2)浸润性筛状癌。浸润性筛状癌由单一类型的肿瘤细胞构成,而腺样囊性癌常含有双层细胞结构,免疫组化肿瘤细胞P63、CK5/6及CD117阴性,而ER、PR阳性;而ACC肿瘤细胞往往 ER、PR为阴性,P63、CK5/6及 CD117则呈阳性,可鉴别两者。(3)实性腺样囊性癌。相对少见,免疫组化及基因检测对鉴别诊断具有重要意义,小细胞癌免疫组化表达神经内分泌标记物,淋巴瘤表达LCA,实性腺样囊性癌具有特征性的MYB-NFIB融合基因。
3.6 治疗与预后 目前治疗一般采用乳腺单纯切除或保乳切除,由于极少数患者出现局部复出或肺转移,故一般不主张腋窝淋巴结清扫,可行前哨淋巴结活检[7]。其他放化疗治疗对预后的影响尚不确定,有报道提出,腺样囊性癌中的实性成分越多预后越差,因此认为高级别/间变性肿瘤可能更具有侵袭性。ACC具有良好的生物学行为,总体预后较好,本文4例长期随访均未出现复发与转移,提示乳腺ACC预后良好。

