高中化学滴定曲线图象题的分析方法
◇ 甘肃 宋可忠
滴定实验是高中化学很重要的定量实验,在近几年的高考试题中经常出现,考查学生对图象的阅读能力、对滴定过程的了解程度、对滴定原理的理解以及对弱电解质的电离、盐的水解、沉淀的溶解平衡等原理的掌握程度.试题综合性强、难度大,本文对常见的滴定图象进行解题方法的分析.
1 酸碱中和滴定图象题
酸碱中和滴定图象题更多的是结合滴定曲线判断滴定过程中溶液离子浓度的比较及计算,通常以选择题或反应原理综合题的形式出现.
例1常温时,分别向体积、浓度均为20 m L 0.1mol·L-1的HX溶液、HY溶液中滴加等浓度的Na OH溶液,混合溶液的p H与加入的Na OH溶液体积(V)之间的关系如图1所示.下列说法正确的是( ).

图1
A.常温时,0.1mol·L-1HX溶液中 HX的电离度为1%
B.V=10 m L时,同时微热溶液(忽略体积变化),溶液的c(X-)/c(Y-)增大

C.V=20m L时,HX曲线对应的溶液中D.滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂
解析
由图象信息可知,V=0时,0.1mol·L-1HX溶液的 p H=4,溶液中c(H+)=1×10-4mol·L-1,HX的电离度为0.1%,选项 A 错误;由于HX为弱酸,HY为强酸,当V=10m L时,HX溶液中溶质为等浓度的HX和Na X,溶液呈酸性,以HX的电离为主,HY溶液中的溶质为等浓度的HY和Na Y,且两溶液中溶质浓度相等,微热时只对HX溶液有影响,促进HX的电离,所以增大,选项B正确;由于HX为弱酸,当V=20m L时,HX曲线对应的溶液中溶质为Na X,是碱性溶液,选项C错误;由于HX为弱酸,用Na OH溶液滴定时不能用甲基橙作指示剂,选项D错误.答案为B.
例2常温时,用0.10 mol·L-1的氨水滴定10.00m L0.05mol·L-1的二元酸H2A溶液,滴定过程中加入氨水的体积(V)与溶液中的关系如图2所示.下列说法正确的是( ).

图2
A.H2A的电离方程式为H2A⇌H++HA
B.B点溶液中,水电离出的 H+浓度为1.0×10-6mol·L-1
C.C点溶液中,

解析
根据图象,A点时,0.05mol·L-1的二元酸H2A溶液的,此时

说明H2A为二元强酸,H2A的电离方程式为H2A=2 H++A2-,选项A错误;B点溶液中,加入了10m L 0.10mol·L-1的氨水,恰好完全反应,此时溶液应为(NH4)2A溶液
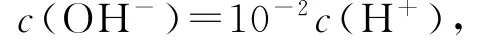

此时溶液因NH+4水解而呈酸性,溶液中的H+均是水电离产生的,故水电离出的H+为1.0×10-6mol·L-1,选项B正确;C点溶液中,加入了12.5m L0.10 mol·L-1的氨水,此时溶液应为(NH4)2A 和 NH3·H2O混合溶液根据电荷守恒:

即c(NH+4)=2c(A2-),选项C错误;
B点时,溶液应为0.025 mol·L-1(NH4)2A溶液,溶液因NH+4水解而呈酸性
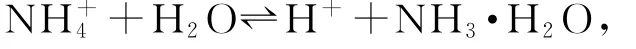
该反应的水解常数为
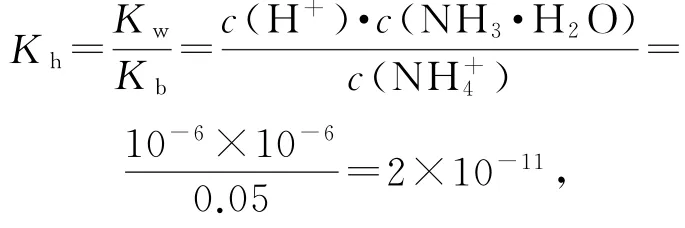
解题方法:首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次看起点,通过起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;再次找滴定终点和p H=7的中性点,判断滴定终点的酸碱性,然后确定中性点(p H=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况.
关于滴定过程中的定量关系:
1)电荷守恒关系在任何时候都存在.
2)物料守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一定为等量关系.
2 盐溶液滴定图象题
盐溶液滴定曲线问题侧重考查滴定过程中的反应原理,判断滴定过程溶液中离子浓度关系、盐的电离和水解能力程度的大小问题.
例3Na OH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸 H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图3所示,其中b点为反应终点.下列叙述错误的是( ).
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液p H=7
D.c点的混合溶液中,
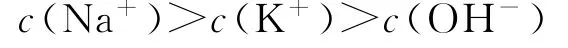

图3
解析
由题意,H2A为二元弱酸(根据电离平衡常数判断),KHA为二元弱酸的酸式盐,其电离平衡常数(Ka2=3.9×10-6)大于水解平衡常数,其溶液呈现酸性,向其中加入Na OH溶液,反应为
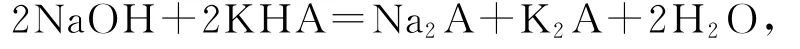
溶液中Na+和A2-的浓度增大,由图象可知,溶液的导电性增强,说明导电能力与离子浓度和种类有关,溶液中离子浓度大,导电能力强,选项A说法正确;a点溶液中导电的离子为K+、HA-,b点溶液中导电的离子为K+、Na+、A2-,且a点和b点溶液中的K+物质的量相同,b点导电能力比a点强,因此,Na+与A2-的导电能力之和大于HA-的,选项B说法正确;b点是反应的终点,其溶液中的溶质为等浓度的Na2A和K2A,它们都是强碱弱酸盐,溶液呈碱性,选项C说法错误;由于b点溶液中的溶质为等浓度的Na2A和K2A,溶液中c(K+)=c(Na+),c点是继续加Na OH后的混合溶液,且a点到b点所加的Na OH溶液体积大于b点到c点加的Na OH溶液的体积,因此c点时c(K+)>c(OH-),选项D说法正确.
例4常温下,向10m L浓度均为0.1mol·L-1的Na OH和Na2CO3混合溶液中滴加0.1mol·L-1的盐酸,溶液p H随盐酸加入体积的变化如图4所示.下列说法正确的是( ).

图4
A.在a点的溶液中,c(Na+)>c(CO2-3)>c(Cl-)>c(OH-)>c(H+)
B.在b点的溶液中,2n(CO2-3)+n(HCO-3)<0.001mol
C.在c点溶液的p H<7,是因为此时HCO-3的电离能力大于其水解能力
D.若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的p H=7时,c(Na+)=c(CH3COO-)
解析
由题意可知,在Na OH和Na2CO3混合液中滴加盐酸涉及反应的先后顺序为
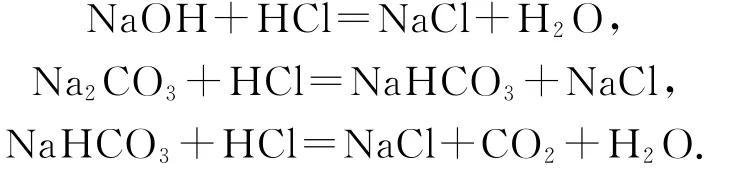
依据图象,a点加入盐酸的体积为5m L,可知第一步反应只进行一半,溶液中的溶质及浓度关系为c(Na OH)=c(Na Cl)<c(Na2CO3),由于溶液中有H2O提供的OH-,所以c(OH-)>c(Cl-),选项 A错误;b点时溶液的p H=7,c(H+)=c(OH-),结合电荷守恒
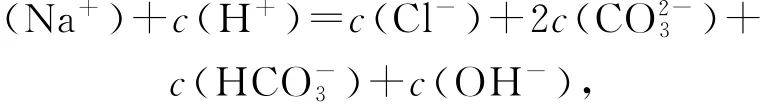
得到
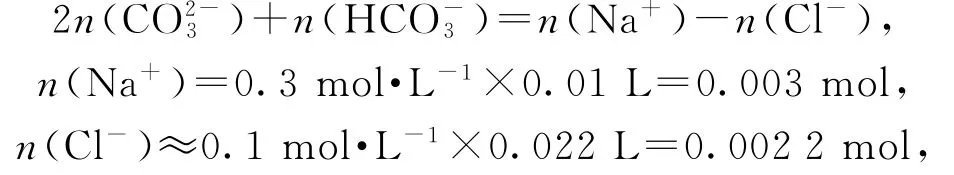
因此,2n(CO2-3)+n(HCO-3)<0.001mol,选项B正确;由c点时所加盐酸的体积及反应关系可知,溶液中的溶质应为Na Cl、Na HCO3,但由于c点溶液呈酸性,原因是反应产生的二氧化碳溶解到溶液中所致,选项C错误;若将盐酸换成醋酸,当滴定到溶液呈中性时,该溶液中含有溶解的CO、HC,依据电荷守恒,选项D错误.
解题方法:在滴定盐溶液时,首先要明白滴定过程中发生的反应及先后顺序,进而可以根据滴定试剂的加入量对反应进程做出准确的判断,从而判断溶液中的溶质.其次要注意反应的节点,即每步反应恰好完成的点.如例题4中一级反应终点是将Na OH恰好中和的点,此时消耗的盐酸体积为10m L,溶液中的溶质为Na Cl和Na2CO3(1∶1)、二级反应终点时消耗的盐酸体积为20m L,溶质为Na Cl和Na HCO3(2∶1)、三级反应的终点时消耗的盐酸体积为30m L,溶质为Na Cl和溶解的CO2.对滴定过程中某一点时溶液的分析,要清楚此时溶液中溶质及量的关系,要考虑溶质的电离、水解,判断溶液的酸碱性,再结合电荷守恒.物料守恒判断离子浓度的大小关系.
3 隐含滴定过程的图象题
这类图象题看起来与传统的滴定曲线不同,它以弱电解质电离平衡的移动为知识载体,呈现的是通过弱电解质溶液的p H变化,引起电离平衡移动,而p H的变化是通过中和反应实现的.
例5改变0.1mol·L-1二元弱酸H2A溶液的p H,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随p H的变化如图5所示.下列叙述错误的是( ).
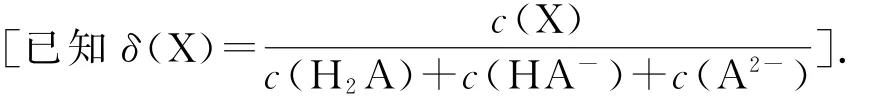
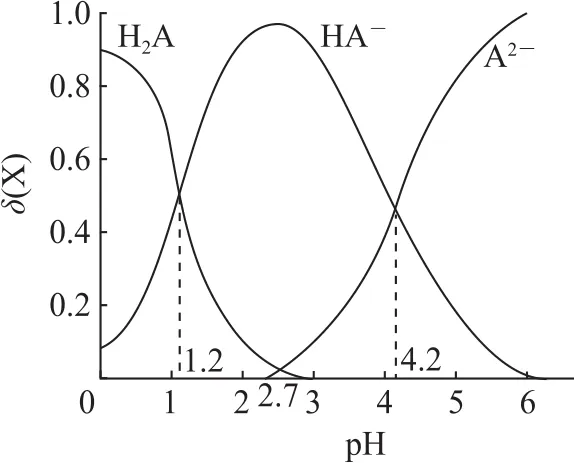
图5
A.p H=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.p H=2.7时,c(HA-)>c(H2A)=c(A2-)
D.p H=4.2时,c(HA-)=c(A2-)=c(H+)
解析
H2A为二元弱酸,其电离方程式为H2A⇌H++HA-、HA-⇌H++A2-,图象反映的是溶液中由于加入碱性物质使电离平衡正向移动,导致溶液p H增大时溶液中H2A、HA-、A2-的物质的量分数的变化结果.由图5可知,p H=1.2时,

由公式可知c(H2A)=c(HA-),选项A说法正确;H2A的二级电离为HA-⇌H++A2-,
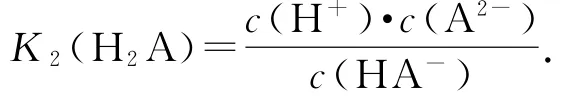
由图知p H=4.2时,c(A2-)=c(HA-),所以K2(H2A)=c(H+),lg[K2(H2A)]=-4.2,选项B说法正确;由题图知:p H=2.7时,c(HA-)>c(H2A)=c(A2-),选项C说法正确;由图知:p H=4.2时,δ(HA-)=δ(A2-),即c(HA-)=c(A2-)≠c(H+)=10-4.2mol·L-1,选项D说法错误.答案为D.
解题方法:解这类图象问题要清楚弱电解质的电离情况及图象表示的意义,若涉及电离平衡常数的计算,根据其表达式在图象中的特殊点(如曲线交点或有坐标值的点),进而可以判断盐溶液的水解平衡常数、酸碱性及其离子浓度关系;若涉及微粒浓度大小的判断,图象本身就反映出微粒含量的变化,可以直接从图象判断.
4 沉淀滴定图象题
沉淀溶解平衡曲线试题考查溶度积的应用及影响因素,通常以选择题或反应原理综合题的形式出现.
例6常温下,向10m L0.10mol·L-1Cu Cl2溶液中滴加0.10 mol·L-1Na2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图6所示.下列说法正确的是( ).
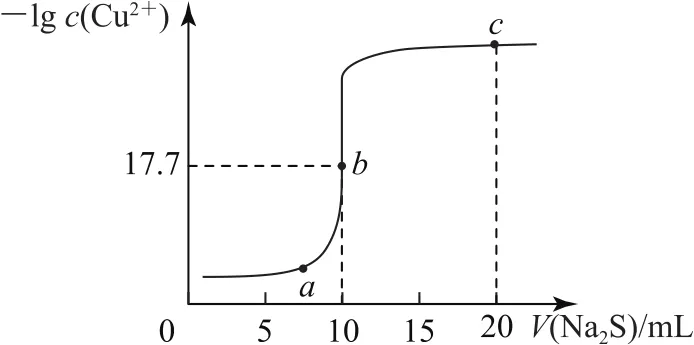
图6
A.Ksp(Cu S)的数量级为10-21
B.曲线上a点溶液中,c(S2-)·c(Cu2+)>Ksp(Cu S)
C.a、b、c三点溶液中,n(H+)和n(OH-)的乘积最小的为b点
D.c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
解析根据图象,在b点时Cu Cl2与Na2S恰好完全反应,此时溶液中c(Cu2+)=c(S2-)=1×10-17.7,Ksp(Cu S)=c(S2-)·c(Cu2+)=1×10-35.4,选项A错误;在a点时,溶液中已经产生Cu S沉淀,该溶液中c(S2-)·c(Cu2+)=Ksp(Cu S),选项B错误;选项C可以用Kw表达式进行判断,a、b、c三点溶液中,n(H+)和n(OH-)的乘积最小时为a点,选项C错误;根据V(Na2S)=20m L判断,c点时溶液中的溶质为浓度相等的Na Cl和Na2S,可以确定选项D正确.答案为D.
例7某温度下,向10m L0.1mol·L-lNa Cl溶液和10 m L0.1 mol·L-lK2Cr O4溶液中分别滴加0.1 mol·L-lAg NO3溶 液.滴 加 的 过 程 中p M[-lgc(Cl-)或-lgc(Cr)]与所加Ag NO3溶液体积之间的关系如图7所示.已知Ag2Cr O4为红棕色沉淀.下列说法错误的是( ).
A.该温度下,Ksp(Ag2Cr O4)=4×10-12
B.a1、b、c三点所示溶液中c(Ag+):a1>b>c
C.若将上述Na Cl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D.用Ag NO3标准溶液滴定Na Cl溶液时,可用K2Cr O4溶液作指示剂
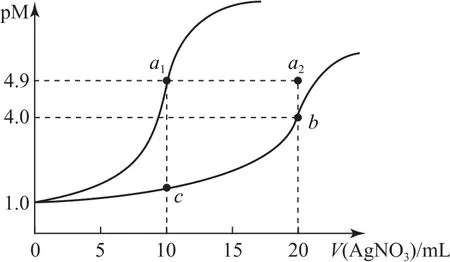
图7
解析
由图象数据可知,b点对应的为滴定K2Cr O4溶液的曲线,b点时恰好完全反应,
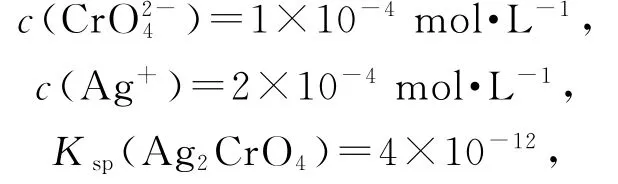
选项A正确;a1点时,溶液中c(Ag+)=c(Cl-)=1×10-4.9mol·L-1,c点时,溶液中的c(Cr)=0.025 mol·L-1,c(Ag+)=4×10-5.5mol·L-1,选项B错误;由于点a1对应的曲线为滴定Na Cl溶液的曲线,若Na Cl溶液浓度改为0.2mol·L-1,则恰好反应消耗的0.1mol·L-lAg NO3溶液为20m L,选项C正确;加入Ag NO3溶液时,Cl-先沉淀,用K2Cr O4溶液作指示剂,滴定终点时,会产生Ag2Cr O4红棕色沉淀,选项D正确.答案为B.
解题方法:沉淀滴定曲线问题的关键是抓住滴定恰好反应的点,可以计算沉淀的Ksp.若涉及离子浓度的计算可以利用Ksp、Kw进行,切记它们只是温度的函数.若涉及离子浓度大小的判定,先必须弄清楚溶液中的溶质.
总之,关于滴定曲线图象问题,首先依据滴定涉及的反应搞清楚横纵坐标的含义,如果坐标是对数先将其转化为指数.其次分析选项的内容,若是判定离子浓度的大小,要依据反应进程搞清楚此刻溶液中的溶质,再根据电离、水解及守恒关系判定.若涉及K的计算,通常利用图象中的交点、反应的终点及有坐标值的点进行.

