关于电解法冶炼铝的问题讨论
◇ 北京 王笃年(特级教师)
问题1电解法冶炼铝时为什么要加冰晶石作为“助熔剂”?冰晶石是如何“助熔”氧化铝的?
氧化铝的熔点太高(2050℃),工业生产中较难获得并保持这么高的温度.幸而科学家通过不懈探究发现了冰晶石(Na3Al F6)的“神奇作用”——它可以使Al2O3在1000℃左右“熔化”并电离为Al3+和O2-,从而实现电解法制铝.而且在电解高温下,冰晶石本身化学性质稳定,可以连续使用.
那么,冰晶石的“助熔”原理究竟是怎样的呢?可以这样理解,冰晶石是离子化合物,它本身的熔点较低(1000℃左右),熔化后电离为Na+、Al F3-6.试想1000℃高温下,这些快速运动的、带有电荷的离子,对Al2O3晶体的作用情况吧!就像极性H2O分子对Na Cl晶体的作用情况一样(H2O溶解Na Cl并使之电离),在Na+、Al F3-6的作用下,Al2O3电离为Al3+和 O2-.
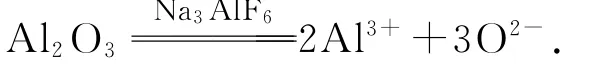
虽然表面上看是一种“助熔”作用,其实助熔的原理是“熔化了的液态冰晶石溶解(熔解)了氧化铝并使之发生了电离”.
需要提醒大家的是,千万不要妄想“助熔剂嘛,只用很少一点点就够了”.你去工厂实际考查就会知道,在电解槽的熔融体里Al2O3只占10%左右,大量的是冰晶石,还有很多其他辅助成分(如Li F、Na F、Mg F2、Ca F2、Al F3等).
问题2到底能不能用电解Al Cl3的方法制备铝?可以电解氧化铝,工业上为什么不直接电解Mg O?
Mg和Al同为活泼金属,工业制取Mg采用电解熔融无水Mg Cl2的方法,而制取Al则采用电解极其难熔的Al2O3的工艺.
关于为什么一般不用电解熔点低的Al Cl3的方法制Al(中学教科书里没有介绍),目前有多种解释,比较普遍的说法是“Al Cl3属于共价化合物,熔化状态下不电离、不导电”,这个说法似乎很合理,容易被接受.但真如此吗?
承接上一问题中关于冰晶石“助熔”氧化铝的解释,我们不妨设想,虽然Al Cl3本身是共价化合物,其自身熔化时难以电离,但如果找到一种熔点较低且可以“熔解”Al Cl3并使其电离的离子化合物,让它们形成共熔体,不就可以实现Al Cl3的熔融电解了吗?
事实上的确存在这种可能性,很多文献报道了Na Cl-Al Cl3熔体、Li Cl-Al Cl3熔体等的电解,它们都可以实现在较低温度下电解获得铝.
至于为什么尚未大规模采用以上电解法进行实际生产,也许与其他因素有关.例如,Al Cl3本身的制造工艺、生产成本,人们对传统工艺的路径依赖(思维惰性)等.
至于为什么不用电解Mg O的方法制镁,那是因为Mg Cl2本身就是典型的离子化合物,且熔点(715℃)远低于 Mg O(2800℃),工艺上更容易实现,生产成本低.在制取Mg Cl2不是很难(成本不高)的情况下,当然选择电解无水Mg Cl2了.
问题3电解铝时为什么要使用会损耗的碳电极?
电解铝使用会损耗的碳电极,可谓无奈之举.理论上可以使用惰性材料,可是我们知道,该过程是在1000℃高温下的电解槽里发生的阳极电解反应,如果使用金属材料,它首先得具有高于1000℃的熔点,然后在该温度下还得是惰性的,不易被氧化.这样的材料即使存在,也会非常昂贵,不易找到.
相比而言,碳电极使用的是碳化的石油焦,经济实惠.因为石油焦本身就是传统石油炼制的副产品,价格低廉.
当然,我们也不排除有朝一日找到(或合成出)相对便宜实用的惰性阳极材料,以替代碳电极的可能性.
问题4使用碳电极电解铝,阳极产生的气体会是O2吗?
采用碳电极电解液态Al2O3的情况下,断然不可能得到O2.试想,在1000℃高温下,即使产生O2,也会立即与电极发生反应,生成CO2或CO.
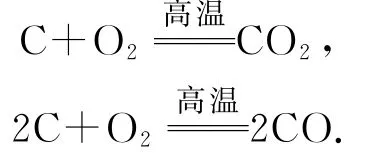
中学教科书里写的电极方程式只是一个示意性的式子,可认为它没有写出后续的作用过程.事实上,阳极气体主要由CO2、CO构成.正是由于不断发生这两个反应,才导致碳电极不断损耗,所以需要定期更换.当然,实际电解槽阳极产生的气体成分远不止CO2、CO这么简单,还会有 HF、CF4、F3C—CF3(全氟乙烷)等含氟污染性气体,以及被气流带出的矿物气溶胶颗粒等.
问题5铝电解槽内如何使温度保持那么高?
虽然铝电解槽内需要保持很高的温度,但电解槽一经启动,则不再需要额外的加热设施.因为我们知道电流通过电解质时,由于电解质具有电阻,本身就可以发热.
初次启动电解槽时,需要一定的外来热源.如,可以引入一定量液态的铝液;或者利用外部热源加热碳电极到一定温度等.
我们知道,电解质都有较大的电阻,电流通过电解质时必然放出热量.工业生产中,为保证单位时间内铝的产出量,通常采取高电流密度的方法电解,因此,电解槽内因通过电流放出的热量足以维持其温度.

