“铁及其化合物”常见考点例析
◇ 安徽 尉言勋 徐 楠
铁是高中五大金属元素(钠、镁、铝、铁、铜)中的核心元素,铁属于可变价金属,所以涉及的相关化学反应较多,在试题中可以与氧化还原反应、物质的量、原电池等相关知识结合考查.铁及其化合物每年高考均会考查,然而每次均有“新意”,可谓“年年岁岁铁相似,岁岁年年意不同”.试题的落脚点灵活多变,要想在此类试题的解答中拿到高分,必须储备铁及其化合物的基础知识并掌握一定的解题技巧.本文结合近年高考真题对铁及其化合物进行归纳总结,希望对一轮复习备考有所启发.
1 知识脉络及价态二维图
1.1 知识脉络图

图1
1.2 价态二维图
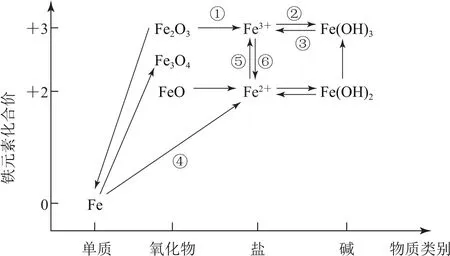
图2
2 重难点剖析
2.1 铁的制备
原料:铁矿石、焦炭、空气、石灰石;
设备:高温炉.
涉及的主要反应:① 还原剂的生成.
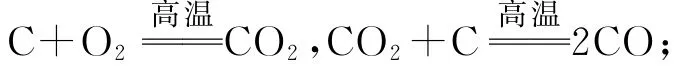
2.2 铁的化学性质
1)与非金属反应:如 O2、Cl2、S、I2等(由于氧化性弱,与S、I2反应得到二价铁).
2)与水蒸气在高温下反应:

3)与酸作用:如图3所示,反应类型如表1所示.
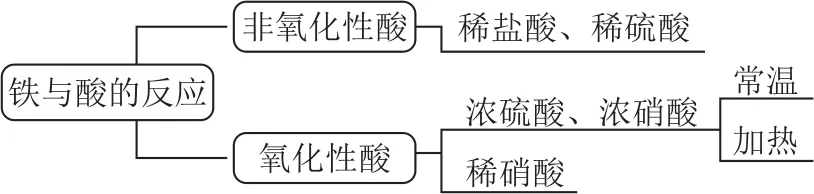
图3
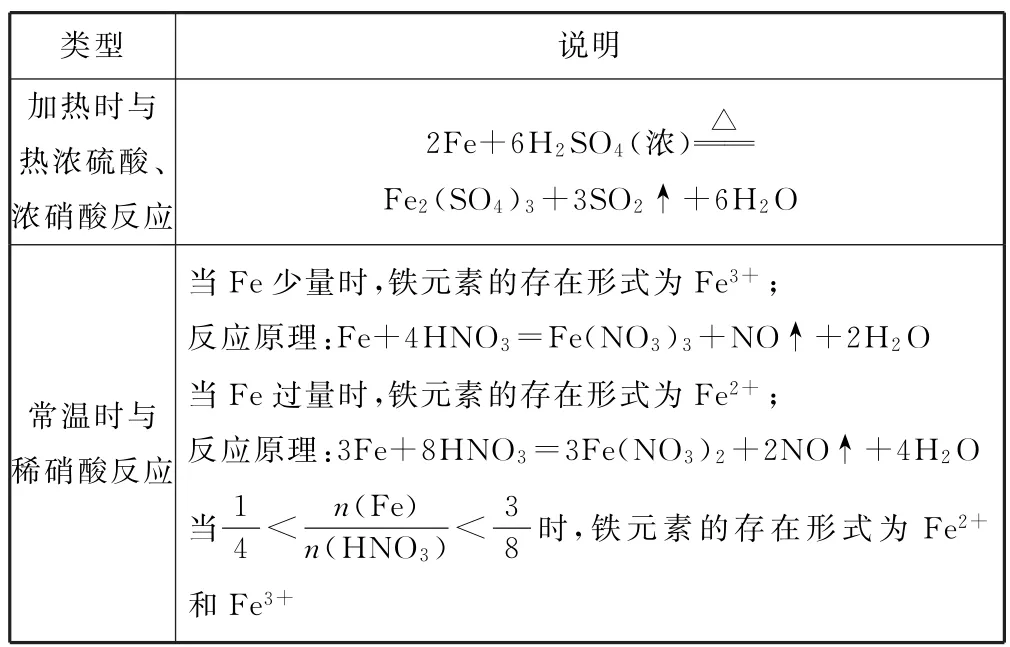
表1
2.3 铁的氧化物和氢氧化物
1)Fe O、Fe3O4与硝酸、浓硫酸等强氧化性酸发生氧化还原反应,且Fe2+被氧化为Fe3+.
2)Fe3O4不是碱性氧化物,但是纯净物.经研究证明,在Fe3O4晶体中有1/3的Fe是+2价,有2/3的Fe是+3价,可看成Fe O·Fe2O3,实际应写成Fe(Fe O2)2,即铁酸亚铁盐,不是一般的氧化物.
3)Fe(OH)2与硝酸反应,得到Fe3+,因为Fe2+具有较强的还原性,如遇硝酸就会被氧化为Fe3+:
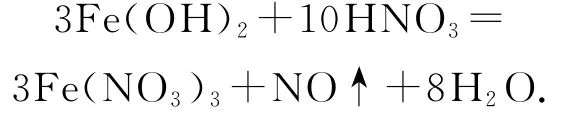
4)Fe(OH)3与盐酸反应发生中和反应:Fe(OH)3+3 HCl=Fe Cl3+3 H2O,而与 HI发生氧化还原反应:2 Fe(OH)3+6 HI=2 Fe I2+I2+6 H2O.Fe3+有较强的氧化性,遇到还原性酸(H2S、HI)发生氧化还原反应.
5)氢氧化亚铁的制备,如表2所示.
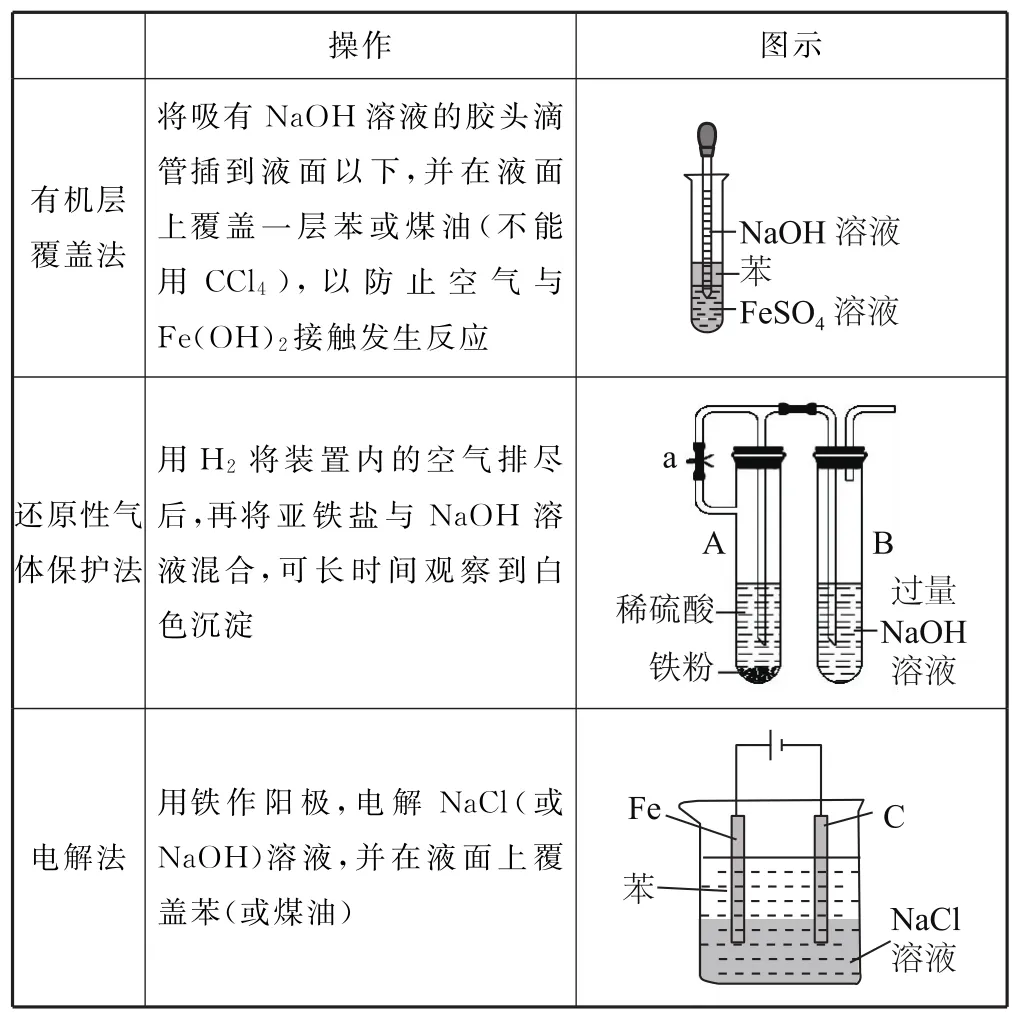
表2
2.4 铁盐(Fe3+)和亚铁盐(Fe2+)
高频考点及易错点,如表3所示.

表3
2.5 Fe2+和Fe3+的检验

表4
3 典例解析
3.1 铁及其化合物在离子方程式中的考查
例1(高考题组合)下列有关离子方程式的叙述正确的是( ).
A.(2019年天津卷·2 B)向沸水中滴加饱和氯化铁溶液得到红褐色液体:

B.(2020年全国卷Ⅲ·5 C)向H2O2溶液中滴加少量Fe Cl3:2 Fe3++H2O2=O2↑+2 H++2 Fe2+
C.(2020年浙江卷·13 A)(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:S+Ba2+=Ba SO4↓
D.(2019年新课标卷Ⅱ·11 D改编)向Mg(OH)2悬浊液中滴加足量Fe Cl3溶液出现红褐色沉淀:

解析
选项A得到的是胶体,不能写沉淀符号,离子方程式为Fe3++3 H2O=Fe(OH)3(胶体)+3 H+,错误;向 H2O2中滴加少量的Fe Cl3,Fe3+不能氧化H2O2,可以催化H2O2发生分解,离子方程式应为2 H2O2=2 H2O+O2↑,选项B错误;OH-先与Fe2+反应,再和NH+4反应,由于Ba(OH)2较少,NH+4不会参与反应,离子方程式为:Fe2++S+Ba2++2 OH-=Fe(OH)2↓+Ba SO4↓,选项C错误;Fe(OH)3的Ksp小于 Mg(OH)2,滴加足量Fe Cl3溶液,可转化为Fe(OH)3红褐色沉淀,选项D正确.答案为D.
3.2 电化学腐蚀的考查
例2(2020年江苏卷11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀.在如图4所示的情境中,下列有关说法正确的是( ).
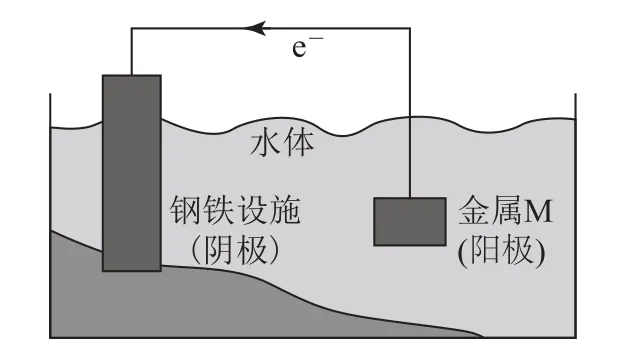
图4
A.阴极的电极反应式为Fe-2 e-=Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
解析
发生还原反应的一极叫阴极,原电池的正极也可以说是阴极,该电极反应式为2 H2O+2 e-=H2↑+2 OH-,选项A错误;金属 M的活泼性比Fe的活泼性强才能保护铁,选项B错误;当铁管作原电池的正极时被保护,将导线与金属M相连,M作负极,失去的电子沿导线进入铁设施表面,钢铁设施表面累积大量电子而被保护,选项C正确;海水中有大量的盐溶解,更容易腐蚀,选项D错误.答案为C.
点评
本题考查金属腐蚀与防护,掌握原电池原理、构成条件、原电池正负极上发生的反应是解题关键,析氢腐蚀和吸氧腐蚀的区别如表5.

表5
3.3 在基础实验中的考查
例3(高考题组合)下列实验操作和现象不能得出相应结论或目的的是( ).
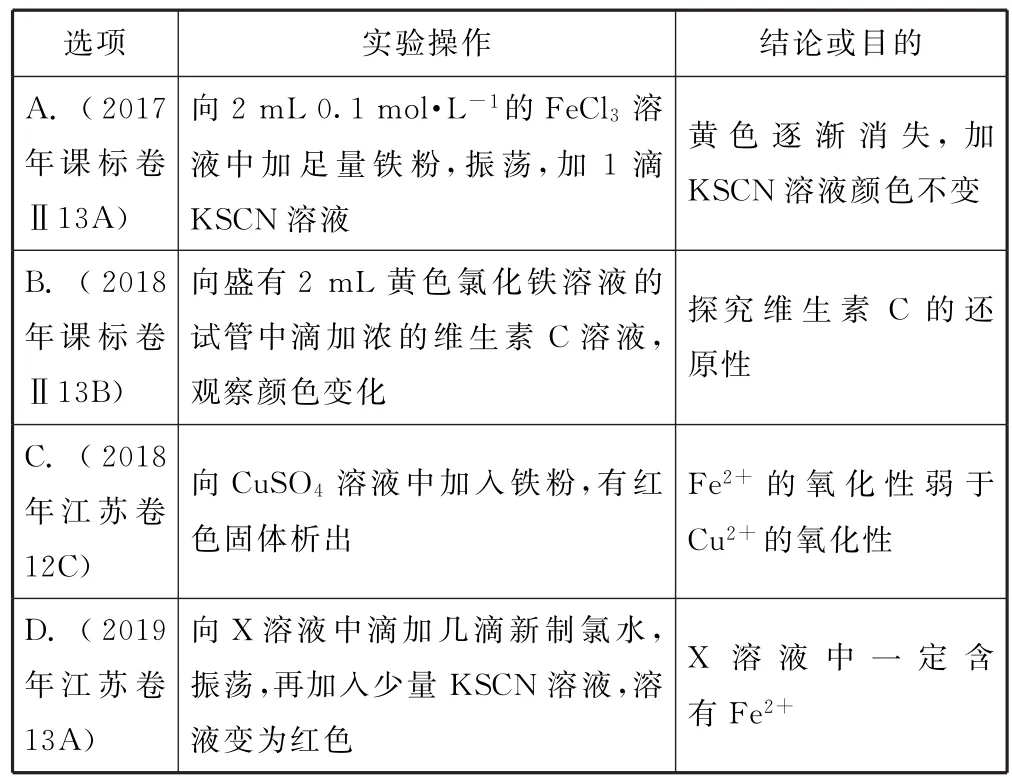
选项实验操作结论或目的A.(2017年课标卷Ⅱ13 A)向2m L0.1mol·L-1的Fe Cl3 溶液中加足量铁粉,振荡,加1滴KSCN溶液黄色逐渐消失,加KSCN溶液颜色不变B.(2018年课标卷Ⅱ13 B)向盛有2m L黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化探究维生素C的还原性C.(2018年江苏卷12 C)向Cu SO4溶液中加入铁粉,有红色固体析出Fe2+的氧化性弱于Cu2+的氧化性D.(2019年江苏卷13 A)向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色X溶液中一定含有Fe2+
解析
2 Fe3++Fe=3 Fe2+,黄色逐渐消失,加KSCN溶液颜色不变,选项A正确;氯化铁与维生素C发生氧化还原反应,生成Fe2+,导致溶液由黄色变为浅绿色,选项B正确;Cu2++Fe=Cu+Fe2+,该反应中氧化剂是Cu2+、氧化产物是Fe2+,则氧化性:Fe2+<Cu2+,选项C正确;检验Fe2+时应该先加KSCN溶液后加氯水,防止Fe3+的干扰,选项D错误.答案为D.
点评
本题考查化学实验方案评价,侧重考查学生实验分析和评价能力,明确实验原理、物质性质是解本题的关键.
3.4 水解平衡中的考查
例4(2015年天津卷,节选)Fe Cl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比Fe Cl3高效,且腐蚀性小.请回答下列问题:
(1)Fe Cl3在溶液中分三步水解:

以上水解反应的平衡常数K1、K2、K3由大到小的顺序是________.
(2)通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为xFe3++yH2O⇌Fex(OH)y(3x-y)++yH+.欲使平衡正向移动可采用的方法是(填序号)_______.
A.降温 B.加水稀释
C.加入NH4Cl D.加入Na HCO3
(3)室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是________.
解析
(1)Fe3+的水解分为三步,且水解程度逐渐减弱,水解平衡常数逐渐减小,故K1>K2>K3.(2)水解是吸热反应,降温时平衡逆向移动,选项A错误;加水稀释,平衡正向移动,选项B正确;加入NH4Cl,强酸弱碱盐显酸性,增加了H+浓度,平衡逆向移动,选项C错误;加入Na HCO3,强碱弱酸盐显碱性,降低H+浓度,平衡正向移动,选项D正确,答案为B、D.(3)从离子方程式知,H+浓度影响高浓度聚合氯化铁的生成,故关键步骤是调节溶液的p H.
3.5 物质结构选考题中的考查
例5(高考题组合)(1)(2019年新课标卷Ⅲ35)Fe Cl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在的Fe Cl3的结构式为________,其中Fe的配位数为.
(2)(2019年新课标卷Ⅱ35)Fe成为阳离子时首先失去________轨道电子.
(3)(2018年新课标卷Ⅱ35)基态Fe原子价层电子的电子排布图(轨道表达式)为________;Fe S2晶体的晶胞如图5所示,晶胞边长为anm,Fe S2相对分子质量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____g·cm-3;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为____nm.

图5
解析
(1)Fe Cl3为共价化合物,蒸气状态下以双聚分子存在的Fe Cl3的结构式为,Fe原子周围有4个Cl原子,则Fe的配位数为4.(2)铁为26号元素,价层电子排布为3 d64 s2,所以成为阳离子时,首先失去的是4 s上的电子.(3)基态Fe原子的核外价电子排布式为[Ar]3 d64 S2,基态Fe原子价层电子为3 d、4 s能级上电子,则核外价电子排布为;由此可得,每个Fe S2晶体的晶胞含有

结合题意晶胞边长为anm、Fe S2相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为

晶胞中Fe2+位于所形成的正八面体的体心,易得正八面体的边长为相邻两个面心的距离
点评
本题以铁为载体,考查物质结构,难点是(3)中晶体密度的计算,可建立模型,假设1个晶胞中含有n个微粒,则1mol该晶胞中含有nmol微粒,其质量为n×Mg;如果1个晶胞的质量为ρ×a3g(a3为晶胞的体积,单位为cm3),则1mol晶胞的质量为ρ×a3×NAg,因此对于立方晶胞,各物理量间的关系为
3.6 化学综合实验中的考查
例6(2020年全国卷Ⅰ)为验证不同化合价铁的氧化还原能力,利用图6所示的电池装置进行实验.

图6
回答下列问题:
(1)由 Fe SO4·7 H2O 固体配制0.10 mol·L-1Fe SO4溶液,需要的仪器有药匙、玻璃棒、________(从图7中选择,写出名称).

图7
(2)电池装置中,盐桥连接两电极电解质溶液.盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电子迁移率(u∞)应尽可能地相近.根据表6中的数据,盐桥中应选择________作为电解质.
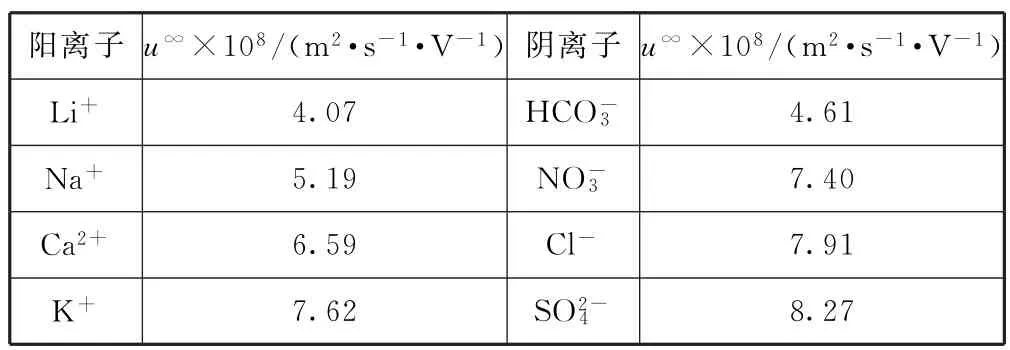
表6
(3)电流表显示电子由铁电极流向石墨电极.可知,盐桥中的阳离子进入________电极溶液中.
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02mol·L-1.石墨电极上未见Fe析出.可知,石墨电极溶液中c(Fe2+)=______.
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为______,铁电极的电极反应式为______.因此,验证了Fe2+氧化性小于,还原性小于.
(6)实验前需要对铁电极表面活化.在Fe SO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化.检验活化反应完成的方法是_______.
解析
(1)配制溶液的步骤为计算、称量、溶解并冷却至室温、移液、洗涤、定容、摇匀、装瓶、贴标签,由 Fe SO4·7 H2O 固体配制 0.10 mol·L-1Fe SO4溶液需要的仪器有药匙、托盘天平、合适的量筒、烧杯、玻璃棒、合适的容量瓶、胶头滴管.(2)Fe2+、Fe3+能与HCO-3反应,Ca2+能与S反应,Fe SO4、Fe2(SO4)3都属于强酸弱碱盐,水溶液呈酸性,酸性条件下NO-3能与Fe2+反应,根据题意“盐桥中阴、阳离子不与溶液中的物质发生化学反应”,盐桥中阴离子不可以选择HCO-3、NO-3,阳离子不可以选择Ca2+,另盐桥中阴、阳离子的电子迁移率(u∞)应尽可能地相近,根据表中数据,盐桥中应选择KCl作为电解质.(3)电流表显示电子由铁电极流向石墨电极,则铁电极为负极,石墨电极为正极,盐桥中阳离子向正极移动,进入石墨电极溶液中.(4)根据(3)的分析,铁电极的电极反应式为Fe-2 e-=Fe2+,石墨电极上未见Fe析出,石墨电极的电极反应式为Fe3++e-=Fe2+,电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02mol·L-1,根据得失电子守恒,石墨电极溶液中c(Fe2+)增加0.04mol·L-1,石墨电极溶液中c(Fe2+)=0.05 mol·L-1+0.04 mol·L-1=0.09mol·L-1.(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为Fe3++e-=Fe2+,铁电极的电极反应式为Fe-2 e-=Fe2+;电池总反应为Fe+2 Fe3+=3 Fe2+,根据同一反应中,氧化剂的氧化性强于氧化产物、还原剂的还原性强于还原产物,则验证了Fe2+氧化性小于Fe3+,还原性小于Fe.(6)在Fe SO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化,发生的反应为Fe+Fe2(SO4)3=3 Fe SO4,要检验活化反应是否完成,只要检验出溶液中不含Fe3+即可,方法是:取活化后溶液少许于试管中,加入KSCN溶液,若溶液不出现血红色,说明活化反应完成.
点评
本题考查铁的价态不同时,氧化还原能力的强弱,难点是第(2)问盐桥中电解质的选择和第(6)问实验方法的设计,侧重考查学生提取信息的能力以及利用信息解决问题的能力.

