ε-聚赖氨酸对大肠杆菌的抑菌机制
王梓源,李欣颖,吕俊阁,付萍,孙雪文,李雪晶,谭之磊,贾士儒
(天津科技大学 生物工程学院,食品营养与安全国家重点实验室,天津,300457)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)作为一种天然防腐剂具有广谱抑菌性,已被广泛应用于食品、医药、电子工业中[1]。但是目前国内对ε-PL的研究多集中于ε-PL高产菌株的选育[2-3]与应用[4-5]方面,对其详细的抑菌机理了解有限,并且已有大部分报道是关于ε-PL对革兰氏阳性菌和酵母的抑菌机制研究。LIN等[1]研究发现,ε-PL所带正电荷可中和单增李斯特菌细胞表面的负电荷,增加细胞膜透性,从而破坏细胞膜结构。BO等[6-7]研究了ε-PL对酿酒酵母细胞的抑菌机理,发现抑菌和杀菌机制均与ε-PL浓度有关:当ε-PL浓度达到阈值浓度时,以毡毯模型的作用方式迅速作用于酿酒酵母细胞膜,使磷脂双层弯曲穿孔,最终导致细胞死亡;当其浓度低于阈值水平时,可增加细胞膜通透性,改变细胞膜结构,破坏细胞膜功能,从而导致细胞内中心碳代谢被抑制。程雅文[8]发现,亚致死浓度的ε-PL可诱导酿酒酵母细胞中的活性氧迸发,使细胞进入凋亡早期阶段;致死浓度的ε-PL能使细胞进入凋亡后期阶段直至死亡。
而关于ε-PL对革兰氏阴性菌的抑菌机理鲜少报道,大肠杆菌(Escherichiacoli)是人和多数动物体内常见的肠道共生革兰氏阴性菌[9],且广泛存在于动植物产品中[10-11],肉制品在加工过程中极易受到E.coli污染,从而引发食源性疾病[12]。不同的大肠杆菌菌株和不同生长状态的同一菌株对ε-PL的耐受性不同。ZHANG等[13]研究了ε-PL对E.coliO157∶H7的抑菌作用,认为低剂量(质量浓度16 μg/mL)ε-PL能够破坏O157∶H7细胞膜的完整性和通透性,从而起到抑菌作用。但对于某些大肠杆菌,此剂量的ε-PL并无抑菌效果,需要使用高剂量(质量浓度≥50 μg/mL)防腐剂[14]。E.coliTUST006是本课题组从腐败食品中分离出的菌株,相比于其他E.coli在食品防腐领域中的应用更具研究价值。因此,本文以E.coliTUST006作为模式菌株,取处于对数生长期、生长旺盛的菌体为研究对象,通过抑菌实验探究高剂量ε-PL对E.coliTUST006的抑菌作用。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
E.coliTUST006(下文统一简写为E.coli),天津科技大学生化工程研究室。
1.1.2 主要试剂
邻硝基苯-β-D-半乳吡喃糖苷(2-nitrophenyl-β-D-galactopyranoside, ONPG)(分析纯)、N-苯基-1-萘胺(N-phenyl-1-naphthylamine, NPN)(分析纯),生工生物工程(上海)股份有限公司;酵母粉(分析纯),英国OXOID;胰蛋白胨(分析纯)、NaCl(分析纯)、NaOH(分析纯)、戊二醇(色谱纯),天津市化学试剂一厂;ε-PL(纯度≥ 99%),浙江新银象生物技术有限公司;其他试剂均为市售分析纯。
1.1.3 培养基及相关溶液
LB液体培养基:胰蛋白胨10 g/L,酵母粉5 g/L和NaCl 10 g/L,5 mol/L的NaOH溶液调pH至7.0~7.2。LB固体培养基在液体培养基的基础上加入1.0%~2.0%的琼脂。所有培养基均121 ℃,1×105Pa灭菌20 min。
磷酸缓冲盐溶液(phosphate buffer saline,PBS):KH2PO40.24 g/L,Na2HPO41.44 g/L,NaCl 8 g/L,KCl 0.2 g/L,浓HCl调pH至7.4。
PUM(phosphate-urea-magnesium)缓冲液:K2HPO4·3H2O 22.2 g/L,KH2PO47.26 g/L,MgSO40.2 g/L,尿素1.8 g/L,浓HCl调pH至7.1。
1.2 仪器与设备
紫外可见分光光度计(U mini-1240),日本SHIMADZU公司;电导率仪(FE30),瑞士METTLER TOLEDO公司;扫描电子显微镜(SU1510),日本日立公司;激光粒径测定仪(BI-90Plus),美国BROOKHA EN仪器设备公司;荧光分光光度计(F-7000),日本Hitachi公司。
1.3 实验方法
1.3.1 指示菌的活化
取一环斜面培养保存的E.coli接种于100 mL LB液体培养基中,37 ℃、180 r/min振荡培养12 h后,将培养液转接到100 mL新鲜LB液体培养基中,使初始细胞密度OD600为0.02,37 ℃、180 r/min振荡培养至OD600为0.2,备用。
1.3.2 抑菌曲线的测定
将不同质量浓度的ε-PL溶液分别加入到活化的E.coli菌液中,使ε-PL终质量浓度分别为0、50、100、150、200和250 μg/mL。继续培养10 h,每间隔1 h测定E.coli细胞OD600值,取3次测量值的平均值绘制抑菌曲线。
1.3.3 细胞存活率的测定
将不同质量浓度的ε-PL溶液分别加到活化的E.coli菌液中,使ε-PL终质量浓度分别为0、50、100和150 μg/mL,继续培养,并在2和4 h取一定量的菌液,采用稀释涂布平板法,计算菌落数,每组设3个平行。按公式(1)计算E.coli细胞存活率:

(1)
1.3.4 ε-PL对E.coli细胞表面疏水性的影响
采用微生物黏着碳氢化合物法测定E.coli细胞的表面疏水性[15]。将E.coli培养至对数期,4 000 r/min离心5 min收集细胞,用PUM缓冲液洗涤并重悬,使菌悬液OD600值为0.5。取3 mL菌悬液分别加入等体积的质量浓度为100、200和300 μg/mL的ε-PL溶液,对照组加入3 mL PUM缓冲液,37 ℃水浴培养,在培养的第2和4 h取样,首先测定菌液的OD600,再取3 mL上述菌液与400 μL十六烷混合,旋涡振荡1 min,静置15 min,取下层水相,用分光光度计测其OD600,每组实验设3个平行。按公式(2)计算细菌表面疏水率:

(2)
1.3.5 ε-PL对E.coli菌悬液电导率的影响
取适量指示菌,参考KONG等[16]的方法并稍作改进,测定E.coli菌悬液的电导率值,从而确定金属离子渗出变化趋势。将E.coli培养至对数期,4 000 r/min离心5 min收集菌体细胞,用质量浓度为50 g/L的葡萄糖溶液洗涤并重悬。将上述菌悬液在沸水浴中处理5 min,测得的电导率计为σ0;分别将不同质量浓度的ε-PL溶液与等体积的质量浓度为50 g/L葡萄糖溶液或上述菌悬液混合,使ε-PL的终质量浓度为50、100和150 μg/mL,37 ℃水浴摇床培养,测得的电导率分别计为σ1、σ2。各组实验设3个平行。按公式(3)计算混合体系的相对电导率:

(3)
1.3.6E.coli内膜通透性的测定
以ONPG为反应底物测定β-半乳糖苷酶活性变化,能够反映ε-PL对E.coli内膜通透性的影响。使用含有20 g/L乳糖的LB培养基培养E.coli,4 000 r/min离心10 min收集细胞,重悬于5 g/L NaCl溶液中,使菌悬液OD600值为0.4,如未特殊说明,以下实验所用菌悬液获得方法均与上述相同。将1.5 mL不同质量浓度的ε-PL与1.5 mLE.coli菌悬液、150 μL 30 mmol/L ONPG溶液混合后,立即测定体系在420 nm波长处的吸光值。在第60、90和120 min各记录1次数据,各组实验设3个平行。
1.3.7E.coli外膜通透性的测定
采用NPN法测定ε-PL对E.coli细胞外膜通透性的影响[17]。分别取1.5 mL质量浓度为0、50、100和150 μg/mL的ε-PL溶液与20 μL 1 mmol/L的NPN溶液混合,用荧光分光光度计分别在激发波长350 nm、发射波长420 nm下检测其荧光强度,然后在上述溶液中加入1.5 mL菌悬液再次检测其荧光强度,直至荧光强度不再增加,2次所测荧光强度之差即为相对荧光强度,各组实验设3个平行。
1.3.8 细菌菌体紫外吸收物的渗透检测
分别取1.5 mL菌悬液加入等体积不同质量浓度的ε-PL,对照组加入等体积蒸馏水,使得ε-PL终质量浓度达到50、100和150 μg/mL。以加入ε-PL为起点,分别在培养的第2和4 h用紫外分光光度计测量菌悬液在260和280 nm波长处的吸光值,各组实验设3个平行。
1.3.9 扫描电镜观察E.coli细胞形态
参考SHIMADA等[18]方法,将收集的菌体用9 g/L NaCl溶液洗涤,重悬于体积分数2.5%戊二醛溶液中,于4 ℃冰箱静置4 h。4 000 r/min离心5 min,弃上清液,沉淀分别用体积分数30%、50%、70%和90%的乙醇进行梯度脱水5 min,最后用纯乙醇重悬。取一定量适宜浓度的样品滴加到盖破片上,晾干。用导电胶将样品粘贴在金属样品台上,真空镀膜,使用扫描电镜(scanning electron microscope,SEM)观察。
1.3.10 ε-PL对E.coli菌体聚集程度的分析
将E.coli培养至对数期,加入ε-PL溶液,使其终质量浓度分别为0、50、100和150 μg/mL,以加入ε-PL的时间为零点,分别在2和4 h取样,使用粒径分布仪测定菌体粒径。
2 结果与分析
2.1 不同质量浓度的ε-PL对E. coli的抑菌曲线
由图1可知,对照组E.coli在延滞期后,快速生长,而ε-PL可抑制E.coli生长,且这种作用呈浓度依赖性,抑制效果与ε-PL质量浓度呈正相关。质量浓度100 μg/mL的ε-PL就能够有效抑制E.coli生长,至培养终点OD600约为对照组的一半,而ε-PL质量浓度≥150 μg/mL时,OD600几乎没有增长,实验中的菌液也接近澄清,说明此时ε-PL几乎能够完全抑制E.coli生长。这表明ε-PL发挥抑菌作用需要一定的阈值浓度。
2.2 ε-PL对E. coli存活率的影响
由图2可知,ε-PL可以明显降低E.coli的存活率,且这种效果与ε-PL的质量浓度和作用时间呈正相关。经50 μg/mL ε-PL处理2 h后,E.coli的细胞存活率为47.98%,随着时间延长,其存活率进一步降低;经100、150 μg/mL ε-PL处理2 h后,E.coli存活率分别下降至37.19%和14.88%,作用4 h后E.coli的细胞存活率分别为21.18%和5.61%,说明此时150 μg/mL ε-PL几乎能够完全抑制E.coli生长,此结论与抑菌曲线结果一致。

图1 ε-PL对E. coli的抑菌曲线Fig.1 The time-kill cur e of ε-PL against E. coli

图2 ε-PL对E. coli存活率的影响Fig.2 The effect of ε-PL on the sur i al rate of E. coli
2.3 ε-PL对E. coli细胞表面疏水性的影响
ε-PL对E.coli细胞表面疏水性的影响如图3所示,与空白对照组相比,经ε-PL处理后,E.coli细胞表面疏水性明显上升。质量浓度50、100和150 μg/mL的ε-PL作用2 h后,细胞疏水率分别为17.1%、20.3%和34.1%;作用4 h后,疏水率分别为11.4%、7.5%和23.5%。以上结果说明,ε-PL能够明显增大E.coli细胞表面疏水性。此细胞表面疏水性增大的现象与薄涛等[19]研究结果一致。这可能是因为E.coli表面疏水性与细胞壁中脂多糖含量密切相关,细胞壁中的脂多糖含量越低,E.coli细胞表面疏水性越强。而ε-PL带有正电荷,可与E.coli外膜上带负电荷的脂多糖通过静电作用相结合,破坏脂多糖的结构,因此导致E.coli细胞表面疏水性增大。
2.4 ε-PL对E. coli菌悬液电导率的影响
当微生物细胞处于不利环境中,其生物膜流动性降低,半透性丧失,胞内的K+、Na+等电解质大量外泄,导致菌悬液体系电导率升高。因此,通过检测菌悬液的电导率来推测细胞受损情况。结果如图4所示,ε-PL处理后E.coli菌悬液的电导率明显增大,特别是经150 μg/mL ε-PL处理4 h后,E.coli菌悬液的电导率远高于未经处理的对照组。说明菌悬液电导率增大的现象随着ε-PL质量浓度升高而愈发明显。此现象与何静如等[20]研究的(-)-β-蒎烯对沙门氏菌菌液电导率影响的结果较为类似。这可能是由于在ε-PL的作用下,E.coli细胞膜流动性降低,原生质外泄,导致E.coli胞内稳态被破坏,进而起到抑菌作用。

图3 ε-PL对E. coli细胞表面疏水性的影响Fig.3 The effect of ε-PL on the cell surface hydrophobicity of E. coli

图4 ε-PL对E. coli菌悬液电导率的影响Fig.4 The effect of ε-PL on the relati e conducti ity of E. coli suspension
2.5 ε-PL对E. coli内膜通透性的影响
当E.coli内膜遭到破坏时,其胞内β-半乳糖苷酶会透过细胞质膜泄漏出来,检测β-半乳糖苷酶含量变化可以推测E.coli内膜通透性的变化[21]。如图5所示,在ε-PL作用下,E.coli菌悬液在420 nm波长处的吸光值与对照组相比明显增大,说明ε-PL作用下E.coli胞内β-半乳糖苷酶大量泄漏,即ε-PL能够破坏E.coli细胞膜,最终导致E.coli生长受到抑制直至死亡。此结论与蒋佳佳等[21]研究的氧化石墨烯纳米银复合材料对E.coli细胞内膜的影响结果相似。
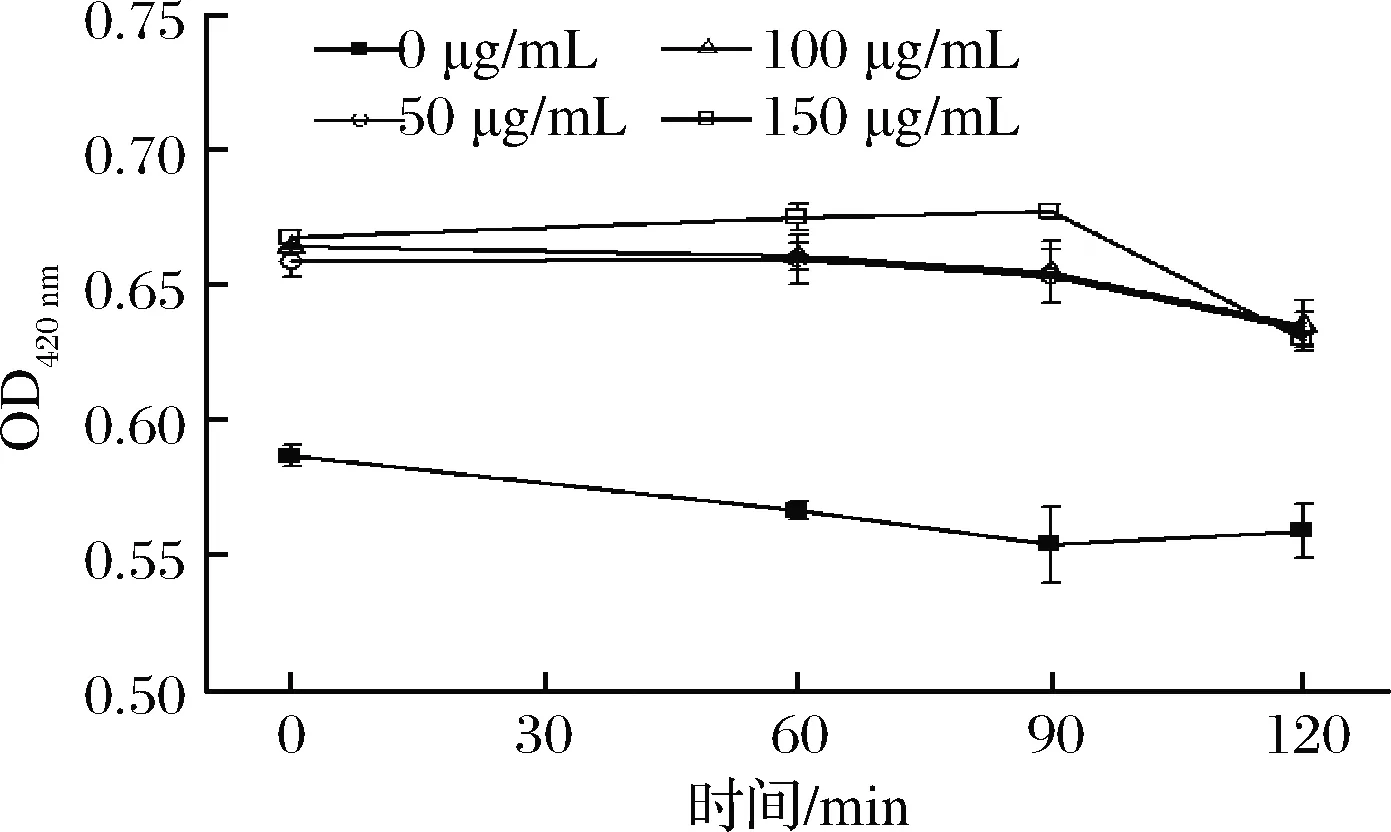
图5 ε-PL对E. coli内膜透性的影响Fig.5 The effect of ε-PL on the inner membrane penetrating acti ity of E. coli
2.6 ε-PL对E. coli外膜透性的影响
菌悬液荧光强度与E.coli外膜被破坏程度呈正相关,如图6所示,对照组菌悬液的荧光强度随时间无明显变化,一直维持在较低水平,而经不同质量浓度ε-PL处理后的实验组菌悬液荧光吸收值,在20~40 min内迅速增加,在40 min后趋于平缓。并且,随着ε-PL质量浓度升高,菌悬液的荧光强度进一步增加。说明ε-PL对E.coli细胞外膜具有破坏作用,且破坏作用与ε-PL质量浓度呈正相关。E.coli外膜渗透性也与脂多糖结构有着密切联系[22],因此,ε-PL对E.coli细胞外膜破坏作用的原因与ε-PL使E.coli细胞表面疏水性增大的原因是一致的,即ε-PL同E.coli表面的脂多糖通过静电作用结合,改变或破坏E.coli的外膜结构,最终造成E.coli死亡。

图6 ε-PL对E. coli外膜透性的影响Fig.6 The effect of ε-PL on the outer membrane penetrating acti ity of E. coli
2.7 细菌菌体紫外吸收物的渗透检测
核酸、蛋白质等生物大分子贯穿于整个细胞膜和细胞质之中,是细胞的重要组成结构,E.coli细胞膜被破坏时,核酸、蛋白质等大分子物质就会泄漏到胞外[23]。据此,检测菌悬液在260和280 nm波长处吸光度的变化,能够了解细胞膜受损情况。由图7和图8可知,ε-PL可以促进E.coli核酸和胞内蛋白质释放,该实验结果进一步说明ε-PL能够破坏E.coli细胞膜,进而导致菌体的死亡,与ε-PL对E.coli细胞表面疏水率、内外膜透性实验结果一致。

图7 ε-PL对E. coli胞内核酸渗漏的影响Fig.7 The effect of ε-PL on the leakage of intracellular nucleic acid of E. coli
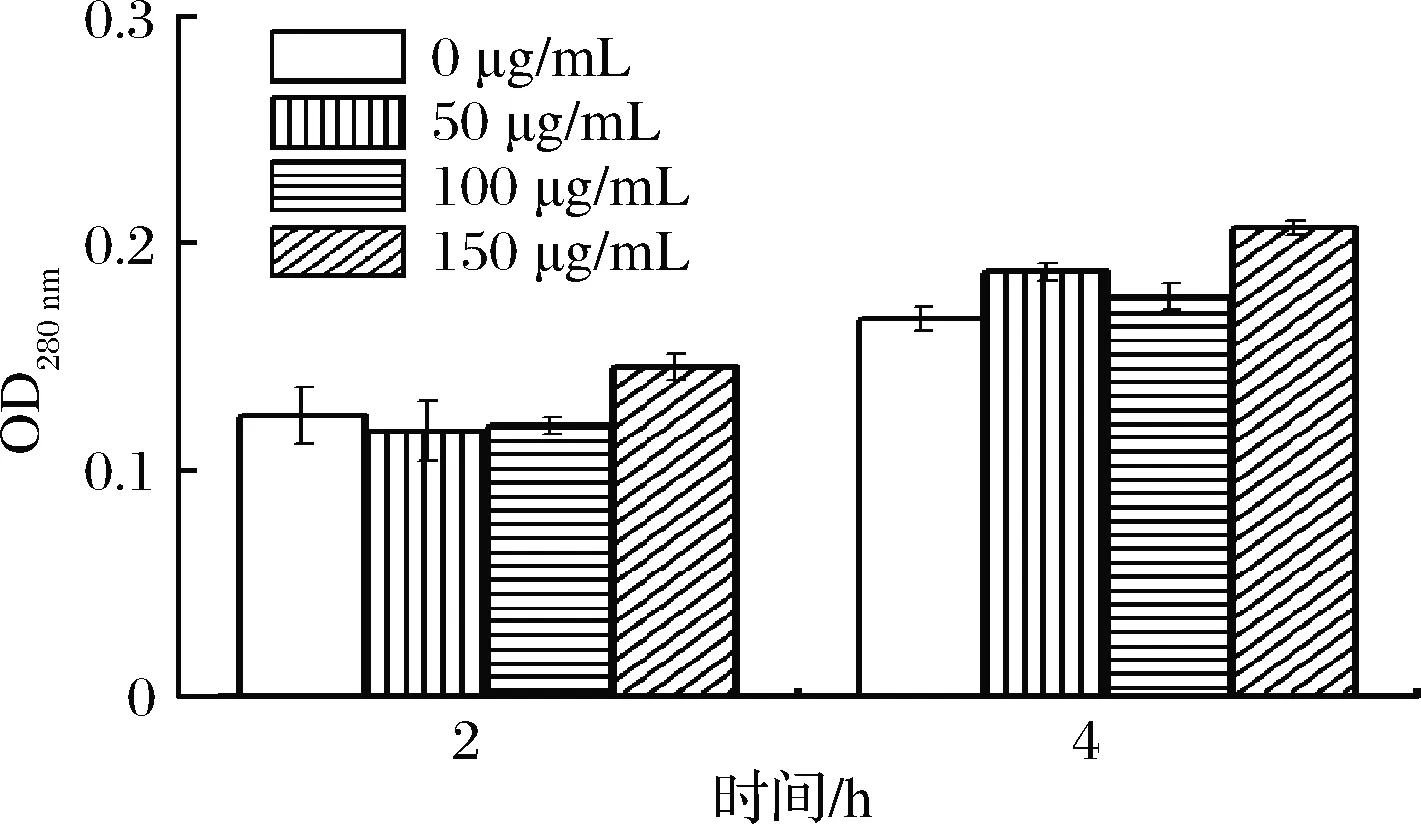
图8 ε-PL对E. coli胞内蛋白质渗漏的影响Fig.8 The effect of ε-PL on the leakage of intracellular protein of E. coli
2.8 SEM观察结果
如图9所示,未经ε-PL处理的E.coli细胞表面光滑、形态饱满,未有细胞破损现象(图9-a)。经50、100 μg/mL ε-PL处理2 h后E.coli细胞间出现明显的聚团黏连现象,部分细胞表面出现凹陷,凸起(图9-b和9-c),且随着ε-PL质量浓度升高,细胞表面变得粗糙皱缩、无饱满感,细胞间聚团黏连明显。上述质量浓度下的ε-PL处理4 h与2 h相比,细胞形态无明显变化。而经150 μg/mL ε-PL处理2 h后,菌体表面出现大量微胶粒(图9-d),4 h后大部分菌体破裂塌陷,出现大量孔洞(图9-h),此时E.coli可能已丧失生存能力。此结论说明ε-PL具有破坏E.coli细胞结构的作用,与上述细胞膜疏水性及渗透性、紫外吸收物的渗透实验结果一致。
目前,根据抗菌肽是否会对细胞膜的完整性造成损伤或能否进入细胞质中,将其分为细胞膜损伤机制和非膜损伤机制。在本研究中,SEM观察结果表明,ε-PL抑菌活性是通过膜损伤机制实现的。在膜损伤机制中,关于桶板模型、环孔机制模型和毡毯模型的研究较为成熟[24]。在桶板模型中,抗菌肽是在不引起磷脂双分子层弯曲的情况下直接插入细胞膜内,并通过抗菌肽分子间的疏水区域接触细胞膜并与之作用[25]。而在环孔机制模型中抗菌肽虽然会使磷脂双分子层弯曲,但不会产生微胶粒。毡毯模型中,抗菌肽通过静电作用与磷脂分子中的阴离子头部结合,像地毯般覆盖在细胞膜表面,当抗菌肽的浓度达到一定程度后,细胞膜上会出现瞬时的孔洞,使得抗菌肽进入到细胞膜内,并且随着磷脂双分子层的弯曲及受损,细胞膜逐渐分解,与抗菌肽共同形成微胶团[26-28]。

a-0 μg/mL ε-PL处理2 h; b-50 μg/mL ε-PL处理2 h; c-100 μg/mL ε-PL处理2 h; d-150 μg/mL ε-PL处理2 h; e-0 μg/mL ε-PL处理4 h; f-50 μg/mL ε-PL处理4 h; g-100 μg/mL ε-PL处理4 h; h-150 μg/mL ε-PL处理4 h图9 不同浓度ε-PL处理后E. coli的SEM图Fig.9 The effect of ε-PL on the morphology of E. coli by SEM
在本研究中,经ε-PL处理后的E.coli形态出现不同程度的变化,可以明显观察到细胞表面粗糙、菌体出现孔隙和微胶粒以及磷脂双分子层弯曲。因此,ε-PL对E.coli的抑菌作用可能是通过毡毯模型中所描述的机制实现的。
2.9 ε-PL对E. coli菌体聚集程度的影响
为进一步探究ε-PL处理后E.coli细胞间的黏连聚团现象,利用粒径仪测定菌悬液的菌团粒径。由图10可知,未经ε-PL处理的E.coli菌团粒径分布为0.5~1.5 μm(图10-b),与何国庆等[29]报道的E.coli菌体大小一致,说明菌体间相互均匀分散,几乎未发生聚团。而经50、100和150 μg/mL ε-PL处理后E.coli的菌团粒径分别为10~40 μm(图10-c)、40~80 μm(图10-d)和80~200 μm之间(图10-e),说明经ε-PL处理后E.coli菌团粒径明显大于未经ε-PL处理的对照组,并且其粒径随ε-PL质量浓度升高而增大,即ε-PL会使E.coli菌体发生团聚,该结果与SEM观察结果一致。

a-不同质量浓度ε-PL对E. coli菌悬液粒径的影响对比图;b-0 μg/mL的ε-PL处理2 h;c-50 μg/mL的ε-PL处理2 h;d-100 μg/mL的ε-PL处理2 h;e-150 μg/mL的ε-PL处理2 h图10 ε-PL对E.coli菌悬液粒径的影响Fig.10 Effect of ε-PL on the particle size of E.coli suspension
HYLDGAARD等[30]研究表明,对ε-PL更耐受的E.colirscC突变体荚膜外多糖、荚膜异多糖酸的过量表达,有助于调节菌体生物膜的三维结构,并起到一定的屏障保护作用。可推测本研究中ε-PL作用后E.coli菌体发生团聚,可能是因为E.coli受到ε-PL刺激后分泌大量黏性多糖以抵御ε-PL的破坏作用。另一方面, AARA等[31]发现,ε-PL可吸附在革兰氏阴性菌的细胞外膜上,破坏细胞膜结构,使膜脂多糖被释放。所以本研究中引起菌体团聚的物质也有可能是E.coli细胞膜遭到ε-PL破坏后,释放出来的脂多糖。此外,由于ε-PL是一种阳离子抗菌肽,本身带有一定的正电荷,而E.coli带有负电荷,因此,ε-PL还可能通过静电吸附作用使E.coli菌体相互黏连,即ε-PL作为一种黏连剂将菌体黏连在一起。
3 结论
本文以E.coli为模式菌株,通过一系列抑菌实验,揭示了ε-PL的抑菌机制。实验结果表明,ε-PL对E.coli的抑菌活性具有剂量依赖性,与ε-PL的质量浓度呈正相关,当ε-PL质量浓度达到100 μg/mL时,有明显抑菌效果。进一步研究表明,ε-PL能够增强E.coli细胞表面的疏水性、内膜及外膜的通透性,并且改变E.coli细胞膜内外电势,使得其细胞内容物如核酸、蛋白质等大量渗出。此外,SEM图显示ε-PL作用后E.coli细胞膜上出现孔洞、微胶团。上述结果说明ε-PL能够破坏E.coli的细胞结构,从而达到抑菌效果。ε-PL对E.coli的作用类似于抗菌肽抑菌机制中的毡毯模型所描述的模式,即ε-PL首先通过静电作用与细胞膜结合,铺满细胞膜表面,使E.coli细胞磷脂双分子层弯曲受损,细胞膜逐渐分解,细胞内物质如电解质、胞内核酸与蛋白质释放,进而导致菌体死亡。研究还发现,ε-PL处理后E.coli菌体会发生聚团黏连现象,且随ε-PL质量浓度升高,细胞团聚愈发明显。本文的研究结果对于ε-PL更好地应用于食品防腐领域具有一定指导价值,对ε-PL对其他微生物抑菌机制的研究也具有一定参考价值。

