复合诱变野生酵母ZZ-46选育高产油脂菌株
周秋利,顾喆,龙凌凤,郭书贤,刘汝宽,孙海彦,孙付保*
1(江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,江苏 无锡,214122) 2(南阳理工学院 生物与化学工程学院 河南省工业微生物资源与发酵技术重点实验室,河南 南阳,473004) 3(湖南省林业科学院 省部共建木本油料资源利用国家重点实验室,湖南 长沙,410004) 4(中国热带农业科学院 热带生物技术研究所海南省热带微生物资源重点实验室,海南 海口,571101)
微生物油脂又称单细胞油脂,是微生物在一定条件下产生并储存在细胞内的甘油酯,其脂肪酸组成与植物油脂类似,以C16和C18系脂肪酸为主,可以作为生产生物柴油的原料[1]。由于产油微生物具有发酵周期短、不受季节气候影响和碳源利用广等优点,在未来生物柴油产业的发展中发挥重要作用[2],具有良好的发展前景。细菌、酵母、霉菌和藻类都可以用来生产微生物油脂,其中以酵母和霉菌类真核微生物居多[3],一些产油酵母的油脂质量可以达到自身干重的80%[4]。
目前,微生物油脂的生产价格仍高于动植物油,主要是因为培养过程中碳源(主要是葡萄糖)成本占总成本的80%[5],因此要实现微生物油脂的大规模生产必须使用廉价的碳源。木质纤维素是世界上储量最大的可再生资源,充分水解后能得到含有葡萄糖和木糖等单糖的混合糖[6],是实现生物转化、生产生物产品的潜在重要原料。然而,大多数微生物具有葡萄糖效应,通常先消耗葡萄糖后利用其他戊糖,葡萄糖会抑制其他糖的利用[7],这种效应造成木糖资源浪费。因此,选育能同时利用葡萄糖和木糖混合糖的高产油脂酵母已经成为微生物油脂技术领域的重要研究方向。
传统诱变方法是实现菌株改良的有效方法之一[8],与单一诱变方法相比,物理化学复合诱变有更高的突变频率[9]。常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变育种技术是利用等离子体射流破坏细胞的DNA结构,使细胞启动自身的DNA修复机制,在此过程中会产生基因突变[10]。该技术产生的等离子体浓度高且均匀,具有突变率高、成本低、无污染和操作安全等优点,已被广泛应用于细菌、酵母和真菌等多种微生物育种[11],比如小球藻Chlorellaulgaris,ARTP诱变后选育出的高产菌株M1,其总脂含量提高了103.5%[12];酵母Candidatropicali,ARTP诱变后选育出的突变菌株T31,其木糖醇产量增加了22%[13]。硫酸二乙酯(diethyl sulfate,DES)是一种烷化剂,能够使部分碱基烷基化,从而改变DNA结构,常用于真核微生物的诱变育种[14]。袁超等[15]利用DES和紫外线进行物理化学复合诱变,筛选出1株高产糖化酶的菌株,其产酶能力提高了53%。综上所述,利用ARTP和DES复合诱变有望大大提高菌株的产油能力。此外,建立快速高效的筛选方法是选育高产菌株的关键。唐鑫等[16]利用脂肪酸合酶抑制剂浅蓝菌素和表征脂肪酸脱氢酶活性的氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)为筛选因子,筛选出高产花生四烯酸的高山被孢霉。金丽华等[17]基于尼罗红荧光染色测定油脂方法,利用96孔板高通量筛选手段获得经ARTP诱变的高产突变体。由此可以利用浅蓝菌素和TTC对突变菌株进行初筛,再利用尼罗红荧光染色和孔板培养进行高通量筛选。
因此,本文利用ARTP和DES诱变技术对可同时利用葡萄糖和木糖混合糖的野生油脂酵母TrichosporondermatisZZ-46进行复合诱变处理,以一定浓度的浅蓝菌素和TTC作为筛选因子对突变体进行初筛,再利用尼罗红荧光检测对初筛突变菌株进行高通量筛选,以期获得高产油脂酵母,为后续利用纤维素水解液发酵奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株
T.dermatisZZ-46, 南阳市工业微生物菌种保藏中心,菌株编号NICC 30027。
1.1.2 主要试剂
浅蓝菌素,Sigma公司;氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC),生工生物工程(上海)股份有限公司;其他试剂均为分析纯。
1.1.3 主要仪器
常压室温等离子体诱变仪ARTP-3,北京思清源生物科技有限公司;GC-2030AF气相色谱仪,日本岛津;Chromaster CM5110高效液相色谱仪,日本日立。
1.2 实验方法
1.2.1 培养基配制
YPD固体培养基(g/L):酵母提取物10、葡萄糖20、蛋白胨20,琼脂15~20,115 ℃ 灭菌20 min。
种子培养基(g/L):酵母提取物10、葡萄糖20、蛋白胨20,115 ℃ 灭菌20 min。
基础发酵培养基:葡萄糖46.67 g/L、木糖23.33 g/L、酵母提取物0.75 g/L、NH4Cl 0.1 g/L、Na2SO40.1 g/L、MgCl2·6H2O 1 g/L、KH2PO411.8 g/L、K2HPO4·3H2O 3.7 g/L、CaCl2·2H2O 40 mg/L、FeSO4·7H2O 5.5 mg/L、一水合柠檬酸 5.2 mg/L、ZnSO4·7H2O 1 mg/L、MnSO4·H2O 0.76 mg/L、18 mol H2SO41.84 μg/L,115 ℃ 灭菌20 min。
1.2.2 高效菌株筛选方法的建立
1.2.2.1 TTC和浅蓝菌素添加浓度的确定
将OD600 nm=1.0野生酵母ZZ-46菌悬液经适当梯度稀释后,取100 μL分别涂布于含有不同质量浓度TTC(0、1.67×10-2、4.17×10-2、6.67×10-2和9.17×10-2g/L)的YPD平板上,以及含有不同浓度浅蓝菌素(0、1.87×10-6、2.61×10-6、4.11×10-6mol/L)的YPD平板上,置于25 ℃恒温培养箱中培养2 d,根据菌落生长状况及颜色确定TTC和浅蓝菌素的最佳添加浓度。
1.2.2.2 平板初筛和高通量筛选
将诱变后的菌液涂布在含有筛选因子的平板上,25 ℃培养2 d,挑取大且红的单菌落到48孔板中(1.0 mL YPD培养基/孔),在25 ℃、200 r/min的摇床中培养,2 d后将100 μL的菌液移到96孔板,利用酶标仪检测OD600 nm表征细胞浓度。
每个孔板中再添加5 μL尼罗红溶液,混匀后避光染色5 min,用酶标仪检测荧光强度表征油脂产量。检测的发射波长和吸收波长分别为485和595 nm。荧光强度为测出的样品荧光强度减去没有加尼罗红的样品背景荧光强度。
1.2.2.3 发酵培养
挑取初筛得到的高产突变菌株单菌落接种于YPD种子培养基中,25 ℃,140 r/min培养36 h,按体积分数10%的接种量接种于50 mL基础发酵培养基中,25 ℃,140 r/min发酵7 d。发酵液离心收集菌体,测定菌体生物量、发酵液油脂产量以及菌体油脂含量。
1.2.3 菌株诱变方法
1.2.3.1 菌悬液的制备
保藏的菌株经活化后,挑取单菌落于YPD种子培养基中,25 ℃,140 r/min培养36 h,取1.0 mL菌液8 000 r/min离心5 min收集菌体,用无菌生理盐水洗涤3次,在涡旋仪上混匀,经过适当稀释,制备成OD600 nm=1.0的菌悬液。
1.2.3.2 ARTP诱变
按上述方法制备ZZ-46菌悬液,取10 μL于无菌金属载片上,将金属载片置于ARTP诱变仪操作室载物台的凹槽内,诱变条件:功率100 W,处理距离2 mm,气体流量10 min/L,处理时间分别为20、50、80、110、140和170 s。将经过ARTP处理过的样品适当稀释后涂布于YPD平板上25 ℃培养2 d,未经ARTP处理的菌液进行相同浓度稀释后涂布于平板,培养条件相同,以此作为对照,按公式(1)计算致死率:

100
(1)
1.2.3.3 DES诱变
通过ARTP诱变获得的高产突变菌株在斜面上活化,按照上述方法制备菌悬液2.0 mL,加入2.0 mL pH 7.0的磷酸缓冲液,再加入0.2 mL 50%硫酸二乙酯-乙醇溶液,25 ℃分别振荡10、30、50、70、90和110 min。每次处理后,向反应混合物中加入1.0 mL 250 g/L硫代硫酸钠溶液终止反应。将反应物稀释到适当浓度,取100 μL涂布于YPD平板,25 ℃培养2 d,以稀释倍数相同且未经处理的菌悬液为对照,计算致死率(公式同上)。
1.2.4 分析方法
生物量的测定和油脂的提取参照文献[18-19];脂肪酸组成分析参照文献[19-20];利用液相色谱仪测定葡萄糖和木糖含量参照文献[21]。
1.2.5 遗传稳定性分析
将诱变菌株在平板培养基上连续传代 7 次,再进行发酵培养,检测菌株的生物量和油脂产量,研究其遗传稳定性。
2 结果与分析
2.1 TTC和浅蓝菌素添加浓度的确定
TTC是一种氧化还原剂,溶于水时无色,当接受脱氢酶脱下来的H+时被还原成红色物质三苯基甲臢(triphenyl formazan,TF),其颜色越深则表示脂肪酸脱氢酶的活性越强,不饱和脂肪酸的含量就越高[22]。浅蓝菌素是一种抗真菌抗生素,可抑制脂肪酸合酶的活性,从而不可逆地抑制内源性脂肪酸的合成,阻碍菌体的正常生长[23]。因此,只有高活性脂肪酸合酶的酵母才能在一定浓度的浅蓝菌素平板上存活而被筛选出来。本实验将TTC和浅蓝菌素作为抗性筛选因子添加到固体YPD培养基中,采用1.2.2.1小节中的方法对TTC和浅蓝菌素添加浓度进行探究,结果如图1所示。

a-TTC;b-浅蓝菌素图1 不同浓度TTC和浅蓝菌素对ZZ-46的生长的影响Fig.1 Effects of different concentrations of TTC and cerulenin on the growth of ZZ-46
随着TTC添加质量浓度升高,菌落直径越来越小,红色也越来越浅。根据菌落颜色深浅以及生长状况,在保证TTC最佳染色浓度的同时,尽量减弱TTC对菌落的生长影响,最终确定TTC的添加质量浓度为1.67×10-2g/L。浅蓝菌素能抑制酵母ZZ-46生长,且随着浅蓝菌素浓度升高,菌落直径越来越小,酵母受到的抑制作用越强烈。当添加浅蓝菌素的浓度为4.11×10-6mol/L时,酵母ZZ-46生长受到明显抑制,较对照有显著差异,为了保证筛选效果,最终选取4.11×10-6mol/L作为浅蓝菌素的最佳添加浓度。
2.2 ARTP诱变及突变菌株的选育
诱变强度和时间都会影响细胞的致死率,适当的致死率才有利于菌株筛选。采用1.2.3.2小节的方法考察野生油脂酵母ZZ-46的诱变时间和致死率关系,结果如图2所示。
随着诱变时间延长,菌落的数量越来越少,致死率越来越高。当处理时间的140 s时,致死率达到96.1%,处理170 s时,致死率达到100%。由于ARTP诱变产生的突变具有随机性,致死率和正突变之间的关系并不明确,这主要取决于诱变方法和菌株自身特性[16]。因此,为了获得生存能力较强的菌株,本研究选择致死率超过95%的140 s为最佳诱变时间。

图2 野生油脂酵母ZZ-46的ARTP致死率曲线Fig.2 ARTP lethality cur e of wild oil yeast ZZ-46
将经过ARTP处理140 s后的酵母稀释到合适浓度并涂布到含有1.67×10-2g/L TTC和4.107×10-6mol/L浅蓝菌素的YPD平板上。按照1.2.2.2小节中的方法进行平板初筛和高通量筛选,测得各突变菌株的OD600 nm和荧光强度。如图3所示,表明原始菌株和诱变菌株的相对OD600 nm和荧光强度(培养48 h,原始菌株为1)。以荧光强度为指标,ZZ-46正突变率为43%,生物量总体相差不大。其中,有6株突变菌(G1、A4、C4、H4、B6和H6)的荧光强度是出发菌株的1.2倍以上,选择这6株菌进行摇瓶发酵培养复筛。

图3 ARTP诱变菌株的相对OD600 nm和荧光强度Fig.3 Relati e OD600 nm and fluorescence intensity of ARTP mutagenic strains
将诱变菌株G1、A4、C4、H4、B6和H6和野生菌株进行摇瓶发酵培养。发酵7 d后收集菌体,检测生物量、油脂产量。结果如图4所示,与野生菌相比,所筛选6株菌的油脂产量和油脂含量均有所提高,除B6、H6外,其他菌株的生物量都有所降低。综合生物量和油脂产量2个指标,B6较出发菌呈现出更大的优势,生物量和油脂产量分别达到21.75、10.31 g/L,较出发菌分别提高8.10%、20.0%。
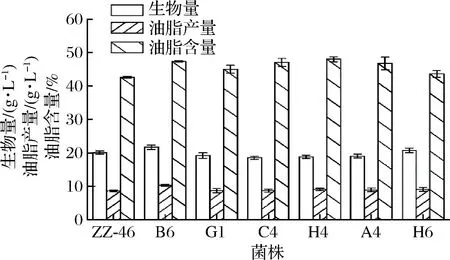
图4 ARTP诱变菌株的复筛结果Fig.4 Rescreening results of ARTP mutagenic strains
2.3 DES诱变及突变菌株的选育
采用1.2.3.3小节中的方法考察突变菌株B6的诱变时间和致死率关系,结果如图5所示。随着诱变时间延长,菌落数量越来越少,当诱变时间为70 min时,致死率为77%,诱变时间延长至90和110 min时,致死率分别为88.23%和95.23%。选择70%~80%的致死率作为诱变计量[24],故DES诱变时间选择70 min。
将DES处理70 min后的B6突变菌按上述方法进行平板初筛和高通量筛选,测得各突变株的OD600 nm和荧光强度。B6和诱变菌株的相对OD600 nm和荧光强度(培养48 h,B6菌株为1)如图6所示,正突变率不如ARTP诱变显著,与ARTP诱变相比,没有突变菌株的荧光强度增加20%。突变菌株L7和N7的荧光强度比出发菌B6增加10%左右,选择这2株菌进行发酵摇瓶复筛。

图5 突变菌株B6的DES致死率曲线Fig.5 DES lethality cur e of mutant strain B6

图6 DES诱变菌株的相对OD600 nm和荧光强度Fig.6 Relati e OD600 nm and fluorescence intensity of DES mutagenic strains
将突变菌株L7、N7和出发菌株B6进行摇瓶发酵培养。发酵7 d后收集菌体,检测生物量、油脂产量,结果如图7所示。

图7 DES诱变菌株的复筛结果Fig.7 Rescreening results of DES mutagenic strains
经过摇瓶复筛之后,突变菌L7呈现出最大的优势,其生物量、油脂产量和油脂含量分别达到22.66 g/L、11.44 g/L和50.49%,较突变菌B6分别提高4.18%、10.96%和3.09%,较野生型菌株ZZ-46分别提高12.62%、33.18%和7.8%。为了研究突变菌株的遗传稳定性,实验对菌株L7进行传代培养,第1代到第7代的生物量、油脂产量和油脂含量分别维持在22.6 g/L、11.5 g/L和50.7%左右,表明该菌株具有良好的遗传稳定性。
2.4 油脂脂肪酸组成
对野生菌株ZZ-46和突变菌株B6、L7所产油脂进行脂肪酸成分分析,结果如表1所示。诱变前后脂肪酸组成相同,主要是棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)和亚油酸(C18∶2),其中油酸含量最多、棕榈酸次之、硬脂酸和亚油酸含量接近,这4种脂肪酸占总脂肪酸的95%以上,与植物油的脂肪酸组成类似[25]。其中,L7与ZZ-46相比,不饱和脂肪酸亚油酸含量上升2.11%,这可能是因为突变菌株的脂肪酸脱氢酶活性更高,其余脂肪酸含量并没有发生太大变化,可以作为生产生物柴油的原料。
2.5 野生菌株ZZ-46和突变菌株L7利用混合糖的发酵曲线
木质纤维素完全水解后得到的葡萄糖和木糖能达到总糖的90%以上,且两者的质量比约为2∶1[18],因此选择葡萄糖∶木糖=2∶1(质量比)的初始碳源模拟纤维素水解液,总糖质量浓度保持70 g/L。考察野生菌株ZZ-46和突变菌株L7生长和积累油脂的情况,结果如图8所示。
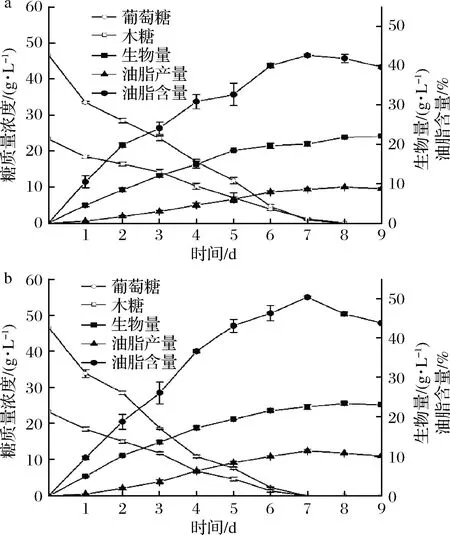
a-野生菌体ZZ-46; b-突变菌体L7图8 野生菌株ZZ-46和突变菌株L7的发酵曲线图Fig.8 Fermentation cur e of wild strain ZZ-46 and mutant strain L7

表1 野生菌株和突变菌株的脂肪酸组成及含量Table 1 Fatty acid composition and content of wild and mutant strains
由图8可知,ZZ-46和L7的油脂积累和菌体生长均是生长偶联型,且L7的生物量、油脂产量和油脂含量明显高于ZZ-46。在培养第7天时,两者油脂含量均达到最大,分别是42.67%和50.49%,继续培养后,虽然生物量有所增加,但是油脂产量和油脂含量均在下降,表明细胞在消耗完培养基中的碳源后,又开始消耗胞内油脂作为能量以维持细胞增殖。从葡萄糖和木糖的利用情况来看,ZZ-46和L7均能同时利用葡萄糖和木糖,葡萄糖的存在并不会抑制细胞对木糖的利用,克服了大多数微生物存在的葡萄糖效应,这可能是因为该菌株的2种糖转运蛋白具有相似的效率,或者存在对这2种糖具有相同亲和力的独特糖转运蛋白在此酵母中运行[25]。此外,L7比ZZ-46提前1 d消耗完混合糖,表明L7的糖耗速率和糖转化能力都显著高于野生菌株,可能是因为L7的脂肪酸合酶具有更高的活性。这些特性对利用纤维素水解液发酵、降低微生物油脂生产成本具有重要意义不少研究者探讨产油酵母利用混合糖积累油脂的能力。宋兆齐等[6]筛选获得1株油脂酵母JM-D,在葡萄糖∶木糖=3∶1质量浓度比混合糖条件下菌体油脂含量达到23.38%,油脂产量达到2.7 g/L;孔祥莉等[18]研究斯达氏油脂酵母L.starkeyi2#在葡萄糖∶木糖=23∶12质量浓度比混合糖条件下发酵积累油脂,生物量和油脂质量分数分别达到19.0 g/L和52.6%;HU等[25]利用T.cutaneumAS 2.571在葡萄糖∶木糖=47∶23质量浓度比混合糖条件下发酵积累油脂,生物量、油脂产量和油脂含量分别达到23.2 g/L、11.2 g/L和48.4%;YU等[26]利用T.dermatis32903在葡萄糖∶木糖=3∶1质量浓度比混合糖条件下发酵积累油脂,OD600 nm达到71.13,油脂产量达到11.48 g/L。
相比上述实验结果,在相同比例的混合糖中,L7具有较为突出的油脂积累能力,此外,L.starkeyi2#在发酵前期以利于葡萄糖为主,当葡萄糖质量浓度低于16 g/L时,木糖的消耗速率明显加快,高浓度葡萄糖阻碍了菌株对木糖的利用,并不能实现真正意义上的同步利用葡萄糖和木糖。T.dermatis32903虽然可以在初始浓度较高的糖中进行发酵,但是木糖的利用率仅为85.9%,且混合糖中木糖的比例不高,而L7可以完全利用发酵液中的木糖,不会造成木糖浪费,也不需要改变水解液中葡萄糖和木糖的比例。
3 结论
本文采用ARTP和DES复合诱变方法获得1株高产油脂酵母L7,其生物量、油脂产量和油脂含量较野生型菌株ZZ-46分别提高了12.62%、33.18%和7.8%,且具有良好的遗传稳定性,脂肪酸组成与植物油相似。该突变菌株L7具有同时消耗葡萄糖和木糖积累油脂的能力,具有利用木质纤维素水解液的潜力,为规模化生产微生物油脂提供可能。

