重组质粒pcDNA4-FLAG-GLUT1 构建及蛋白表达
徐子豪,史小雨,王倩
(天津医科大学基础医学院免疫学系,天津300070)
疟疾是由疟原虫(plasmodium)感染所引起的寄生虫疾病,通过雌性按蚊叮咬人体传播,在全球范围内仍有着较高的发病率和死亡率[1]。疟原虫在人体的寄生生活主要分为肝细胞期和红细胞期,其中以红细胞期引起的临床症状最为明显[2]。红细胞期疟原虫的能量来源主要依靠摄取宿主血液中的葡萄糖进行糖酵解[3]。葡萄糖依次通过红细胞膜表面葡萄糖转运蛋白(GLUT)1、包绕疟原虫的纳虫泡膜(parasitophorous vacuole membrane,PVM)和疟原虫质膜上的己糖转运蛋白(hexose transporter,HT),最终进入疟原虫体内[4]。由于无氧糖酵解产生ATP 效率低下,疟原虫需要摄取大量葡萄糖以维持正常生长[5]。
GLUT1 在人体内广泛存在,是红细胞和血-脑屏障中最主要的GLUT。有研究报道,对正常红细胞和感染恶性疟原虫(Plasmodium falciparum,P. falciparum)的红细胞进行磷酸化蛋白质组学分析,发现感染红细胞表面GLUT1 的磷酸化状态发生改变[6];在伯式疟原虫(Plasmodium berghei,P. berghei)感染的肝细胞阶段,肝细胞会上调细胞表面GLUT1 的表达量和转运效率以增加葡萄糖的摄取[7];而在人类遗传疾病GLUT1 缺陷综合征中,GLUT1 磷酸化状态的改变也会影响葡萄糖的正常吸收[8]。可见,GLUT1 的磷酸化水平对其在细胞表面的表达量及葡萄糖转运效率至关重要。
GLUT1 的磷酸化既可能引发胞浆内的GLUT1囊泡转位到细胞膜,又可能调控细胞表面GLUT1 的葡萄糖转运效率。而红细胞缺乏囊泡转运机制,只能通过调节GLUT1 转运葡萄糖的速率来调节葡萄糖的摄取[8]。为了探究感染红细胞GLUT1 磷酸化状态对葡萄糖吸收的影响,本实验室前期已经对正常和感染恶性疟原虫的红细胞膜蛋白进行质谱分析,找到一些与疟原虫感染相关的GLUT1 特异性磷酸化位点。由于红细胞无法进行基因转染,为了研究这些位点的磷酸化状态在疟原虫感染红细胞中的作用,本研究首先拟在其他细胞中检测这些位点的磷酸化对细胞表面GLUT1 表达量和转运葡萄糖效率的影响。为了尽量降低内源性GLUT1 对检测的影响,选择低表达GLUT1 的小鼠胚胎成纤维细胞系NIH/3T3 进行细胞表面GLUT1 表达水平的定量检测。GLUT1为12 次跨膜蛋白,直接用抗体检测GLUT1 的细胞外结构域灵敏度较低[9],且其N 端和C 端均朝向细胞质内。因此,为了更为准确地检测细胞表面GLUT1的表达水平,本研究首先通过分子克隆的方法,在人GLUT1 第一个胞外区中插入2×FLAG 序列,以pcDNATM4/TO/myc-His B 为载体,构建pcDNA4-2×FLAG-GLUT1,并将其导入NIH/3T3 细胞中,利用抗FLAG 抗体,即可定量检测细胞表面GLUT1 的表达水平,为后续探究疟原虫感染红细胞GLUT1 磷酸化位点的功能提供了必要的分子工具。
1 材料与方法
1.1 材料 细胞系、质粒和菌株小鼠胚胎成纤维细胞系NIH/3T3 于本实验室保存,哺乳动物细胞表达载体pcDNATM4/TO/myc-His B 由南开大学生命科学院胡俊杰课题组提供,感受态细胞Mach1-T1 购自北京博迈德基因技术有限公司。
1.2 主要试剂 限制性核酸内切酶BamHⅠ和HindⅢ购自美国NEB 公司,In-Fusion®HD Cloning试剂盒购自宝日医生物技术(北京)有限公司,质粒小提试剂盒和DNA 凝胶回收试剂盒购自全式金生物技术有限公司,质粒中提试剂盒购自Qiagen 公司;DMEM 培养基、LipofectaminTM2000 试剂盒购自美国Invitrogen 公司,胎牛血清(FBS)购自美国Gibco公司;用于流式的anti-DYKDDDDK,山羊抗兔IgG(PE-conjugated)抗体购自美国Cell Signaling Technology 公司,用于Western 印迹的anti-FLAG 抗体购自美国Sigma 公司。
1.3 实验方法
1.3.1 目的基因片段GLUT1-Ⅰ、GLUT1-Ⅱ和GLUT1-Ⅲ的获取 以人类GLUT1 基因编码区(1~1479 bp)为模板,在GLUT1 的第一个胞外区序列中,即在第55 位氨基酸和第56 位氨基酸之间插入2个连续的FLAG 标签。首先进行分段PCR,分别扩增片段GLUT1-Ⅰ(GⅠ,1~165 bp)和GLUT1-Ⅰ′(GⅠ′,166~1479 bp),并在GⅠ的上、下游分别引入HindⅢ酶切位点和2×FLAG 序列,GⅠ′的上、下游分别引入部分1×FLAG 序列和BamH Ⅰ酶切位点。以GⅠ′为模板进一步扩增出片段GLUT1-Ⅱ(GⅡ,166~541 bp)和GLUT1-Ⅲ(GⅢ,517~1479 bp)(PCR引物见表1)。PCR 反应条件:预变性98 ℃5 min,以98 ℃30 s,55 ℃20 s,68 ℃1 min,循环35 次,68 ℃终延伸5 min,4℃终止反应。PCR 产物经琼脂糖凝胶电泳分离鉴定,切胶回收。
1.3.2 重组质粒pcDNA4-2×FLAG-GLUT1 的构建 通过overlap PCR 将GⅠ和GⅡ连接得到片段GⅠ+Ⅱ(607 bp,引物为F231 和R382),利用In-Fusion 无缝克隆的方法将片段GⅠ+Ⅱ、GⅢ与经HindⅢ和BamHⅠ双酶切后的pcDNATM4/TO/myc-His B 质粒连接(反应条件为50℃,30 min)。将连接产物转化至感受态细胞Mach1-T1 中,在含氨苄的LB 固体培养基上密集涂布后于37℃恒温培养箱倒置培养12~14 h,次日挑取单克隆于LB 液体培养基中摇菌扩增后提取质粒。酶切鉴定及DNA 测序确认2×FLAG 序列成功插入GLUT1 第一个胞外区,得到重组质粒pcDNA4-2×FLAG-GLUT1。大量制备重组质粒用于细胞转染。

表1 构建重组质粒引物序列Tab 1 Construction of primer sequences of vector
1.3.3 细胞的培养与转染 小鼠胚胎成纤维细胞系NIH/3T3 在含10%FBS 的DMEM 培养基中培养,置于37℃、5%CO2的培养箱。当细胞融合度达到70%~90%时,根据LipofectaminTM2000 试剂说明书,以OpitMEMTM培养液分别稀释质粒与转染试剂,将两者混匀后转染细胞,4~6 h 后更换培养基。实验组转染pcDNA4-2×FLAG-GLUT1 质粒,对照组转染pcDNA4 空载质粒。
1.3.4 蛋白质印迹法检测细胞内FLAG-GLUT1 的表达 转染后24 h 收集细胞,提取总蛋白,加入还原性上样缓冲液后进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE);凝胶分离后通过湿转法将蛋白转移到PVDF 膜上(100 V,2 h);5%脱脂牛奶室温封闭1 h;FLAG 抗体(1:1000 稀释)和内参β-actin 抗体(1:4000 稀释)4℃孵育过夜;次日以1×PBST 洗膜3 遍;辣根过氧化物酶标记的山羊抗鼠第二抗体(1:4000 稀释)室温孵育1 h;1×PBST 漂洗3 遍;采用化学发光法显色并曝光。
1.3.5 流式细胞术检测细胞表面FLAG-GLUT1 表达 细胞转染后24 h 使用细胞刮刀将细胞解离,制成单细胞悬液;加入CD16/32 抗体(1∶200 稀释)4℃封闭15 min;再加入anti-DYKDDDDK 抗体(1∶1000稀释)4℃孵育1 h;1×PBS 洗涤后加入PE 耦联的山羊抗兔IgG(1∶250 稀释)4℃孵育30 min;PBS 洗涤后过滤上机检测。
1.4 统计学处理 采用SPSS 25.0 统计软件进行数据分析,正态分布的计量资料以±s 表示,组间比较采用t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 pcDNA4-2×FLAG-GLUT1 重组质粒的构建 为了检测细胞表面GLUT1 表达量,在GLUT1 第一个胞外区Ser55 和Ile56 之间插入2×FLAG 序列,从而可以利用anti-DYKDDDDK 抗体经流式细胞术检测细胞表面的GLUT1 表达量。本实验选用pcDNATM4/TO/myc-His B 质粒,含有真核基因CMV 强启动子,转染细胞后可大量表达目标蛋白。

图1 pcDNATM4/TO/myc-His B(左)与pcDNA4-2×FLAG-GLUT1质粒图谱(右)Fig 1 Plasmid profiles of pcDNATM4/TO/myc-His B(left)and pcDNA4-2×FLAG-GLUT1(right)
由于需要在GLUT1 蛋白内部插入2×FLAG 序列,首先扩增出GⅠ和GⅠ′片段(图2A),在GⅠ末端引入2×FLAG 序列。鉴于GⅠ和GⅠ′片段大小差距较大,不易直接通过overlap PCR 进行连接。因此,进一步以GⅠ′为模板分别扩增GⅡ和GⅢ两个小片段(图2B)。经overlap PCR 连接片段GⅠ和G Ⅱ,利用In-Fusion 无缝克隆技术将片段G Ⅰ+Ⅱ和GⅢ同时插入线性化的质粒pcDNA4,即得到重组质粒pcDNA4-2×FLAG-GLUT1。重组质粒经Hind Ⅲ和BamHⅠ双酶切鉴定插入片段大小正确(图2C),DNA 测序无误。

图2 重组质粒pcDNA4-2×FLAG-GLUT1 的构建及鉴定Fig 2 Construction and identification of plasmid pcDNA4-2 ×FLAG-GLUT1
2.2 转染后NIH/3T3 细胞FLAG-GLUT1 的表达 NIH/3T3 细胞经pcDNA4-2×FLAG-GLUT1 转染后,检测细胞内转入的GLUT1 的表达水平。用anti-FLAG 抗体检测细胞中FLAG-GLUT1 的总表达量,以β-actin 作为内参。与转染空载质粒相比,在40~50 kD间有一条特异性条带(图3 箭头处),大小与GLUT1 蛋白分子量符合,提示pcDNA4-2×FLAG-GLUT1 被导入NIH/3T3 细胞后FLAG-GLUT1 表达正常。
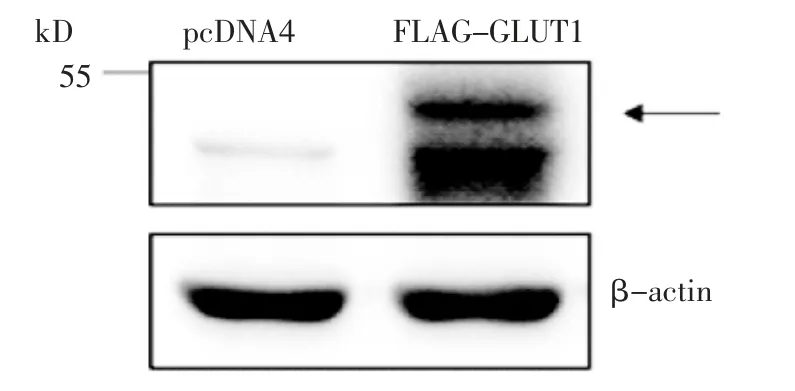
图3 Western 印迹检测NIH/3T3 细胞转染后FLAG-GLUT1 蛋白的表达量Fig 3 Detection of the amount of FLAG-GLUT1 in NIH/3T3 cells by Western blotting
2.3 NIH/3T3 细胞表面GLUT1 的定量检测 NIH/3T3 细胞经pcDNA4-FLAG-GLUT1 转染后,用anti-DYKDDDDK 抗体识别细胞表面FLAG 标记的GLUT1 的表达情况。流式检测结果显示,转染重组质粒的细胞表面可检测到FLAG-GLUT1 的表达,阳性群比例为(21.46±2.375)%,明显高于对照组(0.01±0.00)%,差异有统计学意义(t=9.035,P<0.01)(图4),提示可以通过FLAG 抗体检测细胞表面FLAGGLUT1 的表达量的变化。

图4 流式细胞术检测细胞表面FLAG-GLUT1 的表达Fig 4 Detection of FLAG-GLUT1 expression on cell surface by flow cytometry
3 讨论
疟原虫在人体细胞内寄生需要摄取大量的葡萄糖供能,以维持其生长发育。在疟原虫感染的红细胞期,葡萄糖主要以无氧糖酵解的方式提供能量。目前已建立了恶性疟原虫葡萄糖代谢相关的酶动力学模型,为潜在的药物治疗靶标研究提供了工具[10]。有研究报道,疟原虫质膜上的己糖转运蛋白也可能成为潜在的药物治疗靶标,通过限制葡萄糖的摄取抑制疟原虫的生长发育[4,11-12]。
葡萄糖是各种生物最基本的能量来源,主要通过细胞膜上的GLUTs 被细胞吸收,其中以GLUT1、2、3、4 的生理功能最为重要,GLUT1 因发现最早而得名。GLUTs 属于主要协同转运蛋白超家族(major facilitator superfamily,MFS),具有典型的折叠模式,由12个跨膜螺旋组成N 端和C 端两个结构域,各包含了一对重复的反向结构[13]。GLUT1 的失活突变会影响葡萄糖转运活性,导致癫痫、大脑萎缩和发育迟缓等一系列症状,称为GLUT1 缺陷综合征。通过比较捕获到的GLUT1 和木糖转运蛋白XyIE 的晶体结构发现,GLUT1 转运机制可能是通过胞内区4个α 螺旋组成的结构域(intracellular helical bundle,ICH)与C 端的相互作用介导的[14]。在GLUT1 缺陷综合征已经发现的突变位点中,可能主要通过影响ICH 与C 端的相互作用从而影响葡萄糖转运。当细胞内ATP 充足时,ATP 与GLUT1 结合,引起GLUT1 的loop6-7 和C 端的相互作用,进而抑制其对葡萄糖的吸收[15]。有研究表明,GLUT1 的Ser226位点的磷酸化可通过上调细胞表面GLUT1 的表达量和GLUT1 的活性,增加葡萄糖的吸收[8]。在肌肉组织中,GLUT1 的Ser490 位点的磷酸化也通过相似的机制增加葡萄糖的吸收[16]。上述位点的磷酸化可能改变了GLUT1 内部的空间结构,影响N 端和C端的相互作用,从而影响葡萄糖的吸收速率。因此,通过对正常和感染恶性疟原虫的红细胞膜蛋白进行质谱分析,筛选出可能的与疟原虫感染的特异性磷酸化位点,从而进一步分析其功能。
本研究构建的pcDNA4-2×FLAG-GLUT1 重组质粒,在GLUT1 第一个胞外区中间插入2×FLAG 序列,转染细胞后,可通过FLAG 抗体检测细胞表面GLUT1 表达水平的变化。与常规的直接用GLUT1抗体检测细胞表面GLUT1 的表达相比,具有更高的灵敏度。由于无法对红细胞进行基因转染,在后续的研究中,拟在低表达GLUT1 的NIH/3T3 细胞中对质谱筛选出的候选位点进行模拟磷酸化和去磷酸化点突变,通过检测细胞表面FLAG-GLUT1 表达水平的变化,首先明确特定位点磷酸化状态是否与GLUT1 囊泡转位相关;继而在体外将纯化蛋白FLAG-GLUT1,并重组至脂质体中,借助3H 标记的2-脱氧-D-葡萄糖检测其转运葡萄糖的速率,鉴定这些磷酸化位点对GLUT1 活性和表达量的影响,从而推测GLUT1 的磷酸化在疟原虫感染的红细胞发挥的潜在功能。
综上所述,GLUT1 对于疟原虫在红细胞期的生长发育十分重要,本研究不仅为检测GLUT1 在细胞膜上的表达水平提供了有力的工具,更有助于后续进一步研究GLUT1 磷酸化在疟原虫感染过程中的作用。
——一道江苏高考题的奥秘解读和拓展

