基因表达谱分析肝细胞癌的特征基因
张萃萃,邓为民
(1.天津医科大学基础医学院免疫学系,天津300070;2.天津市血液中心发血科,天津300110)
肝细胞癌(hepatocellular carcinoma,HCC)是肝癌中最常见的原发性恶性肿瘤,占肝癌病例的75%~85%[1]。在世界范围内每年约有841000例HCC 新增病例和782000例死亡病例[2]。乙型肝炎病毒(hepatitis B virus,HBV)和丙型肝炎病毒(hepatitis Cvirus,HCV)是导致HCC 发展的重要原因[3]。病毒诱导的发病机制涉及多种机制,例如HBV-DNA 整合进入宿主遗传系统、DNA 甲基化以及氧化应激[4-5]。肝脏慢性疾病是由于病毒通过各种受体介导的机制持续进入宿主细胞而导致的,这些机制包括感染免疫防御控制中心、病毒抑制抗原呈递、选择性免疫抑制、病毒基因表达下调和病毒突变能够通过识别HBV 抗原使病毒特异性T 细胞功能失效等[6]。尽管HBV 和HCV 引起的病毒性肝炎与HCC 高度相关,但仍有一些非病毒因素可诱发HCC 的发生和发展,如糖尿病、酒精滥用、心血管疾病、肝脏炎症、肥胖、血脂异常和非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)等[7-9]。
如果在早期发现,HCC 患者可以得到良好的治疗,主要的治疗手段是手术切除或者肝移植[10]。但是,大多数HCC 患者都在晚期才得到确诊,此时已经无法进行有效的手术治疗,转而采取化疗的方式破坏癌细胞并抑制癌细胞的增殖,治疗效果不尽如人意[11]。综上所述,HCC 治疗的关键是及早发现、及时诊断和手术治疗。然而目前,HCC 仍然缺少最为有效的肿瘤标志物。临床应用的肿瘤标志物阳性率尚无法令人满意,误诊情况屡有出现。为此,本研究结合生物信息学和临床检验方法,筛选出HCC 中两个最为重要的靶点基因,然后构建了诊断模型,并且在临床样本中进行一对一精确验证。该研究丰富了HCC 的早期诊断,为该疾病的研究提供了理论基础。
1 资料和方法
1.1 差异基因筛选 数据源HCC 患者样本数据获取自TCGA(the cancer genome atlas)数据库。本项目下载了TCGA 数据库中426例HCC 的mRNA 数据,426例样本中包含340例癌症样本和86例配对癌旁样本。TCGA 数据库链接为:https://tcga-data.nci.nih.gov/tcga/。本实验使用R 语言中的edgeR 包分析不同组之间差异表达的基因(differentially expressed genes, DEGs),以对数转换后的差异表达倍数(Log2FC)的绝对值>1 和P<0.05 为标准进行筛选。
1.2 富集通路分析
1.2.1 蛋白质-蛋白质相互作用(PPI)网络和核心基因的识别 本项目利用STRING(https://string-db.org/,version 11.0)分析蛋白质的功能联系及蛋白质的相互作用,保留综合得分大于等于0.4 的相互作用对。用Cytoscape(https://cytoscape.org/,version 3.7.2)可视化PPI 网络。Cytoscape 软件中的MCODE 插件识别显著的聚类模块,以MCODE score >2 为阈值进行筛选。
1.2.2 功能富集分析 用R 语言的clusterProfiler 包做GO(gene ontology)(包括biological process、molecular function 和cellular component)及KEGG(kyoto encyclopedia of genes and genomes)通路富集分析,以P<0.05 为标准筛选显著富集的GO 和KEGG 通路。
1.3 SLC7A11 和CCDC14 浓度检测1.3.1 研究对象 回顾性分析天津医科大学肿瘤医院2018年1月-2019年12月经病理确诊的HCC患者。纳入标准:所有病例均经病理证实;有完整的影像学检查资料;未经放化疗。排除标准:存在其他肿瘤病史;存在其他肝脏慢性疾病。
本研究经本院伦理委员会批准(KY2018C278),并与患者或家属签署知情同意书。根据以上标准,将试验对象分为两组:HCC 阳性患者为HCC 组,共195例,其中男性114例,女性81例;HCC 阴性正常人群为对照组,共107 名,其中男性60 名,女性47 名。1.3.2 ELISA检测 SLC7A11(solute carrier family 7 member11)和CCDC(Coiled-coil domain-containing)14 浓度测定采用ELISA 双抗体夹心法,具体操作严格按照试剂盒说明书进行(试剂盒选自Abcam 公司),本项目的待测样品提取自外周血。为了减少待测人群冻存后细胞数量和检测因子受损严重情况,影响指标检测,本项目样本采用新鲜提取的外周血,分批次对待测人群进行检验,最终的数据进行统一整理。标准品的稀释与加样:在酶标包被板上设标准品孔10 孔,在第一、第二孔中分别加标准品100 mL,然后在第一、第二孔中加标准品稀释液50 μL,混匀;以此类推,逐步稀释,最终稀释后各孔加样量都为50 μL,浓度分别为24 μg/L、16 μg/L、8 μg/L、4 μg/L 和2 μg/L;加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5 倍)。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。温育:用封板膜封板后置37℃温育30 min。配液:将30 倍(48T 的20 倍)浓缩洗涤液用蒸馏水30 倍(48T 的20 倍)稀释后备用。洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s 后弃去,如此重复5 次,拍干。加酶:每孔加入酶标试剂50 μL,空白孔除外。进一步温育和洗涤。显色:每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37℃避光显色15 min。终止:每孔加终止液50 μL,终止反应(此时蓝色立转黄色)。测定:以空白调零,450 nm 波长依序测量各孔的吸光度(OD 值)。测定应在加终止液后15 min 以内进行。
1.4 统计学处理 采用Excel 2013 软件建立数据库,SAS 9.4 和SPSS 19.0 统计软件进行数据分析。对连续性变量进行正态分布检验,符合正态分布的变量以±s 表示,采用SAS 9.4 中的Paired-t test 方法用于数据比较。P<0.05 为差异有统计学意义。
2 结果
2.1 差异表达基因的分析结果 为了消除批次误差效应,本项目首先对芯片原始数据进行标准化(图1A)。340例HCC 样本和86例癌旁样本进行基因差异化分析结果显示:454个基因表现出显著性差异,可列为DEGs,其中上调基因234个,下调基因220个(图1B)。

图1 HCC 和癌旁组织差异基因分析Fig 1 Analysis of differentially expressed genes in HCC cancer samples and adjacent tissues
2.2 富集分析结果 通过基因富集分析,差异表达基因主要集中在neuroactive ligand-receptor interaction 通路中(图2A)。PPI 网络筛选出针对HCC 发展最重要的10个基因,其中SLC7A11 和CCDC14 排名最靠前,意味着这两个基因在HCC 形成中的重要性最高(图2B)。

图2 KEGG 富集分析结果和PPI 网络筛选的重要基因Fig 2 Results of KEGG enrichment analysis and important genes screened by PPI network
2.3 SLC7A11 和CCDC14 检测结果 与对照组相比,HCC 组SLC7A11 浓度显著升高;CCDC14 浓度亦有明显提高。以发现的正常最高值作为检测标准,SLC7A11 和CCDC14 针对HCC 检测阳性率达到标准(表1)。
表1 SLC7A11 和CCDC14 浓度检测(±s)Tab 1 Analysis of concentration for SLC7A11 and CCDC14(±s)
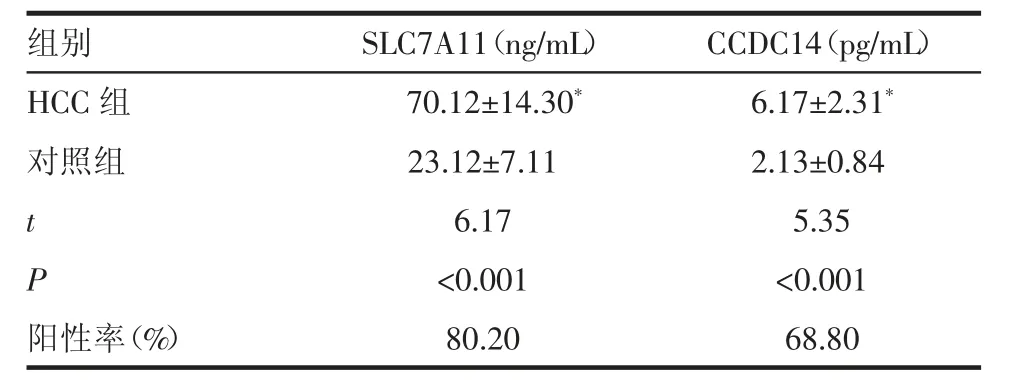
表1 SLC7A11 和CCDC14 浓度检测(±s)Tab 1 Analysis of concentration for SLC7A11 and CCDC14(±s)
注:HCC:肝细胞癌;与对照组相比,*P<0.05
组别 SLC7A11(ng/mL) CCDC14(pg/mL)HCC 组 70.12±14.30* 6.17±2.31*对照组 23.12±7.11 2.13±0.84 t 6.17 5.35 P<0.001 <0.001阳性率(%) 80.20 68.80
3 讨论
HCC 治疗效果主要取决于早期精确诊断、及时的手术治疗以及有效的预后预测模型。然而,目前临床上该恶性肿瘤尚缺乏令人满意的临床标志物。甲胎蛋白(alpha fetoprotein,AFP)是目前全世界应用最广泛的HCC 肿瘤标志物,诊断HCC 的敏感度为39%~65%,特异度为76%~94%。其敏感度和特异度均不令人十分满意,尤其在具有小肿块的HCC 早期阶段,80%的患者血清AFP 并未见明显升高。近几年HCC 的基础和临床研究也提出了若干新型肿瘤标志物[12]。例如高尔基体蛋白73(golgi protein 73,GP73)和甲胎蛋白异质体3(alpha fetoprotein-L3,AFP-L3)等。GP73 在正常人的肝细胞中表达量极低或者不表达,而在HCC 患者血清中明显升高,然而有诸多报道证实肝炎和脂肪肝患者中也存在着GP73 水平显著升高。AFP-L3 是AFP 异质体的一种。AFP-L3 为肝癌细胞特有,当临界值设为10%~15% 时,约1/3 的小肝癌(<3 cm)患者血清AFP-L3阳性;而>15%时,AFP-L3 的敏感度为75%~96.9%,特异度为90%~92%。然而有文献对于AFP-L3 在HCC诊断方面有效性的报道却不一致,一项纳入12 篇文章的Meta 分析指出AFP-L3 比AFP 有更高的特异度,但敏感度较低[13]。基于这些事实,有必要寻找更有效、更可靠的HCC 临床标志物。
本研究对TCGA 中HCC 样品和癌旁对照样品进行了差异表达基因分析,以揭示潜在的关键性差异基因。实验从340个癌症样本和86个相邻对照样本中筛选了454个差异基因,其中高表达的234个,低表达的220个。这些差异基因主要集中在神经活性配体-受体通路中。Liu 等[14]实验证明神经活性配体-受体通路与HCC 相关,因为诸多在人肝中表达的基因参与神经活性配体-受体相互作用途径。另外,Zhao 等[15]发现,肝癌的早期、中期和晚期都存在神经活性的配体-受体相互作用。因此,该途径在HCC进展中似乎很重要。
本项目确定了若干个有显著表达差异的基因,其中最为突出的两个基因是SLC7A11 和CCDC14,这为将来的研究提供了非常有价值的起点。SLC7A11 是广泛存在于肝细胞膜上面的特异性离子进出通道,之前有报道称其在HCC 存在差异性表达。SLC7A11 在HCC 中的差异性表达可能与HCC 变异细胞中特定改变的分子信号有密切联系[16]。CCDC 卷曲螺旋结构域结构基因,其表观遗传的改变已经证实与包括鼻咽癌、胰腺癌、前列腺癌在内的多种恶性肿瘤息息相关。其在HCC 中的作用尚未明了[17]。
总体而言,本项目全面揭示HCC 的差异性基因图谱,并且提出了两个可行的创新临床肿瘤标志物,为HCC 临床诊断和治疗提供了新的思路。本研究为单中心研究,样本量有限,尚存在一定的局限性。为了使SLC7A11 和CCDC14 作为HCC 特异性的标志物广泛地应用于临床检验,未来还需要进行多中心、大样本量研究。

