非小细胞肺癌组织中miR-105、KIFC1的表达变化及其临床意义
李丹,朱静,吴君华,徐维国,陈明勇
绵阳市中心医院,四川绵阳621000
肺癌是全球范围内最常见的恶性肿瘤,近年来肺癌发病率及病死率逐渐增高,严重威胁人类健康[1]。目前肺癌的治疗主要包括手术治疗、化疗及靶向治疗等,但中晚期肺癌患者远期生存率较低,5年生存率仅约20%[2]。非小细胞肺癌(NSCLC)是肺癌最为常见的类型,约占肺癌所有类型的80%,但由于肿瘤具有较大的异质性,不同患者治疗的敏感性及预后差异较大[3]。因此,有必要深入研究NSCLC的病因及发生发展的分子机制,寻找具有临床意义的诊断治疗靶点。微小RNA(miRNA)是小的内源非编码RNA,近年来研究发现miRNA参与细胞增殖、迁移和凋亡过程,与感染、免疫及肿瘤等疾病密切相关[4]。miR-105基因位于Xq28,在胃癌[5]、肝癌[6]等多种肿瘤组织中均存在异常表达的现象,并且miR-105的异常表达参与促进肿瘤的恶性进展,与患者不良远期生存率有关。驱动蛋白家族成员C1(KIFC1)又称为HSET,位于6p21.32,在肝细胞肝癌[7]、食管鳞癌[8]中存在表达异常升高的现象,并具有促进肿瘤细胞恶性增殖和迁移的作用,有可能成为肿瘤的诊断治疗新靶点。本研究观察了NSCLC癌组织中miR-105及KIFC1的表达变化,分析两者与NSCLC患者临床病理参数的关系,探讨其临床意义。
1 资料与方法
1.1 临床资料 选取2018年6月~2019年12月绵阳市中心医院收治的NSCLC患者120例,男72例、女48例,年龄30~78(56.2±6.5)岁,腺癌75例、鳞癌45例,肿瘤直径<5 cm者67例、≥5 cm者53例,肿瘤分期Ⅰ期30例、Ⅱ期44例、Ⅲ期37例、Ⅳ期9例,肿瘤分化程度高分化33例、中分化40例、低分化47例,淋巴结转移49例、无转移71例。患者均接受手术治疗,术中留取绿豆粒大小的癌组织及癌旁组织(距离癌组织5 cm以上),液氮速冻后,转运至标本库后置于-80 ℃冰箱保存。纳入标准:①经病理学检查明确诊断为NSCLC;②首次诊治,患者既往均未接受过放化疗、免疫治疗等治疗;③临床病理资料完整。排除标准:①合并感染性疾病、免疫系统疾病等;②合并其它器官恶性肿瘤;③合并心肝等严重器官功能不全。患者及家属均知情同意并已签署知情同意书,本研究经绵阳市中心医院伦理委员会审核批准通过。
1.2 NSCLC癌组织与癌旁组织中miR-105、KIFC1检测方法 采用qPCR法。取约100 mg组织标本,TRIzol法提取组织中总RNA,DEPC水稀释,分光光度计测定总RNA溶液的浓度及纯度。以总RNA为模板,按照TaqMan RNA反转录试剂盒说明书将总RNA反转录合成cDNA,并进行PCR扩增。引物序列如下:miR-105正向引物为5′-AGGACUCAAAUGCUCAG-3′,反向引物为5′-UCAAAUGCUCAGACUCCUGU-3′;内参基因U6正向引物为5′-CGCTTCGGCAGCACATATACTAA-3′,反向引物为5′-TATGGAACGCTTCACGAATTTGC-3′;KIFC1正向引物为5′-TGAGCAACAAGGAGTCCCAC-3′,反向引物为5′-TCACTTCCTGTTGGCCTGAG-3′,内参基因β-actin正向引物为5′-TGACGTGGACATCCGCAAAG-3′,反向引物为5′-CTGGAAGGTGGACAGCGAGG-3′。总反应体系20 μL,包括2 μL cDNA,0.1 μL TaqDNA聚合酶、1 μL上下游引物、1 μL 20×SYBR GreenI及0.4 μL浓度为10 mmol/L dNTPs。miR-105 PCR反应条件为:95 ℃、30 s,95 ℃变性5 s、60 ℃ 退火34 s、72 ℃延伸10 s,共40个循环。KIFC1 PCR反应条件为:95 ℃、5 min,95 ℃变性15 s、60 ℃退火60 s、72 ℃延伸10 s,共40个循环。所有反应均在ABI7500实时定量PCR仪上完成。以2-ΔΔCt表示组织中miR-105、KIFC1的相对表达量。重复3次,取平均值。
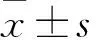
2 结果
2.1 NSCLC癌组织与癌旁组织中miR-105、KIFC1相对表达量比较 NSCLC癌组织组织中miR-105、KIFC1的相对表达量分别为0.52±0.11、2.16±0.25,癌旁组织中miR-105、KIFC1的相对表达量分别为1.13±0.16、1.23±0.15,两者相比,P均<0.05。
2.2 NSCLC癌组织中miR-105、KIFC1相对表达量的相关性 NSCLC癌组织中miR-105、KIFC1相对表达量呈负相关关系(r=-0.602,P<0.05)。
2.3 癌组织中miR-105、KIFC1相对表达量与NSCLC患者临床病理参数的关系 癌组织中miR-105、KIFC1相对表达量与NSCLC患者临床病理参数的关系见表1。由表1可知,NSCLC癌组织中miR-105、KIFC1相对表达量与肿瘤分期、组织分化程度有关(P均<0.05),而与性别、年龄、病理类型、肿瘤大小及淋巴结转移无关(P均>0.05)。

表1 癌组织中miR-105、KIFC1相对表达量与NSCLC患者临床病理参数的关系
3 讨论
肺癌是最常见的人类恶性肿瘤之一,也是全球癌症死亡的主要原因,发达国家高于发展中国家[9]。
近几十年来,我国肺癌的发病率和病死率有所增加。在病理上,肺癌分为NSCLC和小细胞肺癌,NSCLC占所有肺癌病例的75%~80%。目前手术仍然是NSCLC患者最有效的治疗方法,有助于延长患者的生存时间[10]。但是,在早期阶段,NSCLC很少表现出明显的症状,很多患者在疾病中晚期被诊断出,手术治疗效果不佳。近年来,尽管在化学疗法、放射疗法和靶向疗法等方面均取得了进步,但晚期NSCLC患者的预后仍然很差,严重威胁患者生活质量及生命健康[11]。
miRNA的表达及功能失调与肿瘤、自身免疫等多种人类疾病密切相关。miRNA是一类天然的小非编码RNA,长度为18~22个核苷酸,能够转录后抑制其靶信使RNA的表达。单个miRNA可以通过特异性结合mRNA的3′-UTR区来调控数百种靶mRNA的表达,有望成为预测或早期诊断NSCLC的肿瘤标志物[12]。本研究中,NSCLC癌组织中miR-105的相对表达量为显著低于癌旁组织,目前其机制尚不清楚,可能与长链非编码RNA如LINC00261能够直接结合并抑制miR-105靶基因表达有关。研究[13]发现,肺癌中LINC00261表达升高,通过抑制miR-105,进而抑制下游FHL1基因的表达,促进肿瘤细胞的无限增殖。本研究结果表明,NSCLC癌组织中miR-105的表达与肿瘤分期及组织分化程度有关,表明癌组织中miR-105可能作为一种抑癌基因参与抑制NSCLC的发生发展。有研究[14]报道,miR-105能够直接抑制磷脂酰肌醇3激酶/AKT信号通路的传导,发挥抑制肿瘤细胞恶性增殖的作用,而肿瘤发生时miR-105表达降低,其抑癌能力降低,导致肿瘤的分期分级升高。
驱动蛋白超家族蛋白(KIFs)是一类运动相关蛋白,可以附着在微管上并沿微管移动,以运输细胞器、蛋白复合物和信使RNA。此外,许多KIF通过参与染色体和纺锤体的运动,在有丝分裂中发挥重要作用[15]。KIFs家族由45个成员组成,包括39个N-驱动蛋白、3个M-驱动蛋白和3个C-驱动蛋白。KIFC1是KIFs家族中唯一在哺乳动物细胞中具有负端定向运动的成员,它位于6号染色体的短臂上,有4个转录本,正向链上共有20个外显子。KIFC1参与许多生理和病理过程,是细胞内物质的交换并维持细胞存活的驱动力[16]。KIFC1是潜在的癌症生物标志物和癌症治疗的分子靶标[17]。本研究中,癌组织中KIFC1相对表达量显著高于癌旁组织,其机制可能是肿瘤细胞中转录因子TCF4表达增加,其能够结合KIFC1基因启动子区域并促进KIFC1基因转录,导致KIFC1表达升高[17]。此外,本研究中,癌组织中KIFC1表达与肿瘤分期及组织分化程度有关,表明KIFC1表达随着分期和组织学分级的升高而表达增加,与促进肿瘤发生发展有关。我们分析,其机制可能是KIFC1一方面促进Akt磷酸化,进而激活GSK3β信号通路,促进肿瘤细胞的增殖,导致肿瘤分期升高;另一方面,KIFC1促进转录因子Snail的表达,促进上皮间质转化等基因的表达,导致肿瘤进展,组织分化程度降低[18]。
本研究中,癌组织中miR-105的相对表达量与KIFC1的相对表达量呈明显负相关,因而推测两者可能存在相互调控的关系。有研究[19]通过双荧光素酶报告基因实验证实,KIFC1可作为miR-105的直接靶基因,miR-105结合于KIFC1的mRNA 3′-UTR区,降低mRNA稳定性,降低KIFC1表达,从而抑制肿瘤细胞恶性增殖及迁移等生物学行为。
综上所述,NSCLC癌组织中miR-105表达降低、KIFC1表达升高,两者负相关,miR-105、KIFC1表达与肿瘤分期及组织分化程度有关,共同参与NSCLC的发生发展,有望成为新的NSCLC诊断、治疗的肿瘤标志物。

