哮喘诱发过程中腹腔注射CpG寡核苷酸的小鼠肺组织病理及BALF和血清TSLP表达观察
王超,董晓艳,蒋鲲,朱丹颖,方永双,李孟荣
1上海市儿童医院,上海交通大学附属儿童医院,上海 200062;2 温州医科大学附属第二医院,育英儿童医院
支气管哮喘(简称哮喘)是儿童常见的呼吸道慢性疾病之一,严重影响儿童的生长发育及身心健康。哮喘的病因、发病机制及治疗方法一直是临床研究的热点。CpG寡核苷酸(CpG oligonucleotides,CpGODN) 是一类含有与微生物体内类似的、具有免疫活性的非甲基化GC序列单链脱氧寡核苷酸(ssDNA)片段的统称,具有广泛的免疫调节作用。多项动物实验[1~3]表明,CpGODN可诱导小鼠Th1型免疫反应,抑制Th2型免疫应答,可以有效地预防和治疗哮喘。胸腺基质淋巴细胞生成素(TSLP)是一种上皮源性细胞因子,与TSLP受体(TSLPR)结合而发挥生物学功能。越来越多的研究[4,5]结果表明,TSLP可能是启动哮喘和过敏症的关键因子,并介导过敏进程的发生、发展。CpGODN在哮喘中的具体作用机制目前尚不明确。CpGODN是否可以通过干预哮喘小鼠支气管肺泡灌洗液(BALF)及血清TSLP的表达变化,发挥其免疫调节作用?为此我们建立急性哮喘小鼠模型,观察CpGODN腹腔注射的急性哮喘小鼠BALF、血清TSLP的表达变化,现报告如下。
1 材料与方法
1.1 动物、试剂 SPF级健康雄性Balb/c小鼠36只,4~6周龄,体质量18~22 g,购自中国科学院上海实验动物中心,于温州医学院实验动物中心层流实验室饲养,饲养温度25 ℃,相对湿度70%,昼夜照明12/12h;CpGODN:硫代磷酸化CpGODN1826 (5’-TCCATGACGTTCCTGACGTT-3’),上海生工生物工程有限公司;卵清白蛋白(OVA)、地塞米松(DXM)购自美国Sigma公司;TSLP酶联免疫吸附试验(ELISA)试剂盒购自上海朗顿生物科技公司。
1.2 动物分组、哮喘诱发及CpGODN用法 36只小鼠(4~6周)随机分为4组,每组各9只。哮喘模型组(A组)、DXM干预组(B组)、CpGODN干预组(C组)用OVA致敏和激发建立小鼠急性哮喘模型:0.1%OVA/AL(OH)3混合凝胶0.1 mL于第1、14天腹腔注射致敏,第25~31天1%OVA雾化吸入激发,每日1次,每次30 min,连续7 d;B组激发前1 d和每次激发前1 h,0.5 mg/kg的DXM腹腔注射;C组激发前1 d和每次激发前1 h,50 μg的CpGODN腹腔注射。D组为正常对照组,每次致敏和激发均以生理盐水代替。在致敏阶段,第1次致敏后,各组小鼠表现无明显差异,在激发阶段,A组小鼠表现为烦躁不安、呼吸急促、腹肌抽搐和二便失禁等症状,严重者呼吸减慢或节律不齐,动作迟缓或俯伏不动、四肢瘫软,反应迟钝;B、C组小鼠上述表现较A组明显减轻;D组小鼠均无上述症状。
1.3 各组小鼠肺组织炎症水平观察 末次激发24 h时,取各组小鼠,摘取眼球收集血液,2 000 r/min离心15 min,吸取血清-80 ℃保存。颈椎脱臼处死小鼠,打开胸腔,暴露肺组织,夹闭左肺门处,1 mL PBS缓冲液分3次于气管插管处注入,缓慢冲洗右肺,回收BALF,回收率约80%,2 000 r/min离心15 min,取上清液-80 ℃保存待检。左肺组织用4%多聚甲醛固定,制备石蜡包埋切片,苏木素一伊红染色用于光镜观察;同时取左肺组织,置预冷的2.5%戊二醛前固定,1%锇酸固定,常规方法处理,透射电镜观察肺组织超微结构。
1.4 各组小鼠BALF、血清TSLP检测 采用ELISA法。取各组小鼠BALF、血清,ELISA法检测TSLP,所有操作均严格按照试剂说明书进行。以标准品的浓度为横坐标,OD值为纵坐标,在对数坐标纸上绘制标准曲线,用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代人方程式,计算出样品相对浓度,再乘以稀释倍数,即为样品的实际浓度。重复3次,取平均值。
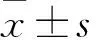
2 结果
2.1 各组小鼠肺组织病理改变 光镜下可见,A组小鼠肺组织炎症明显,支气管周围有大量的炎症细胞浸润,B、C组肺组织炎性细胞浸润减少,轻于A组,D组小鼠肺组织无炎症改变。电镜下A组小鼠肺组织超微结构改变明显,B、C组小鼠肺组织超微结构改变类似,均轻于A组,D组肺组织超微结构无明显改变。见图1、2。
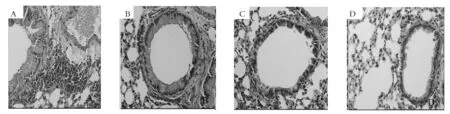
图1 各组小鼠肺组织HE染色(×200)

注:A1为哮喘模型组肺泡腔内活化的巨噬细胞;A2为哮喘模型组肺泡Ⅱ型上皮细胞板层小体空泡化明显;B1为DXM组肺泡肺泡Ⅱ型上皮细胞微绒毛基本完整;B2为DXM组肺泡隔结构基本恢复正常;C1为CpGOND肺泡Ⅱ型上皮细胞结构基本恢复正常;C2为CpG治疗组电镜显示肺泡Ⅱ型上皮细胞板层小体基本恢复正常;D1、D2为对照组正常的肺泡Ⅱ型上皮细胞及板层体。图2 各组小鼠肺组织电镜图像(图A1、C2、D2×25 000,图A2、B1、B2、C1及D1×10 000)
2.2 各组小鼠BALF、血清中TSLP水平比较 A、B、C、D组BALF中TSLP水平分别为(2.481±0.152)、(2.263±0.122)、(2.483±0.191)、(2.483±0.280)pg/mL,与 A、C、D组比较,B组小鼠BALF中TSLP水平低(P均<0.05)。A、B、C、D组血清TSLP水平分别为(2.739±0.127)、(3.028±0.142)、(3.556±0.102)、(2.560±0.096)pg/mL,与D组比较,A、B、C组血清TSLP水平升高(P均<0.05),A、B、C组间两两比较,P均<0.05。
3 讨论
TSLP由Friend等[6]于1994年首次报道,是一种新型的白细胞介素7(IL-7)样细胞因子,属于IL-2家族,主要由上皮细胞、气道平滑肌细胞、角质细胞、基质细胞、成纤维细胞、肥大细胞、巨噬/单核细胞、中性粒细胞及树突细胞(DCs)表达[7,8]。人TSLP编码基因位于5q21.1染色体,主要存在短型、长型2种同源异构体,前者有60个氨基酸组成,后者编码159个氨基酸[9,10]。鼠TSLP基因定位于第18号染色体,由140氨基酸组成。尽管人和鼠TSLP在基因和蛋白水平上仅有56%和43%的同源性,但其生物学功能却非常相似[11,12]。TSLP受体(TSLPR)属于造血细胞因子受体家族成员,功能性TSLPR复合物是由TSLPR和IL-7Rα组成。TSLP与其特异性受体TSLPR及IL-7Ra结合,形成三元复合物,启动信号传导[8]。TSLP-TSLPR-IL-7Rα复合体可作用于多种细胞系,特别是髓样DCs,上调DCs主要组织相容性复合物(MHC)Ⅱ类、OX40配体(OX40L/CDl34L,CD252)、CD54、CD80、CD83和CD86以及激活标记物DC-LAMP的表达,促进DCs的成熟,从而诱导CD4+T细胞(Th0)分化为Th2细胞[13],Th2效应细胞可分泌大量炎性因子(IL-4、IL-5、IL-9和IL-13)以及GM-CSF,促进B细胞生成IgE、肥大细胞脱颗粒和黏液高分泌,引起气道炎症和气道高反应性。Th2记忆细胞上MHC Ⅱ类相关抗原与B细胞受体结合,激活协同刺激分子CD40和CD40L,促进IgM向IgE转换。TSLP还可显著抑制Treg功能,导致抗炎细胞因子IL-10水平降低[14]。但经TSLP处理的DCs不产生促进Thl型细胞分化的细胞因子IL-12或促炎症因子TNF-α、IL-lβ和IL-6,这是TSLP构建Th2免疫微环境的关键特征[13]。研究发现,TSLP的基因启动区包含NF-κB结合位点,亦包含诱导TSLP表达的顺式调控元件,NF-κB结合位点是TSLP的启动子。在人气道上皮细胞中,促炎因子IL-lβ和TNF-α可通过NF-κB信号途径调节TSLP表达[15];能使Toll样受体兴奋的因素即可通过NF-κB途径刺激内皮细胞产生TSLP[15,16]。本研究结果显示,哮喘组EILSA法检测BAFL中TSLP没有明显升高,与理论预计及Zhou等[5]研究献报道不符,考虑可能与造模有关及TSLPR的表达有关。哮喘组血清中TSLP明显升高,Zhou 等[5]也曾用EILSA法检测哮喘小鼠血清TSLP表达,但未检测出结果。王淑丽等[17]报道哮喘小鼠血清TSLP表达升高,究竟是局部TSLP影响血清TSLP表达,还是血清TSLP加重局部炎症反应,尚需进一步研究。
DXM是一种强有效的糖皮质激素,能抑制多种免疫效应细胞的功能,从而抑制各种细胞因子的合成与分泌。糖皮质激素与其受体结合后能降低NF-κB、AP-1活性,致促炎症因子如前列腺素、IL-1、IL-6、TNFa等表达减少,而抗炎症因子如IL-10、转化生长因子等表达增加,从而发挥糖皮质激素的抗炎等生物学效应[18]。Lee等[15]报道IL-lβ和TNFa能够诱导TSLP的表达和释放,进一步研究TSLP基因启动因,发现IL-lβ和TNFa可通过NF-κB途径活化TSLP启动基因,而加入核因子NF-κB阻滞剂后,TSLP表达明显减少。因此推测,DXM抑制TSLP的合成与分泌的机制可能是通过抑制IL-1、TNFa的合成,降低NF-κB活性实现的。本实验结果显示DXM组BAFL中TSLP明显降低,与其余三组相比,有显著性差异,提示DXM局部作用机可能是通过降低NF-κB活性,减少IL-lβ和TNFa分泌,从而抑制TSLP的表达。但DXM组血清中TSLP水平较A、B组明显升高,与小鼠致敏、激发时出现的症状不符,提示DXM和(或)TSLP全身同局部作用机制不同,为进一步研究DXM、TSLP在变应性疾病中的作用提供理论依据。
作为强有力的免疫反应刺激序列,CpGODN对哮喘气道炎症的抑制作用得到了广泛的关注。多个实验模型表明CpGODN具有预防及治疗哮喘的作用。CpGODN通过TLR9的特异性识别,可诱发信号传导途径,激活多种不同的转录因子,包括NF-κB和激活蛋白-1(AP-1),进而刺激B细胞增殖,诱导Th1型细胞因子如IL-12、IFN-γ、IL-6、TNF-α等的分泌,从而诱导Th1型免疫应答[1,19]。研究[15,16]发现,能使Toll样受体兴奋的因素即可通过NF-κB途径刺激内皮细胞产生TSLP。既然CpGODN可以活化TLR9,理论上即可激活NF-κB,应该可以升高TSLP表达,加重哮喘的症状,但是我们前面已述,TSLP构建Th2免疫微环境的关键特征,是经TSLP处理的DCs不产生促进Thl型细胞分化的细胞因子IL-12或促炎症因子TNF-α、IL-lβ和IL-6。Tomoki等[20]通过对静止DC、CD40L-DC、TSLP-DC基因表达谱的分析,发现TSLP能够诱导DC表达TNF超家族蛋白OX40L,后者通过与T细胞表面受体OX40相互作用,在没有IL-12的作用下促进Th2细胞的产生。当有IL-12存在时,OX40L不能诱导产生炎症Th2细胞,失去启动炎症Th2细胞产生的能力。CpGODN虽然可以通过激活NF-κB,诱导TSLP的表达,但是CpGODN可诱导Th1型细胞因子IL-12的分泌,使TSLP失去构建Th2免疫微环境的能力,不能产生以Th2为优势的免疫应答,由此可以推测CpGODN干预使小鼠哮喘症状减轻,部分机理可能是通过阻断TSLP介导的免疫应答实现的。在本实验结果显示,CpGODN组BAFL中TSLP无明显升高,同A组、B组比较无显著性差别,血清中TSLP升高明显,小鼠的哮喘症状反而减少,提示CpGODN局部同全身作用机制可能不同;CpGODN可能拮抗了TSLP的生物学作用。为CpGODN防治哮喘提供了新的理论依据及新的研究途径。
综上所述,腹腔注射CpGODN可减轻急性哮喘小鼠肺组织炎症水平,其机制可能为影响小鼠BALF、血清TSLP的生物学效应有关。哮喘的发病机制复杂,CpGODN在哮喘发病中的免疫活性作用可能存在多种不同的调节机制,彼此之间存在复杂的网络联系,与TSLP之间相互作用机制仍待进一步研究探讨。

