细胞自噬与光动力疗法的研究进展
冯颖君, 李志嘉, 肖紫璇, 王思佳, 曾抗
(1.南方医科大学南方医院皮肤性病科,广东 广州 510515;2.南方医科大学皮肤病医院,广东 广州 510091)
光动力疗法(photodynamic therapy,PDT)作为近30年快速发展的新型治疗方法,在皮肤肿瘤、感染性疾病、皮肤附属器疾病、医疗美容中以微创、选择性好、安全性高、疗效佳等独特优势逐渐得到广泛的应用[1-2]。细胞自噬(cell autophagy)将受损的细胞器、错误折叠的蛋白及其他大分子物质等运送至溶酶体(lysosome)降解并再利用,是真核细胞维持内环境稳态的一种平衡机制[3]。PDT可通过诱导细胞凋亡、自噬与坏死等主要途径达到治疗目的[4]。PDT引起的细胞自噬发挥双刃剑的作用,一方面适当的自噬有利于细胞存活,另一方面过度的自噬促进细胞死亡。与此同时,细胞发生自噬的程度与凋亡息息相关[5]。本文就PDT诱导细胞自噬的机制及与凋亡的关系进展进行综述,为今后相关实验研究及临床诊疗提供帮助。
1 PDT的基本原理
PDT是一种依赖于光敏剂、一定波长的光源和分子氧之间的相互作用,进而产生杀伤效应的新型治疗方法[6]。PDT过程中本身无毒的光敏剂(photosensitizer,PS)被增殖旺盛的细胞选择性吸收,经过特定波长激发光的照射产生活性氧(reactive oxygen species, ROS),继而发生氧化应激损伤细胞甚至导致细胞死亡,但周围正常的组织不受损伤,有着高度的组织选择性[6]。近30年来,光敏剂及纳米技术等的快速发展,将PDT从实验室推向临床,使PDT不仅在皮肤领域得到广泛应用,现在还作为辅助治疗用于呼吸、消化、神经系统疾病和泌尿系肿瘤[6]。
PDT是一种结合光物理和光化学过程产生生物效应的治疗方式。用光激发PS,是一个物理过程,随后被激发的PS与细胞底物或分子氧发生光化学反应,最终导致癌细胞死亡。在吸收了一个光子之后,PS从它的基态单重态(S0)转移到激发单重态(Sn)。单激发态PS(singlet excited state PS)由于寿命很短(从纳秒到皮秒)不能参与细胞底物的反应,为了回到基态,激发的PS要么以光的形式辐射能量,要么通过内转换(internal conversion,IC)释放热能而失去能量,从而返回S0,或者通过系统间交叉(inter-system crossing,ISC)将单激发态PS转换为寿命更长(从毫秒到微秒)的激发三重态PS(triplet state PS)。三重态PS也通过发射荧光或热而失去能量返回基态[7]。而在生物环境中,激发三重态主要通过以下两种机制返回基态:一是电荷(即电子)转移到周围的基质,导致形成超氧阴离子(O2·-),接着蜕变为过氧化氢(H2O2)——高度活性羟基自由基(·HO)的前体,这是通过类Fenton反应形成的,即通过电子转移直接与细胞基质反应,最终生成氧化产物(Ⅰ型反应);二是将能量(但不带电荷)直接转移到基态分子氧(3O2)中,从而产生高活性的单线态氧(1O2)(Ⅱ型反应)。1O2被认为是最具破坏性的ROS,因为它可以与蛋白质的氨基酸、不饱和脂质等多种生物分子反应。在这样一个吸收和产生ROS的周期之后,PS再次处于基态,准备吸收一个新的光子来产生更多的ROS。因此,一个PS分子在被破坏之前可以产生数千个1O2分子。这两种光动力机制的比率对于每个PS都是独一无二的,取决于各自的化学结构(图1)[8]。
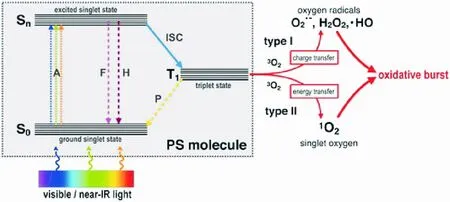
图1 光动力疗法的光化学和光物理机制(S0:基态单重态;Sn:激发单重态; T1: 激发三重态PS;A:光吸收;F:光辐射;H:热能释放(内转换);ISC:系统间交叉;P:荧光发射;3O2:基态分子氧;1O2:单线态氧;O2·-:超氧阴离子;·HO:羟基自由基;H2O2:过氧化氢)[8]
PDT产生的ROS主要通过以下三种机制起抗肿瘤作用:①损伤病变部位的微血管,从而造成肿瘤或被感染的细胞缺血缺氧;②刺激机体免疫系统,增加炎症及免疫介质的释放,提高对细胞的识别及杀伤效应;③通过凋亡、坏死途径直接杀伤细胞[4]。随着对PDT的深入研究,研究者们发现各种类型的细胞在被ROS氧化应激损伤后都可以引发自噬反应,而PDT在细胞中诱导的自噬有两种结果,一方面可以维持细胞稳态,保护细胞,另一方面,过度的自噬也可以引起自噬性细胞死亡(autophagic cell death,ACD)[5]。
2 细胞自噬现象
细胞自噬是一种高度保守的真核细胞分解代谢和再循环的过程。在能量或营养不足、代谢紊乱、缺氧等各种细胞应激情况下,细胞内受损或无用的蛋白质、细胞器或其他细胞质成分被运输到溶酶体系统进行降解,产生氨基酸等降解产物供细胞重新利用,自噬在维持细胞新陈代谢、内环境的稳态以及细胞器如线粒体和内质网的功能中起着关键作用[9]。自噬水平一定程度上的增加有助于提高细胞的生存能力,对各种细胞毒性损伤做出反应。然而,自噬的过度激活也会造成不可逆损伤,加速细胞死亡,称为ACD或Ⅱ型细胞程序性死亡(type Ⅱ programmed cell death,PCD)[9-10]。
在哺乳动物细胞中,自噬有三种主要类型:小自噬(microautophagy)、大自噬(macroautophagy)和伴侣介导的自噬(chaperone-mediated autophagy,CMA)。 虽然它们在形态学上各不相同,但三者最终都向溶酶体输送“货物”以进行降解和循环[11]。小自噬是一种非选择性的细胞自噬,利用溶酶体膜的内陷、突起或分隔直接捕获溶酶体表面的细胞质“货物”或者完整的细胞器。CMA与小自噬的不同之处在于,它不使用膜结构来隔离货物,而是使用伴侣蛋白来选择性识别底物蛋白,并以受体介导的方式一对一地跨溶酶体膜转运底物。特别是含有特定五肽基序的底物被伴侣热休克蛋白70(HSP 70)识别,该蛋白将蛋白质底物传递到溶酶体膜表面,通过与溶酶体相关的受体膜蛋白2a (lamp-2a)相互作用,转移到溶酶体腔内迅速降解,CMA是唯一的一种选择性细胞自噬形式。与小自噬和CMA不同,大自噬是在靶细胞内合成双膜囊泡(自噬体),自噬体隔离受损的细胞器和错误折叠的蛋白质并与溶酶体融合形成自噬溶酶体(autophagolysosome),溶酶体水解酶随后降解自噬体内容物使其再参与循环利用。作为一种非特异性的整体降解过程,大自噬是三种细胞自噬类型中研究得最清楚的,也是PDT中常见的自噬类型[5, 10-11]。
细胞自噬是一个完整、动态、多步骤的过程,要准确、客观地反映生物环境中的细胞自噬水平必须联合应用多种检测方法[12]。
首先,电子显微镜(electron microscopy,EM)被认为是细胞形态学方面检测自噬水平最直接、经典的方法[13]。自噬体是一种独特的囊泡状双层膜结构,包含有细胞质,可能还有细胞器。自噬溶酶体仅具有单层膜结构,可包裹处于不同降解阶段含有致密电子的细胞质和(或)细胞器[14]。Zhu等[15]在探讨岩藻黄素在人胃癌SGC-7901细胞自噬中的作用时,用电子显微镜观察到了不同阶段的自噬体结构。其次,质粒荧光标签检测细胞自噬流。GFP-LC3、RFP-GFP-LC3荧光质粒可分别通过在荧光显微镜下观察绿色荧光斑点、红绿荧光信号变化及黄色荧光信号强度,检测细胞自噬流,评价细胞自噬水平[16]。再次,Western-blotting检测自噬标志性蛋白表达水平也是最常用的一种方法。除了LC3、ATG8是细胞自噬的经典标志蛋白外,P62蛋白是目前研究最透彻的细胞自噬选择性降解底物。一般情况下,P62蛋白水平的高低与细胞自噬的活性成反比,因此其表达量的变化也可用于监测细胞自噬流[17]。
细胞自噬是一个发生、发展、变化的过程,在实验中需根据自身研究的目的、内容考虑使用多个不同的方法以准确地评估在给定的生物环境状态下的细胞自噬程度。特别地,溶酶体不仅是细胞自噬过程中不可或缺的细胞器,也是一些光敏剂的靶点[17]。因此采用多种检测方法来验证细胞自噬,以此排除光敏剂可能带来的影响是很有必要的。
3 PDT诱导细胞自噬
因为PDT诱导的细胞凋亡的发生较自噬更加快速且明显,故以往科学家们更多地研究PDT引起的凋亡[18]。越来越多的研究表明,各种类型的细胞在PDT后都可以引发自噬反应。但是调节细胞自噬的分子机制尚不完全清楚,PDT后促进细胞生存还是死亡,也与PS类型、细胞类型、凋亡机制的存在与否和光损伤的程度有关[7]。
多种证据表明,PDT诱导的自噬可以减弱其对各种细胞的杀伤效应,如乳腺癌细胞(MDA-MB-231和 MCF-10A)、HeLa细胞和皮肤鳞状细胞癌A431细胞[19-21]。乳腺癌细胞经亚甲蓝光动力疗法(methylene blue photodynamic therapy,MB-PDT)处理后,细胞内自噬体的形成和LC3-Ⅱ/LC3-Ⅰ的比值都明显增加,使用自噬抑制剂后,MDA-MB-231和MCF-10A细胞死亡率增加,相反,自噬激活剂雷帕霉素可以进一步增强细胞自噬通量,减少PDT诱导的细胞死亡[19]。同样,自噬抑制剂3-MA可通过抑制细胞自噬增强ALA-PDT对A431细胞产生的杀伤作用[21]。光敏蛋白光动力疗法(photofrin-based photodynamic therapy)可诱导HeLa细胞产生强大的自噬作用,利用CRISPR/Cas9基因组编辑技术在HeLa细胞系中敲除ATG5基因可以增强细胞的光敏感性,进而导致PDT介导的细胞毒性增加[20]。以上研究表明,细胞自噬可能作为光动力抵抗的一种机制存在。这也许可以解释临床上用光动力治疗尖锐湿疣时,如果光敏剂用量不足常常会出现明显的治疗抵抗现象;同理也许可以解释当光动力的其他治疗参数(包括照射剂量、照射时间和光照距离等)不足时也会出现治疗抵抗现象[22]。
细胞自噬水平的持续上调可以使PDT诱导的自噬反应从细胞保护作用向激活ACD转变。Zhu等[23]的研究证实,甲基焦酚氯素光动力疗法(methyl pyropheophenylchlorin-photodynamic therapy,MPPa-PDT)可以引起内质网应激(endoplasmic reticulum stress,ERS),ERS进一步通过PERK信号通路诱导细胞自噬,在体内外对乳腺癌MDA-MB-231细胞均有杀伤作用。应用自噬抑制剂可以明显减少自噬体的形成,同时降低PDT治疗乳腺癌细胞的细胞毒性和凋亡。体外实验中,甲基氨基酮戊酸光动力疗法(methyl aminolevulinate photodynamic therapy,MAL-PDT)可以诱导DOK口腔癌前病变细胞发生ACD。同时体内实验表明,MAL-PDT抑制仓鼠颊囊肿瘤的生长。因此,MAL-PDT可能通过诱导ACD为口腔癌前病变提供一种有效的治疗方法[24]。
细胞经PDT处理后产生的反应与PDT剂量有关[10]。既往的研究揭示了金丝桃素介导的光动力疗法(hypericin-mediated PDT,HY-PDT)可以增加结肠癌细胞对化疗药物——奥沙利铂(oxaliplatin,L-OHP)的敏感性[25]。而进一步研究相关机制发现,HY-PDT诱导的不同程度的自噬对细胞命运和化疗敏感性可以产生相反作用[26]。低剂量HY-PDT诱导保护性细胞自噬,促进细胞增殖,同时可降低L-OHP对奥沙利铂耐药结肠癌细胞的细胞毒性。高剂量HY-PDT可以诱导大量ROS产生和严重的ERS,进而上调CHOP蛋白的表达和激活CHOP/TRIB3/Akt/mTOR级联信号,触发ACD[26]。综上,细胞自噬程序激活的最终结果高度依赖于应激信号的强度和细胞内环境的调节。
4 PDT中细胞自噬与凋亡的关系
在时间上,PDT诱导细胞自噬可以独立甚至早于凋亡发生。经过PDT处理后,人乳腺癌MCF7细胞系因缺失Caspase-3没有发生典型的凋亡反应,但是凋亡缺陷的MCF-7v细胞中LC3-Ⅱ以时间和剂量依赖的方式大量积累,这表明细胞自噬可以单独发生[27]。根据Kessel等[28]的研究结果,小鼠白血病L1210细胞暴露于LD90-PDT后,分别于15 min和60 min内观察到了细胞自噬和凋亡,前者可以首先发生。
PDT诱导的细胞自噬在凋亡活性细胞和凋亡缺陷细胞中可能发挥保护或者杀伤细胞两种不同的作用。在凋亡活性细胞中,PDT引起的细胞自噬更倾向于起自我保护和抵抗光动力的作用。Valli等[29]探讨了Pc13-PDT对人黑色素瘤A375细胞的光毒性作用,结果表明,阻断PDT诱导的细胞自噬可以促进凋亡发生,增加PDT的杀伤效果,揭示了细胞自噬在其中的自我保护作用。此外,在重复接受Pc13-PDT处理的A375细胞中,检测到对治疗敏感性降低和细胞自噬激活增加,这表明细胞自噬可能是耐受PDT的机制之一[29]。在凋亡缺陷细胞中,细胞自噬主要引发ACD。在人前列腺Bax缺陷DU-145细胞中,PDT处理后只观察到细胞自噬现象[30]。Panzarini等[31]研究结果显示,醋酸玫瑰红光动力疗法(rose bengal acetate photodynamic therapy,RBAc-PDT)通过ROS和ERS激活HeLa细胞多条死亡信号通路,有趣的是,单独抑制Caspase-9、Caspase-8、泛Caspases并不影响细胞自噬途径的激活,引发ACD的发生。因此,PDT中细胞自噬的最终作用可能与凋亡机制有关。
5 结语
PDT通过产生的ROS(主要是1O2)损伤微血管、激活免疫系统,以凋亡、坏死途径直接杀伤细胞,但PDT诱导的细胞自噬是一把双刃剑,一定程度的自噬可以保护细胞,过度的自噬也可以引发ACD。在PDT中,由于光照时间、剂量、PS和细胞类型的不同以及是否引起凋亡,细胞自噬引发的结果也截然不同。在低剂量PDT处理和凋亡存在的细胞中,自噬可能是光动力抵抗的一种方式,更多地发挥细胞保护作用;在高剂量和凋亡缺陷的细胞中,自噬更多引发ACD。因此,临床治疗上应保证足够的光动力效应(包括充分的光敏剂剂量、照射剂量、照射时间和光照距离等各种参数),以期充分利用细胞自噬途径引起的杀伤效应,同时避免其产生的光动力抵抗效应,这提示,PDT联合细胞自噬抑制剂在某些条件下可能是提高PDT疗效的一种方法。

