NADPH氧化酶在油酸诱导的H9c2心肌细胞凋亡中的作用
何勇鹏,孙 迪,刘恩宠,何 杰,李 忌,王振华
(烟台大学生命科学学院/线粒体与健康衰老研究中心,山东 烟台 264005)
糖尿病心肌病是独立于高血压和冠心病等其他心血管病变之外的心脏病变[1],糖毒性、氧化应激、内质网应激、线粒体功能失常、脂毒性等都是其潜在发病机制,但其确切分子机制仍不清楚,现有研究表明氧化应激是导致心肌细胞凋亡的重要原因.
活性氧(ROS)来源于细胞呼吸代谢过程中的副产物, 参与多种生理生化和病理过程中的信号传导[2-5].线粒体是病理性ROS合成的关键位点,NADPH氧化酶(NOXs)则是细胞内源性ROS产生的主要来源之一,与其他酶类生成ROS方式不同,而是通过将NADPH上的电子转移到O2上产生ROS[6-9].NADPH氧化酶可作为细胞内关键信使分子,其激活可通过多种信号通路诱导细胞凋亡[10-12].
油酸(cleic acid,OA.结构式如图1)是构成食用油脂中含量最高的单不饱和脂肪酸,亦是人体血浆中含量最高的游离脂肪酸之一[13].血浆油酸水平与胰岛素抵抗相关,也是糖尿病发生的独立危险因素[14].心血管事件是糖尿病患者致死的首要危险因素,2型糖尿病患者在未有明确血管受损时,亦有心脏功能受损表现,称为糖尿病心肌病[15-16]. 本研究以油酸复制H9c2心肌细胞体外损伤模型,探究NADPH氧化酶在油酸诱导的心肌细胞损伤中的关键作用,为糖尿病心肌病的防治提供新的研究思路.

图1 油酸结构式
1 材 料
1.1 实验细胞系
H9c2(2-1)大鼠心肌细胞购自中国科学院上海细胞库.
1.2 仪器与设备
细胞培养箱(上海力申科学仪器有限公司); 生物超净台(苏州净化设备有限公司); 倒置相差显微镜(香港Motic公司); 多功能酶标仪(Molecular Devices Corporation); ACEA NovoCyte TM系列流式细胞仪(艾森生物科学公司); Micro 21R高速冷冻离心机(Thermo Fisher Scientific Inc); 数显恒温水浴锅(江苏省金坛市科兴仪器厂); 电子天平(北京赛多利斯科学仪器有限公司); MH-2 微孔板孵育振荡器(海门市其林贝尔仪器制造有限公司); 蛋白电泳仪器(美国BIO-RAD公司); Tanon5500凝胶成像系统(上海天能科技有限公司).
1.3 材料与试剂
油酸(美国 Sigma公司); MTT粉末(北京 Biodee公司); 蛋白酶抑制剂(Thermo Fisher Scientific,Waltham,MA); BCA蛋白定量试剂盒(Thermo Fisher Scientific,Waltham,MA); NAC、 mito-TEMPO、 DCFH-DA探针美国(美国Sigma公司); DPI(美国 Selleck 公司);β-actin一抗、Caspase 3(美国 CST 公司)、一抗、Bax一抗、Bcl-2一抗(上海 Abcam 公司); HRP 耦联山羊抗兔 IgG(美国 Santa Cruz Biotechnology 公司).
2 方 法
2.1 细胞培养
H9c2心肌细胞培养于高糖DMEM培养基(含10% Gibco血清和双抗)中,在37 ℃,5% CO2培养箱中培养至70%~80%融合时,用含0.25% EDTA胰酶消化细胞,传代培养,取对数生长期的细胞进行实验.
2.2 油酸的配制
精密量取1 mL 0.1 μmol/L的NaOH并将其加热至75 ℃,将31.4 μL 油酸加入至NaOH中,超声震荡至完全溶解后,制备油酸母液浓度为100 mmol/L.以10% BSA为溶剂将油酸稀释至浓度分别为2、4、8 mmol/L,使用0.22 μm滤膜过滤后,于-20 ℃分装保存.使用前,将不同浓度油酸于37 ℃温水浴溶解,使用时,将油酸按不同浓度与DMEM完全培养基1∶9进行混合加入至BSA终浓度为1%.
2.3 细胞实验分组
2.3.1 油酸干预实验 将H9c2心肌细胞随机分为对照组与实验组(不同浓度、不同时间油酸处理).
2.3.2 抑制剂干预实验 将H9c2心肌细胞随机分为对照组、油酸组、抑制剂处理组、抑制剂与油酸联用组(抑制剂提前30 min预处理).
2.4 细胞活力检测
在96孔板中接种H9c2心肌细胞悬液(细胞2×104个·L-1,每孔100 μL),每组设置6个复孔.在37 ℃、 5% CO2细胞培养箱中培养过夜,按照实验设计,加入不同浓度含油酸的培养基,继续培养不同时间.处理终点后,吸弃原培养液,加入100 μL含10% MTT(5 mg/mL)的DMEM培养液,培养箱中孵育3 h.吸弃MTT培养液,每孔加入200 μL DMSO溶液,平板振荡15 min,酶标仪测定570 nm吸光度,计算公式如下:细胞增殖活力=实验组A(校正后) /对照组A(校正后)× 100 %
2.5 细胞内ROS检测
在6孔板中接种H9c2心肌细胞悬液(细胞5×104个·L-1,每孔100 μL),每组设置3个复孔.在37 ℃、 5% CO2细胞培养箱中培养过夜,按照实验设计,加入不同浓度含油酸的培养基,继续培养.实验结束后,吸弃培养基,PBS清洗一遍,加入10 μmol/L DCFH-DA荧光探针,37 ℃孵育20 min.吸弃探针,用PBS清洗2遍,300 μL胰酶消化细胞1000 ×g,4 ℃离心6 min.吸弃上清,加入500 μL PBS重悬,放入冰盒避光,利用流式细胞仪定量ROS水平.
2.6 细胞凋亡检测
在6孔板中接种H9c2心肌细胞悬液(细胞5×104个·L-1,每孔100 μL),每组设置3个复孔.在37 ℃、 5% CO2细胞培养箱中培养过夜,按照实验设计,加入不同浓度含油酸的培养基,继续培养.处理终点时,将把细胞培养液吸出至合适离心管内,PBS洗涤贴壁细胞一次,加入300 μL胰酶消化细胞,吸弃胰酶,用收集到的培养基将细胞轻轻吹打下来,转移至离心管内,1000 ×g离心5 min,弃上清,收集细胞,用PBS 轻轻重悬细胞并计数并取1×104个细胞.依据情况加入相应的Annexin-FITC/PI/FITC结合液.室温避光放置15 min,置于4 ℃利用流式细胞仪检测凋亡情况.
2.7 细胞内蛋白表达检测
细胞经过油酸处理终点后,用冷PBS洗涤样品,并用含有蛋白酶抑制剂混合物的缓冲液裂解(RAPA∶PMSF=100∶1, PMSF母液浓度为100 μmol/L).将裂解物在4 ℃下以14 000 ×g离心15 min.用BCA蛋白定量试剂盒定量蛋白质浓度.通过SDS-PAGE分离蛋白质提取物并电转移到PVDF膜上.用TBS-T缓冲液中的5 %无脂牛奶封闭膜90 min,并在4 ℃下与一抗孵育过夜.用TBST洗涤后,将膜与二抗在室温下温育1 h.β-actin 用作内部对照.从3次实验中显示代表性印迹,并用增强的化学发光(ECL)试剂拍摄图像.
2.8 统计学方法
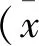
3 结 果
3.1 油酸刺激引起H9c2心肌细胞增殖抑制
通过前期实验结果验证配制油酸的溶剂本身无毒.不同浓度油酸刺激H9c2心肌细胞72 h后,所致心肌细胞增殖率呈现浓度依赖性降低趋势(图2(a));400 μmol/L 油酸刺激H9c2心肌细胞24、48、72 h后,所致心肌细胞增殖率呈现时间依赖性下降趋势(图2(b)),表明油酸可引起H9c2细胞增殖抑制.
3.2 油酸刺激引起H9c2心肌细胞内ROS的产生
为探究油酸是否会引起H9c2心肌细胞内活性氧的产生,采用DCFH-DA荧光探针利用流式细胞仪检测细胞内ROS的产生情况.与对照组相比,利用不同浓度的油酸刺激细胞后,可引起细胞内ROS升高并呈浓度依赖性(图3(a));利用400 μmol/L 的油酸刺激细胞不同时间后,可引起细胞内ROS升高并呈时间依赖性(图3(b));表明油酸可引起H9c2心肌细胞内ROS的产生.
3.3 NADPH氧化酶抑制剂降低油酸引起H9c2心肌细胞内ROS的产生
为确定油酸刺激细胞后引起ROS产生的来源,利用总活性氧抑制剂NAC、线粒体源活性氧抑制剂 mito-TEMPO 以及NADPH氧化酶抑制剂DPI与油酸联用,72 h后检测细胞ROS的产生情况. 结果表明(图4),1 mmol/L NAC与10 μmol/L DPI预处理0.5 h均可显著性降低油酸引起的ROS增加,而10 μmol/L mito-TEMPO 则不能降低油酸引起的ROS增加,说明油酸引起的H9c2细胞内ROS的产生来源于NADPH氧化酶.

与正常组相比,*P<0.05,**P<0.01.

与正常组相比,*P < 0.05,**P < 0.01.
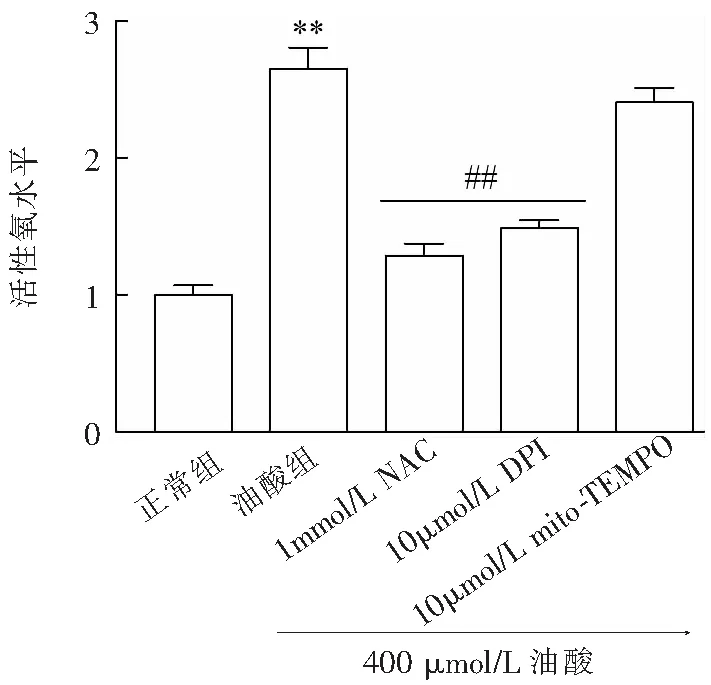
与正常组相比,**P < 0.01;与油酸组相比,##P<0.01, NS>0.05.
3.4 NADPH氧化酶抑制剂降低油酸引起H9c2心肌细胞增殖抑制
探究NADPH氧化酶抑制剂DPI是否可逆转油酸刺激后的细胞命运,对DPI作用细胞后细胞形态学进行观察与细胞活力的测定.结果表明:10 μmol/L DPI 与油酸联用后,可明显改善细胞状态(图5),通过MTT结果发现联用后可显著降低油酸引起的细胞增殖抑制(图6),提示NADPH氧化酶合成的ROS参与油酸诱导的H9c2心肌细胞增殖抑制.

图5 DPI对油酸致H9c2心肌细胞形态学变化的影响

与正常组相比, **P < 0.01;与油酸组相比,#P < 0.05, NS > 0.05.
3.5 NADPH氧化酶抑制剂抑制油酸引起H9c2心肌细胞凋亡
3.5.1 Western blot 法检测细胞凋亡 Bcl-2 家族成员与Caspase 3剪切在细胞凋亡过程中起到至关重要的作用.为确定油酸引起H9c2心肌细胞的死亡机制,利用western blot 法检测Caspase 3 剪切、Bax、Bcl-2蛋白变化.结果表明:与对照组相比,油酸可明显增加Caspase 3 剪切水平(图7),同时降低了Bcl-2/Bax蛋白表达水平(图8),提示油酸可诱导H9c2心肌细胞凋亡;采用DPI预处理0.5 h后可明显降低油酸诱导的Caspase 3 剪切水平,并且增加了Bcl-2/Bax蛋白表达变化.

与正常组相比, **P < 0.01;与油酸组相比,##P < 0.01.

与正常组相比, **P < 0.01;与油酸组相比,#P < 0.05.
3.5.2 流式细胞术检测细胞凋亡 利用早期凋亡细胞中出现磷脂酰丝氨酸外翻的原理进行凋亡的检测,利用Annexin V / PI双染后流式细胞术测定凋亡时相来检测细胞凋亡程度.结果表明:与对照组相比,油酸可引起凋亡数量明显增加,采用DPI预处理0.5 h后可明显降低油酸诱导心肌细胞凋亡数量(图9、图10),提示NADPH氧化酶所产生的ROS参与油酸诱导的H9c2心肌细胞凋亡.
4 讨 论
脂毒性作为一种危险因素,可对心肌细胞造成不可逆的损伤,同时导致心肌细胞结构与功能均发生改变,增加细胞凋亡.已有研究表明棕榈酸可对H9c2心肌细胞造成脂毒性,并且能够诱导细胞凋亡[17-18],而不饱和脂肪酸对心肌是否有毒性作用却未见报道.本研究利用油酸进行心肌脂毒性的机制探讨,为糖尿病心肌病的防治提供新的思路.
图9 DPI对油酸致H9c2心肌细胞凋亡的影响(3次独立重复实验中代表性图片)
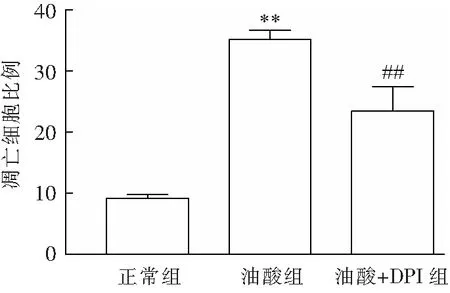
与正常组相比,**P < 0.01;与油酸组相比,##P < 0.01.
研究表明,由氧化胁迫导致的心肌细胞凋亡是糖尿病患者非缺血性心力衰竭发生的重要原因[19].糖尿病心血管系统中有多种ROS来源,其中包括线粒体电子传递链,NADPH氧化酶和其他酶类.糖尿病发病过程中,糖脂代谢紊乱是引起心肌功能障碍的重要原因.已有研究表明,NADPH氧化酶在高糖诱导的心肌细胞损伤中发挥重要的作用,同时也参与由高脂诱导的MIN6胰岛β细胞凋亡[20-21],而NADPH氧化酶在高脂诱导的心肌细胞损伤中的作用也未见报道.本研究利用油酸刺激H9c2心肌细胞,在非靶向抗氧化剂NAC、线粒体靶向抗氧化剂mito-TEMPO以及NADPH氧化酶抑制剂DPI联合油酸的作用下,证实了油酸致细胞氧化胁迫的源头为NADPH氧化酶,表明了NADPH氧化酶来源的ROS介导了油酸的细胞毒活性.
细胞凋亡作为一种细胞程序性死亡,由众多基因参与其调控.从糖尿病动物实验研究提示,心肌细胞凋亡在糖尿病心肌病的发展过程中具有重要的作用,其中Bcl-2家族与Caspase家族为细胞凋亡研究中的重点,Bcl-2作为一种抗凋亡因子,而Bax是一种促凋亡因子,正常生理状态下Bcl-2与Bax在细胞中保持动态平衡,对细胞命运的改变具有重要意义.Caspase家族蛋白引发的级联反应也控制着细胞凋亡过程.本研究显示,用400 μmol/L的油酸刺激H9c2心肌细胞72 h后, Caspase 3剪切以及Bcl-2/Bax比值增加,而在NADPH氧化酶抑制剂DPI与油酸联用下可逆转上述结果,提示NADPH氧化酶的激活参与心肌细胞凋亡.
综上所述,油酸刺激可抑制H9c2心肌细胞的增殖、氧化胁迫增加并诱导细胞走向死亡,但其确切机制尚未阐明.糖尿病的发病过程中不仅是心肌细胞受损,同时伴随着胰岛β细胞等发生凋亡[22].机体内能量平衡极为重要,线粒体作为细胞内能量制造中心,可维持细胞正常运转.脂肪酸氧化的场所是线粒体,油酸刺激或可引起线粒体功能受损.过量脂肪酸通过β氧化产生大量的乙酰辅酶A,高水平的还原粒将线粒体内膜的泛醌还原为氢醌,并产生大量活性氧.而高水平的ROS可直接损伤线粒体DNA,线粒体生物发生过程受到抑制,导致线粒体膜通透性转换孔打开,细胞色素C释放到胞质中从而引起Caspase家族引起级联反应,致使细胞凋亡.这为脂毒性损伤细胞确切机制的研究提供了新的思路.
5 结 论
高脂刺激可诱导心肌细胞发生氧化胁迫损伤,并确定其发生氧化胁迫源头为 NADPH 氧化酶.高脂刺激可引起心肌细胞增殖抑制,并呈时间与浓度依赖性的方式诱导心肌细胞凋亡,最终致使心肌细胞走向死亡.

