重金属铜胁迫下小珊瑚藻差异蛋白的双向电泳分析
王小蓓,刘 庆,王秀静,李丽霞
(烟台大学生命科学学院,山东 烟台 264005)
近年来,由于不合理的工业和农业生产,海洋近海岸带遭受较为严重的重金属污染[1].潮间带大型海藻栖息于潮间带这一特殊的地理位置,海水重金属污染是其不可避免要应对的环境压力.双向电泳技术(two-dimensional electrophoresis,2-DE)作为蛋白质组研究中三大核心技术之一,是广泛用于分离蛋白质的优选途径,在鉴定蛋白质差异表达方面具有显著优势[2-3].利用蛋白质组学对海洋生物的研究亦方兴未艾[4-5],利用该技术可对在不同环境胁迫下的生物体进行比较研究,确定与处理效应相关的特异性蛋白,全面深刻地了解胁迫的各种影响.小珊瑚藻(Corallinapilulifera)栖息于潮间带中潮带岩礁上或石沼内,是潮间带大型海藻的一种常见类型,具有良好的综合应用价值[6].本研究利用蛋白质双向电泳和质谱分析技术,提取正常培养和各浓度铜处理下的藻蛋白,通过分析藻体内可溶性蛋白种类及表达强度的变化,剖析铜胁迫因素与蛋白表达趋势的相关性问题,进一步在蛋白质水平上了解海藻生理机能及代谢过程与环境条件之间的相互关系,为小珊瑚藻抗铜机制的探究及研发海洋环境的监测途径提供一定的理论依据.
1 材料与方法
1.1 试验材料
烟台月亮湾海域采集的礁石上生长旺盛的新鲜小珊瑚藻.
1.2 试验方法
1.2.1 材料准备 挑选生长旺盛的新鲜小珊瑚藻,迅速带回实验室,灭菌海水仔细洗去沉积物及附着杂质,约30 g 鲜重小珊瑚藻作为一个处理,培养于盛有2.5 L 灭菌海水的透明玻璃缸中,海水持续充气并每日更换.经过3 d预培养后,海藻材料接受铜胁迫处理.根据我国污水综合排放标准规定及预实验的结果, 设置3个铜处理浓度(一级投放标准铜浓度 0.5 mg/L 的1/2倍、1倍及2倍),将小珊瑚藻分别置于Cu2+浓度为 0.25、0.5及1.0 mg/L 的灭菌海水中培养.对照组置于正常灭菌海水中充气培养,处理组和对照组各设置3次重复.处理6 d后,为减少实验误差,控制实验因素,选取长势一致对照组和处理组的藻段,于液氮速冻后-80 ℃冷藏备用.
1.2.2 样品蛋白质的提取 蛋白质的提取采用酚抽提法[7],并进行了部分改进.海藻中加入1 mL 10%预冷三氯乙酸(TCA)丙酮提取液,用细胞破碎机破碎;匀浆中加入8 mL TCA丙酮提取液,4 ℃下15 000 r/min 离心20 min,去上清加入10 mL 预冷丙酮重复上一步骤1次;冰上干燥,加入4 mL 酚抽提液(30% 蔗糖, 0.25 mol/L Tris-HCL, pH值8.0, 0.05 mol/L EDTA-Na, 0.1 mol/L KCL, 2% SDS, 0.02 mol/L 二硫苏糖醇(DTT)),混匀;加入4 mL Tris-丙酮-酚,4 ℃下混匀1 h;4 ℃下15 000 r/min离心20 min,取上层酚层溶液于另一支15 mL离心管中;加入3倍体积的0.1 mol/L醋酸铵甲醇溶液,-20 ℃沉淀1 h;4 ℃下15 000 r/min离心20 min取沉淀,加入1 mL丙酮(含0.02 mol/L DTT),4 ℃下15 000 r/min离心10 min,重复2次.-20 ℃冰箱干燥10 min;将干燥的粉末溶于样品裂解液中,30 ℃恒温水浴充分溶解蛋白,加10 μL两性电解质(IPG buffer);室温下15 000 r/min离心10 min取上清,并再次离心,充分去除杂质.蛋白质浓度测定参照Bradford[8]的方法进行.
1.2.3 蛋白质双向电泳 本实验采用17 cm pH值为4~7的线型预制胶条,聚丙烯酰胺凝胶浓度为12.5%,蛋白上样量为300 μg,各项具体操作依据Holloway and Arundel[9]的方法进行.采用考染法对凝胶进行染色,并进行下一步分析.
1.2.4 图像采集与分析 采用透射模式分辨率300 dpi进行扫描,图像用PDQuest Advanced 8.0.1进行分析,分别创建对照组和处理组进行组内和组间分析.
1.2.5 差异蛋白质MALDI-TOF-MS鉴定 将软件分析确定的差异蛋白点用切胶笔手动切割下来置于1 mL离心管中,交给上海博苑基因公司进行样品的漂洗、脱色、冻干、酶解,进行MALDI-TOF-MS鉴定,通过Mascot软件在数据库中进行比对.
2 结果与分析
2.1 小珊瑚藻蛋白表达谱的差异分析
Cu2+处理后小珊瑚藻藻体蛋白的双向电泳图谱如图1所示.使用PDQuest Advanced 8.0.1软件对电泳图谱进行分析,鉴定出4组蛋白质点数分别为220个、341个、278个及96个.当Cu2+处理浓度为0.25 mg/L时,小珊瑚藻产生的部分蛋白表达丰度显著增加,样品中的蛋白点数量亦达到顶峰;随Cu2+处理浓度升高至0.5 mg/L,可检测的蛋白点数目逐步减少;当Cu2+浓度达到1.0 mg/L时,蛋白点的大小和数量出现显著下降,部分蛋白甚至消失,胁迫体现为明显的“低促高抑”效应.
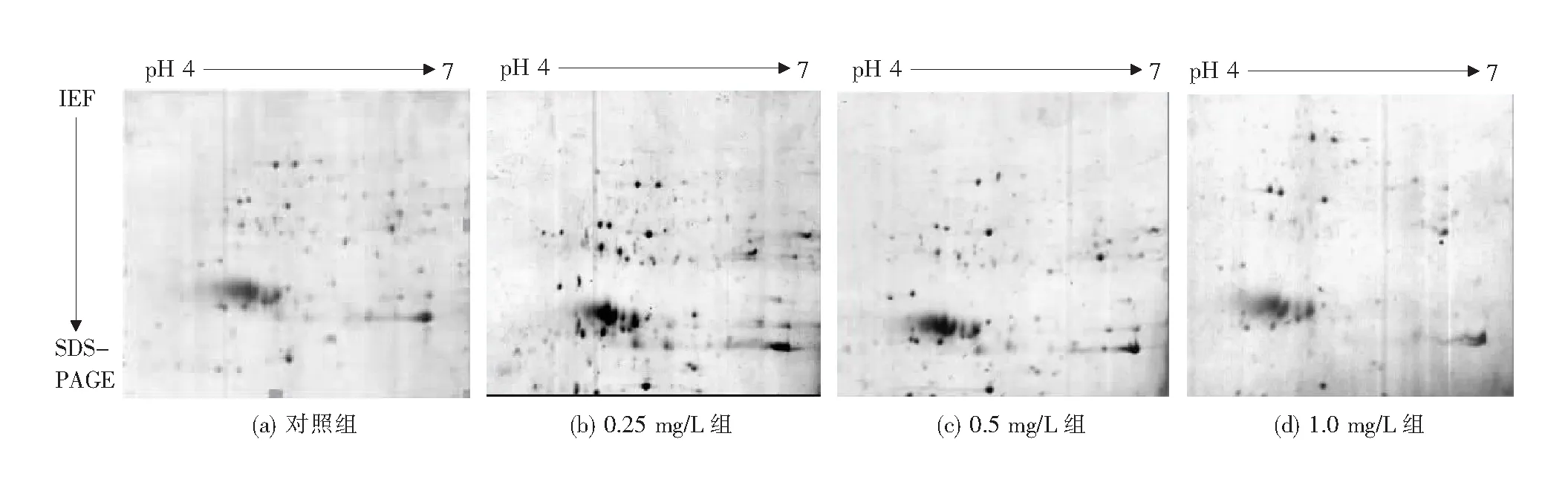
图1 小珊瑚藻藻体蛋白双向电泳图谱
不同处理后小珊瑚藻相应的蛋白浓度测定值见图2.由图2可知,0.25 mg/L处理下蛋白浓度与对照组间的差异有统计学意义(P<0.05).在最高浓度(1.0 mg/L)处理下,蛋白质浓度与对照组相比显著下降(P<0.05),而0.5 mg/L处理下蛋白浓度与对照组间浓度差异无统计学意义(P>0.05).
鉴于小珊瑚藻在0.25 mg/L胁迫处理后蛋白表达丰度增加最为显著,因此选择该处理图谱与对照组图谱进行了对比分析,二者在不同的分子质量和等电点的数量分布见图3.由图3可见,小珊瑚藻的蛋白点均集中在分子质量14~75 kU及等电点4.5~6.5之间,0.25 mg/L处理组的蛋白点数量在各范围内较对照组均有显著增加,分布趋势基本一致.

图2 不同浓度铜处理下小珊瑚藻的蛋白质浓度变化
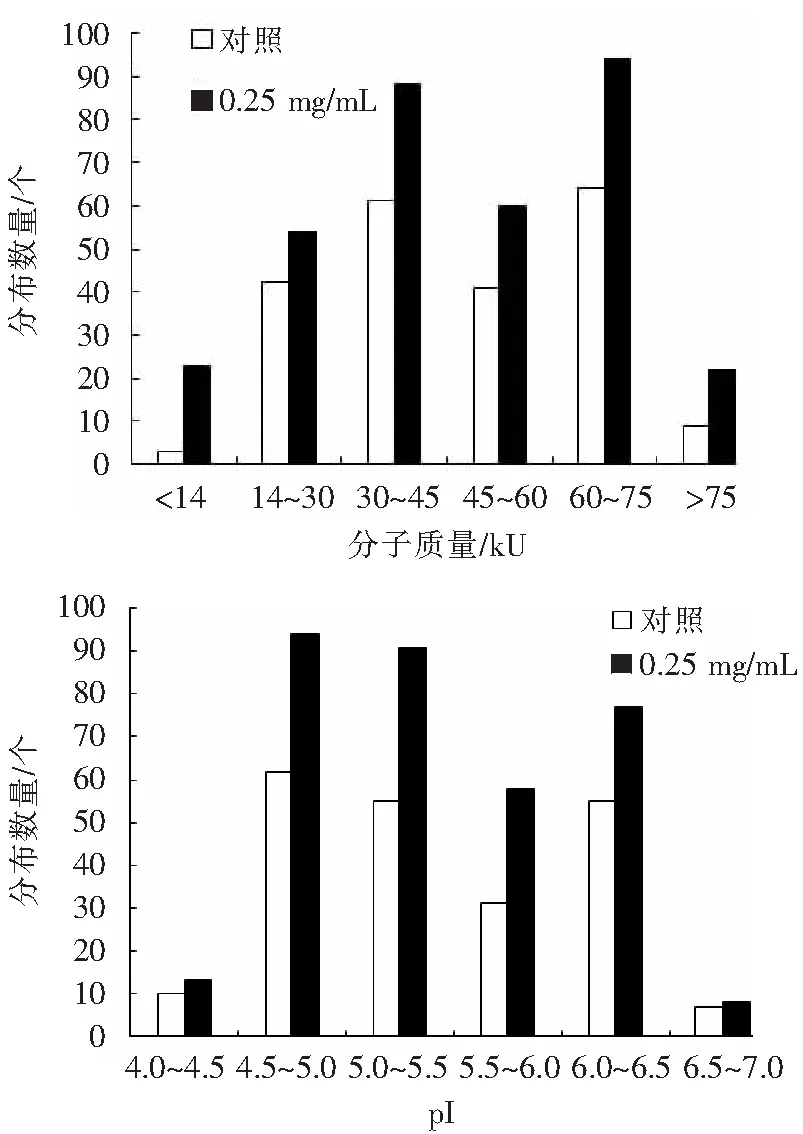
图3 对照组和0.25 mg/L组的蛋白点在不同分子质量和等电点的数量分布
继续以0.25 mg/L处理组电泳图谱为分析模板,选择差异大于2.5倍的点为显著差异点,共识别49个差异蛋白,其中34个表达上调,15个表达下调,蛋白表达柱形图结果见图4.对照组与0.25 mg/L处理组中蛋白点SSP4601与蛋白点SSP4302的差异表达对比放大图及立体图如图5所示.
2.2 差异蛋白点的MALDI-TOF-MS鉴定结果
从0.25 mg/L组差异蛋白中继续筛选出7个丰度较高的蛋白点(图6)进行MALDI-TOF-MS鉴定,成功鉴定出4个阳性结果(表1): ABC转运蛋白(SSP4601),超氧化物歧化酶(SSP8401),叶绿素外在蛋白(SSP3305),保守假定蛋白(SSP4302).这些蛋白可能通过清除活性氧、参与防卫反应及转录后调控等多种方式在藻体抵御Cu2+胁迫的影响中发挥作用.

图4 对照组和0.25 mg/L处理组的蛋白点表达量变化

图5 对照组和0.25 mg/L处理组蛋白点的差异表达

图6 7个差异蛋白图谱
3 讨 论
蛋白质组学研究为后基因组时代的重要研究领域,双向电泳作为一种简单、高效、快速分离蛋白的方法在研究中广泛应用.双向电泳对蛋白质样品的浓度及纯度要求较高,蛋白质样品的制备对于蛋白质组学是否成功有着至关重要的影响[10-11].
经过多次预实验的比较,本研究采用改良后的酚抽提法进行小珊瑚藻蛋白的提取,所提取的蛋白质浓度及纯度有明显提高,钙质等杂质成分显著减少,2-DE图谱中的蛋白点数明显增多,横纵条纹大幅减少,且二位图谱背景也比较清晰.因此,改良后的酚抽提法更适合于小珊瑚藻蛋白的提取.
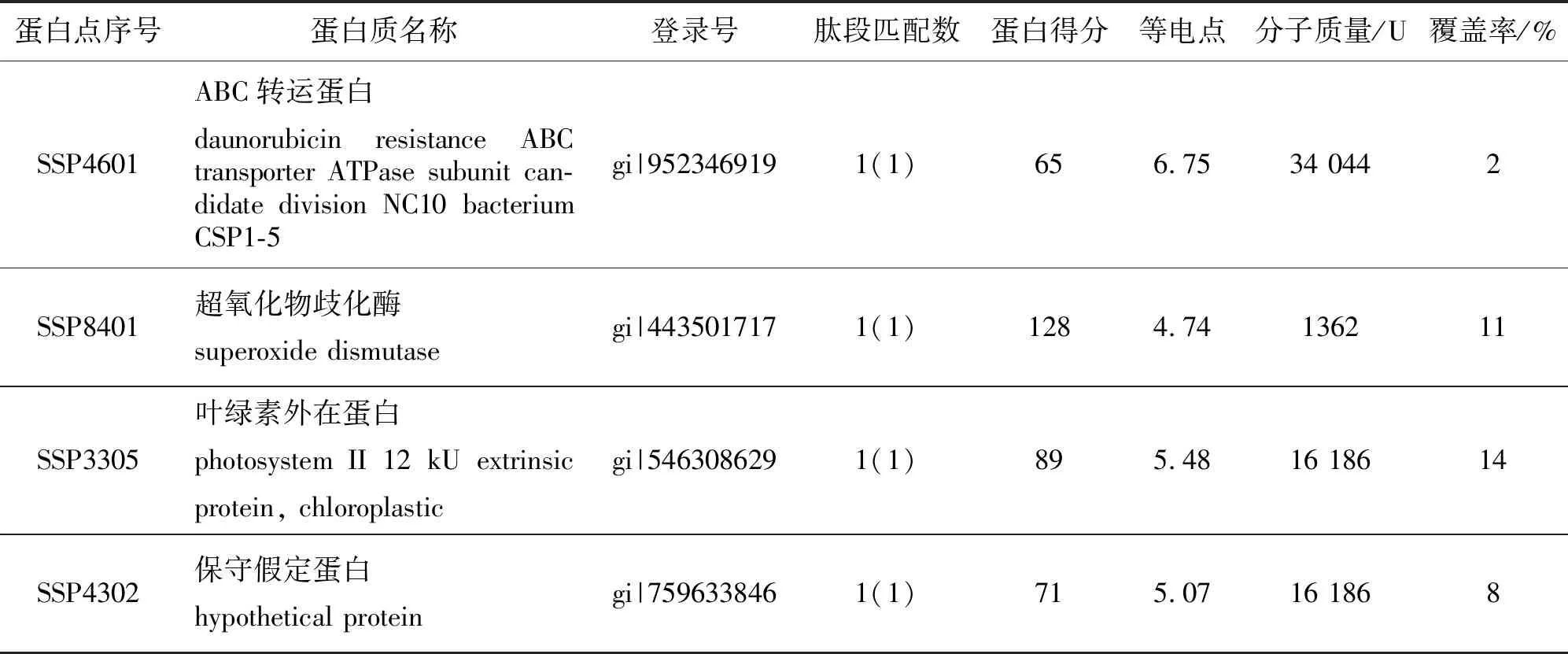
表1 小珊瑚藻差异蛋白的质谱鉴定结果
ABC转运蛋白是生物体中最大的蛋白家族之一,含有1~2个接合核苷酸的域(NBDS)和跨膜域(TMD),通过形成二聚体或多聚体来实现功能.此类蛋白的共同点是序列上含有所谓的接合ATP的盒,这个序列盒通过与ATP的接合和解离来调节物质的跨膜运输[12].ABC转运蛋白在植物体内对脂质、生长素、次生代谢物和异源物质的运输及解毒有一定作用,尤其是在维持K+的细胞内稳态机制方面有作用.本试验中鉴定出的该蛋白表达丰度上调,说明Cu2+离子的胁迫后,小珊瑚藻细胞通过调整转运蛋白代谢水平以维持细胞内外的渗透压平衡.

此外,与脂双层疏水部分相连接的外在蛋白和光系统Ⅱ(PSⅡ)中叶绿体光电子的传递均受Cu2+的影响,当环境中Cu2+的浓度过高时会破坏PSⅡ供体位点的放氧复合体蛋白,使光反应PSⅡ的活性丧失,放氧能力也丧失[18].AGGARWAL等报道海水中铜对藻类的光合作用的主要影响与叶绿体色素组成和超微结构的变化、净光合速率的降低,核酮糖-1,5-二磷酸羧化酶/加氧酶的降低有关,抑制了电子传递和PSⅡ的活动[19].高政权[20]2005年报道首次在大型海洋红藻条斑紫菜(PorphyrayezoensisUdea)PSⅡ中发现20 kU 蛋白.此外,在条斑紫菜叶状体PSⅡ中还发现了14 kU和16 kU 2种新蛋白,但未检测到广泛存在于单细胞红藻和蓝藻 12 kU 蛋白,而本研究中鉴定蛋白点SSP3305为PSⅡ12 kU外在蛋白,这也是潮间带大型红藻小珊瑚藻中发现此类蛋白的首次报道,而此种外在蛋白的高级结构组成及小珊瑚藻受到Cu2+离子胁迫时细胞内光合生理代谢变化规律,还需要进一步的研究探索.
4 结 论
本研究表明,Cu2+能对小珊瑚藻蛋白表达产生显著影响,0.25 mg/L Cu2+处理下蛋白浓度与对照间达到差异显著水平,而在最高浓度1.0 mg/L Cu2+处理下,蛋白质浓度比对照显著下降,表现为 “低促高抑”效应;0.25 mg/L Cu2+处理组蛋白2D图谱与对照差异最为显著;质谱分析鉴定出4个阳性结果,分别为ABC转运蛋白,SOD,PSⅡ12 kU外在蛋白,保守假定蛋白.本研究通过分析Cu2+处理下小珊瑚藻蛋白种类及表达丰度的变化,解析重金属Cu2+梯度浓度与蛋白表达的相关性,可进一步为小珊瑚藻抗铜胁迫的应激反应及外界胁迫环境条件间的互作关系研究奠定基础.

