茶硝香酰胺联合吉非替尼对人非小细胞肺癌迁移的影响
石晓玉,张 燕,孙彦莉,盖 静,刘 昆,张国营
(烟台大学药学院分子药理实验室,烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005)
根据2018年Global Cancer的调查,肺癌的发病率和死亡率均位居首位[1].其中非小细胞肺癌占肺癌的85%左右,患者5年生存率不到20%[2].肺癌的治疗方式以手术切除联合放化疗为主,以及靶向治疗,免疫治疗等[3-5].吉非替尼作为表皮生长因子受体酪氨酸酶抑制剂(EGFR-TKIs)代表药而被广泛应用[6-7],但同时也伴随着耐药[8]和毒副作用,加上肺癌极易转移导致患者的预后差[9].报道称肺癌细胞容易通过发生上皮-间质转化(EMT,epithelial-to-mesenchymal transition)提高其迁移能力.茶氨酸是具有抗焦虑、抗衰老、增强抗癌药物的效用等诸多生理功能[10-13]的氨基酸,茶氨酸和其衍生物具有抗多种肿瘤的活性[14-15].前期实验[16]可知茶硝香酰胺(TNC,图1)属于茶氨酸衍生物,并且可能是通过EGFR/VEGFR-Akt/NF-κB信号通路发挥抑制作用,但TNC对人非小细胞肺癌细胞的影响和其作用的分子机制及其临床应用潜力尚不明了,本实验拟通过考察TNC与吉非替尼联合使用对A549细胞迁移能力的影响,分析是否显著增强吉非替尼抑制A549细胞远处转移的潜力,结合前期实验结果,通过设置Ly(PI3K/AKT通路抑制剂),Bay(NF-κB通路抑制剂)2组阳性对照,来探究两者合用可能影响的信号通路,为TNC的进一步开发应用、解决如何有效抑制临床非小细胞肺癌转移的难题以及吉非替尼的毒副作用提供新方法新思路.

图1 茶硝香酰胺化学结构式
1 材料与方法
1.1 实验材料
A549细胞系购于中国医学科学院药物研究所;本实验室自主合成的茶硝香酰胺(TNC);Hyclone公司的DMEM高糖培养基;从Sigma公司购买的胎牛血清(FBS)、胰蛋白酶、表皮生长因子(EGF)以及肝细胞生长因子(HGF);购于碧云天公司的彩色预染蛋白Marker,ECL Star发光试剂盒,BCA蛋白浓度测定试剂盒,PI3K/AKT通路抑制剂Ly,NF-κB通路抑制剂Bay,结晶紫染色液;所用一抗和HRP标记二抗购于Santa Cruz Technology.
1.2 实验仪器
细胞恒温培养箱(3111型,美国Thermo公司);培养皿(美国BD公司);倒置荧光显微镜(日本尼康公司 TE200-U型);小型湿转电泳槽 (美国BIO-RAD公司);冷冻离心机(深圳市迈斯艾尔科技发展有限公司).
1.3 实验方法
1.3.1 细胞常规培养 根据常规操作,将冻存细胞于温水中快速融化,离心,加入完全培养液(含双抗和10% 胎牛血清的DMEM培养基)于37 ℃,5% CO2培养箱培养.细胞长至培养皿80%~90%时,胰蛋白酶消化,离心,传代.
1.3.2 四甲基偶氮唑盐法检测TNC与吉非替尼联合使用对A549细胞生长的影响 取状况良好的A549细胞,调整浓度4×103个/孔均匀加至96孔板,24 h后加药.配制TNC和吉非替尼至5个浓度,单独以及交叉组合加药,另外设阳性药物Bay(NF-κB通路抑制剂)和Ly(PI3K/AKT通路抑制剂)组和对照组,每组设3个复孔.加药培养24 h后,每孔加MTT孵育4 h后加DMSO溶液,15 min后于酶标仪570 nm处检测吸光度A,以空白对照组吸光度为标准,计算细胞相对生长率:
相对生长率=(A加药组/A对照组)×100%.
1.3.3 细胞划痕法检测TNC与吉非替尼联合使用前后对A549细胞迁移的影响 取状态良好的A549细胞,以7×105/皿的细胞浓度接种在6孔板中.培养24 h后,弃去培养液,洗涤,用无菌枪头匀速划线.再次洗涤后于倒置荧光显微镜下拍照,记为0 h.根据预实验,分别设置对照组,吉非替尼组(25 μmol/L),TNC组(125 μmol/L),联合组(25 μmol/L 吉非替尼+125 μmol/L TNC)和阳性对照组Ly(25 μmol/L)、Bay(3 μmol/L).每组使用含2%胎牛血清培养液培养24 h后定点拍照,使用ImageJ软件计算照片中的划痕面积,计算细胞相对迁移率:
细胞相对迁移率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%.
1.3.4 Transwell检测TNC联合吉非替尼对发生EMT的A549细胞迁移能力的影响 参考文献[19-22],用EGF和HGF刺激A549细胞发生EMT,取状况良好A549细胞接种于6孔板中,待细胞长至50%,饥饿24 h换成含EGF(20 ng/mL)和HGF(80 ng/mL)的2% FBS培养液,2 d换1次液.观察细胞,每隔24 h拍照记录细胞形态变化.诱导实验成功后,参考文献[23],将发生EMT的A549细胞和未刺激的A549细胞同时饥饿24 h后,调整浓度为2.5×105个/mL,加入小室的上室中,下室加完全培养基,诱导迁移.将发生EMT的A549细胞(EGF+HGF)视为模型组,在模型组中设置空白模型组,TNC+模型组,吉非替尼+模型组,TNC+吉非替尼+模型组,同时对于未进行EMT诱导实验的A549细胞,设置相同组别以便观察,另设阳性对照组PI3K/AKT通路抑制剂Ly(25 μmol/L)、NF-κB通路抑制剂Bay(3 μmol/L).培养6 h后吸走上清,PBS清洗,甲醇固定,风干,用棉棒擦去没有通过的细胞,加结晶紫染色15 min,于倒置荧光显微镜下随机选择5个视野拍照,计数,记录其迁移情况,计算细胞相对迁移率:
细胞相对迁移率=处理组迁移细胞数/空白对照组迁移细胞数×100%.
1.3.5 Western Blotting法检测TNC与吉非替尼联合对非小细胞肺癌A549细胞相关蛋白表达的影响 按照常规操作,提取上述各组A549细胞总蛋白,使用BCA试剂盒确定蛋白浓度后计算上样体积分装.每管加Loading Buffer后预处理蛋白,取出配制好的凝胶上样,电泳,转膜,使用15%脱脂牛奶封闭,2 h后洗脱牛奶后封闭一抗,过夜孵育.次日,TBST洗膜3次后,封二抗1 h后洗膜,使用ECL发光检测仪器检测捕捉条带,使用Quantity One软件扫描分析条带灰度,以GAPDH为内参蛋白,检测目的蛋白表达情况.

2 实验结果
2.1 TNC与吉非替尼联合使用对A549细胞生长的影响
由图2可见,24 h时,较高浓度联合方案中25 μmol/L吉非替尼和125 μmol/L TNC及125 μmol/L以下浓度的TNC对细胞生长的影响无统计学意义.
2.2 TNC与吉非替尼联合使用对A549细胞迁移的影响
如图3所示,由预实验确定联合浓度,与对照组相比,其他各组细胞迁移率的降低均有统计学意义(*P<0.05),24 h时25 μmol/L 吉非替尼组A549细胞相对迁移率为64.86%,125 μmol/L TNC组细胞相对迁移率为73.73%,与25 μmol/L吉非替尼联合组细胞相对迁移率降低为51.26%,统计学分析结果表明:25 μmol/L 吉非替尼与125 μmol/L TNC联合组对比吉非替尼单药组,可增强对A549细胞迁移的抑制作用,有统计学意义,且其抑制程度与阳性对照组PI3K/AKT通路抑制剂Ly和NF-κB通路抑制剂Bay相近.

代表与单一TNC组相比,*P<0.05.

代表与对照组相比,**P<0.01, ***P<0.001;#代表与单药组相比,###P<0.001.
2.3 EGF联合HGF诱导A549发生EMT细胞形态变化
由图4可知,EGF联合HGF可诱导A549细胞发生上皮间质转化,细胞间隙变大,细胞由典型铺路石状变为长梭型,纺锤状,提示EMT诱导实验成功,由图5可见TNC和吉非替尼可抑制EGF和HGF联合诱导的EMT过程.

图4 EGF联合HGF刺激促进A549细胞发生EMT细胞形态变化

图5 EMT诱导实验中不同处理组A549细胞形态图
2.4 TNC联合吉非替尼对加速发生EMT的A549细胞迁移的抑制作用
从图6可观察到:在未刺激的A549组中,与对照组相比,TNC组和吉非替尼组迁移的细胞数量明显减少,联合用药组迁移的细胞数较单药组更少,细胞相对迁移率降低至42.71%;在EGF和HGF联合刺激的模型组中,双生长因子刺激模型组细胞相对迁移率提高至135.9%,TNC、吉非替尼、联合用药组细胞相对迁移率则显著降低,分别降低至61.45%、74.13%和49.48%.阳性对照Ly和Bay也显著抑制EGF和HGF联合刺激的A549细胞EMT和迁移.
2.5 TNC联合吉非替尼对A549细胞相关蛋白表达的影响
2.5.1 TNC与吉非替尼联合使用对A549细胞HGF、c-MET表达的影响 如图7所示,单独使用TNC(125 μmol/L)、吉非替尼(25 μmol/L)以及两者联合可显著下调肝细胞生长因子HGF,受体酪氨酸激酶c-MET蛋白表达水平.而且在模型组(EGF+HGF刺激组)中,上述蛋白变化情况相似,与单一处理组相比均有统计学意义.
2.5.2 TNC与吉非替尼联合使用对A549细胞EGF、EGFR、K-Ras表达的影响 如图8所示,单独使用TNC、吉非替尼和两者联合可显著下调EGF及其受体EGFR蛋白和K-Ras表达水平.而且在模型组(EGF+HGF)中,上述蛋白变化情况相似,与单一处理组相比均有统计学意义.

代表与空白对照组相比,***P<0.001,&代表与各单药组相比,&P<0.05;#代表与模型组相比,
2.5.3 TNC与吉非替尼联合使用对A549细胞AKT蛋白表达的影响 如图9所示,未使用EGF+HGF刺激组中,联合组的AKT蛋白下调至49.43%;使用EGF+HGF刺激组中,联合组AKT蛋白表达量低至45.55%,与此同时,阳性对照Ly组使其下调至30.59%.虽然TNC和吉非替尼单独作用均可显著减少AKT蛋白的表达,但联合用药组抑制作用更显著.
2.5.4 TNC与吉非替尼联合使用对A549细胞NF-κB蛋白表达的影响 如图10所示,在模型组和正常组中,TNC、吉非替尼、TNC+吉非替尼均显著下调NF-κB蛋白表达水平,其联合用药组(TNC+吉非替尼、模型+TNC+吉非替尼)与对应的对照组相比,NF-κB蛋白表达下降程度较单药组显著增强,分别降低了52.75%和49.46%,Ly组下调了56.33%,两者影响程度无统计学意义.

代表与空白对照组相比,**P<0.001,***P<0.001;&代表与各单药组相比,&P<0.001;#代表与模型组相比,#P<0.001;$代表与模型组中的各单药组相比,$P<0.001.
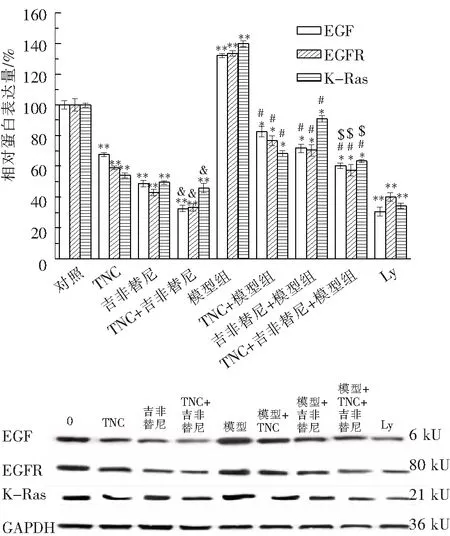
代表与空白对照组相比,*P<0.005,***P<0.001;&代表与各单药组相比,&P<0.05;#代表与模型组相比,P<0.001;$代表与模型组中的各单药组相比,#P<0.001.

代表与空白对照组相比,*P<0.005,***P<0.001;&代表与各单药组相比,&P<0.005;#代表与模型组相比,##P<0.01;$代表与模型组中的各单药组相比,$P<0.005.

代表与空白对照组相比,*P<0.005,**P<0.001,***P<0.001;&代表与各单药组相比,&P<0.005;#代表与模型组相比,##P<0.01;$代表与模型组中的各单药组相比,$P<0.005.
2.5.5 TNC与吉非替尼联合使用对A549细胞E-Cadherin、Vimentin蛋白表达的影响 如图11所示,在模型组和正常实验组中,上皮细胞标志物E-Cadherin表达水平显著性增加,波形蛋白Vimentin表达水平明显降低,且联合组的影响程度较单一药物组更显著,与阳性对照Ly影响程度几乎持平.

代表与空白对照组相比,*P<0.05,**P<0.001,***P<0.001;&代表与各单药组相比,&P<0.001;#代表与模型组相比,###P<0.001;$代表与模型组中的各单药组相比,$P<0.005.
2.5.6 TNC与吉非替尼联合使用对A549细胞N-Cadherin、Slug蛋白表达影响 如图12所示,各用药组均下调N-Cadherin、Slug的蛋白表达量,与同组别的单一用药组相比,联合组下调蛋白表达水平的能力显著增强.
2.5.7 TNC与吉非替尼联合使用对A549细胞ZEB、Twist、Snail蛋白表达影响 如图13所示,在加速EMT的模型组和正常实验组中,锌指转录因子家族ZEB、Twist和Snail表达水平明显降低,且联合组的影响程度较单一药物组更显著,阳性对照Ly也展示显著性的抑制作用.
3 讨论与结论
非小细胞肺癌占肺癌的80%,起初症状不明显,一旦发现往往是中晚期.远处转移是肺癌患者死亡的重要原因,而针对转移性肺癌患者的有效治疗方案很缺乏,术后生存率极低.吉非替尼作为代表性的表皮生长因子受体酪氨酸酶抑制剂(EGFR-TKIs)类小分子靶向药物而熟知,但随着应用的不断扩大,其逐渐出现的耐药性和毒副作用不容忽视,为了避免药物本身存在的不足,临床上往往采用多种药物联合使用的方案来达到最佳的治疗效果.

代表与空白对照组相比,***P<0.001;&代表与各单药组相比,&P<0.001;#代表与模型组相比,##P<0.01;$代表与模型组中的各单药组相比,$P<0.001.
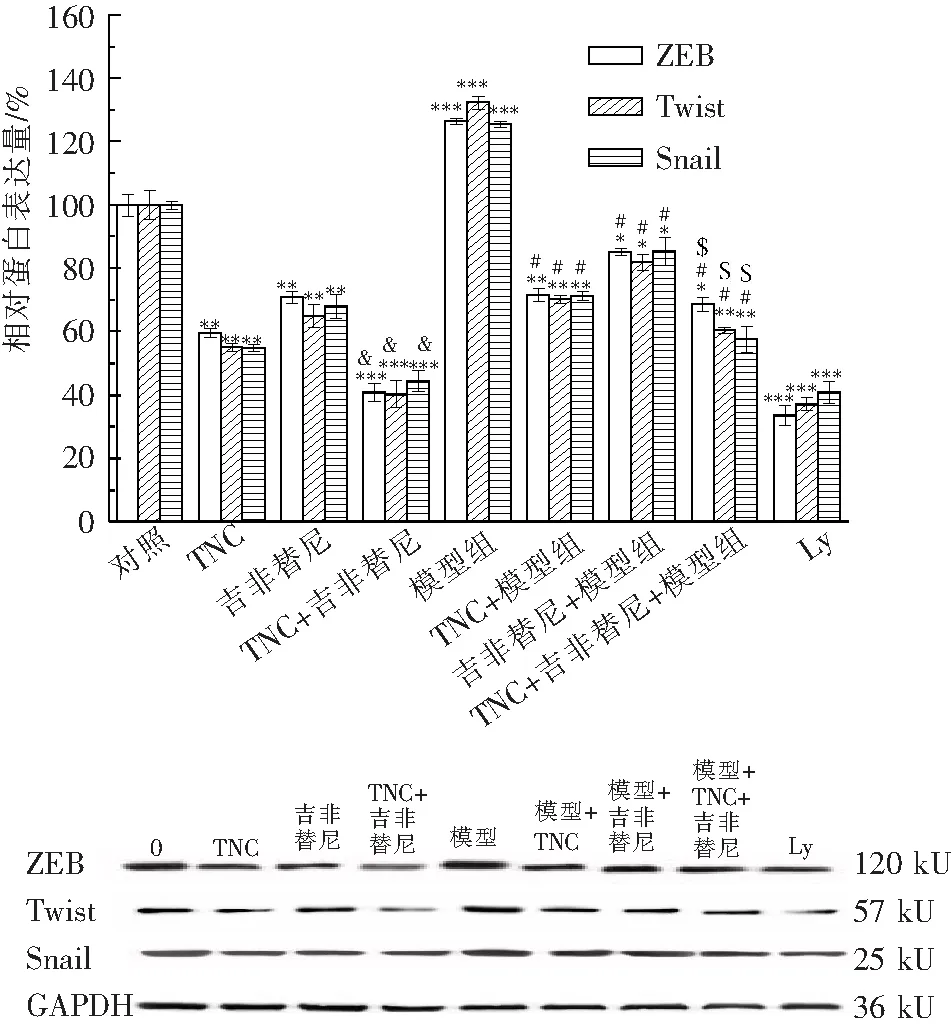
代表与空白对照组相比,***P<0.001,&代表与各单药组相比,&P<0.001;#代表与模型组相比,###P<0.001;$代表与模型组中的各单药组相比,$P<0.001.
茶硝香酰胺TNC属于茶氨酸衍生物,单独或联合抗癌药物使用均有良好的抗肿瘤活性.实验室前期工作已经证实TNC对A549细胞生长和迁移具有抑制作用,并且可能是通过影响AKT或NF-κB信号通路发挥作用.由MTT实验结果可知:24 h时除250 μmol/L TNC联合25 μmol/L吉非替尼对A549细胞的生长有较弱的影响外,其他联合浓度在24 h对A549细胞生长无显著性影响,在此基础上,本实验主要探究TNC能否提高吉非替尼对A549细胞迁移的抑制作用和其作用的分子机制,排除高浓度对细胞生长的影响,结合预实验我们选择125 μmol/L TNC联合25 μmol/L吉非替尼进行实验.划痕实验结果可以发现:TNC联合吉非替尼对A549细胞迁移抑制作用显著优于单独应用同等剂量的吉非替尼,25 μmol/L 吉非替尼组细胞相对迁移率为64.86%,而加入TNC的联合组细胞相对迁移率降低至51.26%,对A549细胞迁移的抑制率显著提高;在后续的Transwell实验中,吉非替尼组细胞相对迁移率为56.59%,而联合用药组细胞相对迁移率降低至42.71%,提示TNC可显著提高吉非替尼对A549细胞迁移的抑制作用.Transwell实验结果同样发现:在EMT模型组中,TNC和吉非替尼均可以抑制A549细胞的迁移能力,且联合用药组的抑制率较单药组显著提高.此外,本研究采用Western Blotting实验检测相关蛋白的表达水平,进一步解析其可能作用的分子机制.
EMT是肿瘤远处转移的关键步骤之一[17],与肿瘤细胞的迁移密切相关[18],其中上皮细胞标志物E-Cadherin、间质细胞标志物波形蛋白Vimentin和N-钙黏着蛋白N-Cadherin公认为细胞发生EMT过程的重要标志[24],其中可以抑制E-Cadherin表达的转录因子家族也逐渐成为研究EMT过程的重要内容,其中包含锌指转录因子家族成员Slug、Snail、碱性螺旋-环-螺旋家族成员Twist和E盒结合锌指结构转录因子家族ZEB等[25],这四者同属于E钙黏着转录抑制子,可以通过位于E-Cadherin 启动子区域的E盒特异结合,从而起到抑制 E-Cadherin表达的作用,进而促进间质化进程.本实验中,TNC联合吉非替尼可显著上调E-Cadherin的表达,下调N-Cadherin、Vimentin、转录因子Snail、Slug、ZEB、Twist的表达,提示两者联合可能是通过抑制A549细胞发生EMT过程从而影响其迁移能力.HGF诱导的c-MET活化触发了多种细胞反应,包括细胞增殖,凋亡,骨架重排等.在癌细胞中,可以通过激活RTK激酶,引起自体磷酸化,激活PI3K,进一步促进癌细胞转移[26-27].表皮生长因子受体EGFR可由活化的HGF/c-Met、 K-Ras激活后,与EGF结合启动PI3K/AKT信号通路,逐级磷酸化下游蛋白,比如核转录因子NF-κB等,从而影响细胞的生长转移和一系列生理过程.由Western Blotting实验结果可知:TNC联合吉非替尼显著下调了上述PI3K/AKT和NF-κB信号通路促进EMT和迁移相关蛋白的表达水平,同时显著提高了抑制EMT和迁移的E-Cadherin蛋白的表达水平,且较单药组相比,作用程度更显著.本研究这些结果表明:TNC联合吉非替尼可显著增强吉非替尼对A549细胞迁移能力的影响,其作用的分子机制可能是通过影响HGF/c-Met/K-Ras/EGFR/EGF-PI3K/AKT/NF-κB信号通路而发挥作用,这为TNC开发应用与吉非替尼在临床上如何平衡治疗效果、减少转移和毒副作用提供了新的解决思路.

