miR-1266靶向DAB2IP调控肝癌细胞的增殖和凋亡
吴晓庆,万 红,杨璞叶,钱宏波,靳稳妮,兰 琳
1.西安市第八医院肝病科,陕西 西安 710061; 2.兰州市第二人民医院感染科; 3.西安市第八医院中西医结合科; 4.西安市第八医院检验科
原发性肝细胞癌简称肝癌,是全球第五大常见恶性肿瘤,具有较高的发病率和死亡率。我国肝炎患者的数量居世界首位,每年有大量的肝炎患者在肝硬化的基础上发展为肝癌,据统计,中国肝癌新发病例数占全球的 50%以上,对国民的健康和生命造成严重威胁[1-2]。外科手术切除是临床上治疗早期肝癌的最有效方法,但大多数肝癌患者被确诊时已是肿瘤晚期,错过了最佳手术时机。因此,研究肝癌发生、发展的分子机制,寻找潜在的肝癌治疗靶点,探寻更有效的肝癌治疗方法尤为重要。miRNA是在真核生物中发现的一类内源性且具有调控功能的非编码RNA,长度为20~25个核苷酸,可以通过碱基互补配对的方式识别靶mRNA,并根据互补程度不同抑制靶基因翻译或促进靶基因降解[3],在调控肝癌细胞增殖、凋亡、分化、侵袭等过程中发挥重要作用[4]。miR-1266是miRNA的一种,近年来研究发现,miR-1266是多种癌症发生、发展中的关键参与者和调控因子[5],然而miR-1266在肝癌中的作用及其机制目前尚不清楚。因此,本研究旨在探讨miR-1266对肝癌细胞增殖和凋亡的影响及其调控机制,为肝癌的诊断和治疗提供新靶标和策略。
1 材料与方法
1.1 实验材料选择2018年1月至2018年10月西安市第八医院肿瘤科确诊为肝癌并后期实施肝癌切除术的40例患者,患者在术前均未进行放、化疗,患者及其家属均已签署知情同意书,实验方案经我院伦理委员会批准。纳入标准:入组病例均经术前影像学及术后病理确诊为肝癌,均为原发性肿瘤接受手术切除治疗,术前均未接受任何相关放、化疗及新辅助治疗等;排除标准:排除继发性肝癌病例,合并其他部位恶性肿瘤及严重脏器功能障碍或精神、认知功能障碍等病例等。在患者进行肝癌切除手术后,对患者的肿瘤组织标本和癌周正常肝组织标本(距离患者癌组织边界>3 cm的癌旁组织)进行收集,组织离体15 min内立即置于液氮中冻存用于后续实验分析。人肝癌细胞株HepG2购自中国科学院细胞库,用质量浓度为100 g/L胎牛血清(FBS)的DMEM培养基,在体积分数为5%的CO2,37 ℃的恒温培养箱中进行培养,生长密集达到80%后,对细胞进行传代培养。
1.2 细胞转染将对数生长期的HepG2细胞以1×105/孔密度接种于6孔板中,置于细胞培养箱内常规培养,当细胞生长状态良好且融合度为60%左右时开始进行转染。按照LipofectamineTM2000试剂盒(美国Invitrogen公司)说明书将阴性对照(NC)、miR-1266 mimics、miR-1266 mimics+pcDNA-DAB2IP分别转染入HepG2细胞中。转染完成后继续培养24 h后,更换为含10% FBS的DMEM培养基,培养24 h后,qRT-PCR检测miR-1266的表达水平,确认转染效率。
1.3 总RNA的提取及qRT-PCR使用Trizol试剂(美国Invitrogen公司)提取组织及细胞中的总RNA,使用逆转录试剂盒(日本Takara公司)根据说明书步骤将RNA反转录成cDNA,使用SYBR Green miRNA荧光定量 PCR 试剂盒(日本Takara公司)配置20 μl PCR反应体系,在ABI 7500仪器上进行qRT-PCR反应。循环条件为95 ℃,30 s;95 ℃,5 s;60 ℃,30 s;70 ℃,30 s;循环40次。引物由上海生工生物公司合成,引物序列如表1。以U6为内参,以2-ΔΔCt计算miR-1266和 DAB2IP mRNA的相对表达量,ΔCt = Ct目的基因-Ct内参,Ct值的含义是:每个反应管内的荧光信号到达设定的域值时所经历的循环数。
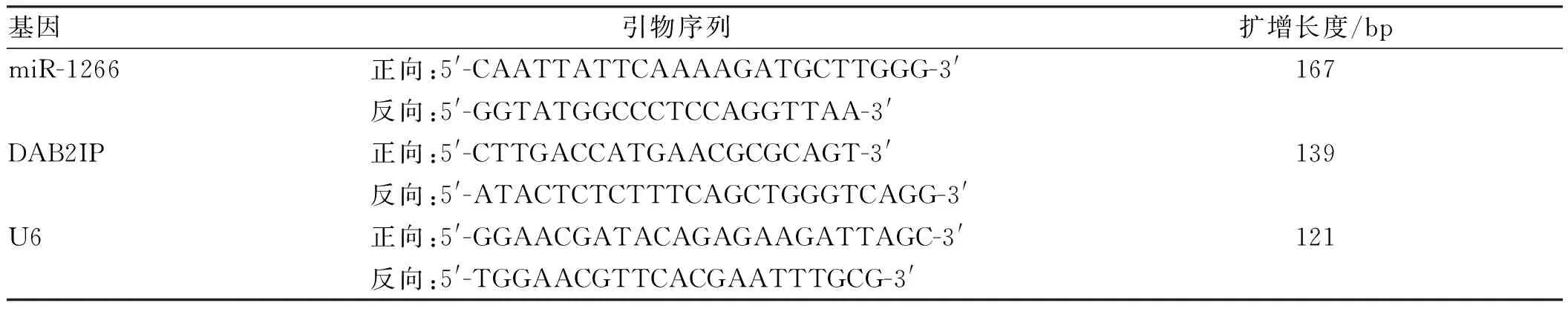
表1 miR-1266、DAB2IP、U6引物序列及扩增长度Tab 1 Primer sequences and amplification length of miR-1266, DAB2IP, U6
1.4 miR-1266靶基因预测及验证应用4个miRNA靶基因预测网站miRBase(http://www.miRbase.org/)、TargetScan(http://www.targetscan.org/)、miRDB(http://www.miRdb.org/)、microRNA(http://www.microrna.org/)预测 miR-1266的靶基因,发现DAB2IP的3′-UTR与miR-1266存在结合位点。利用双荧光素酶报告基因试验进行验证,将含有DAB2IP 3′-UTR序列(WT)及其突变序列(MUT)的片段插入到双荧光素酶报告载体pmirGLO中,构建双荧光素酶报告载体质粒。利用LipofectamineTM2000 ,将miR-1266 mimics或阴性对照分别与pmirGLO-DAB2IP-WT或pmirGLO-DAB2IP-MUT重组质粒共转染至HepG2细胞中。转染完成后,在37 ℃,体积分数为5%的CO2培养箱中继续培养48 h,根据双荧光素酶报告基因检测试剂盒说明检测荧光素酶活性。
1.5 Western blotting检测收集转染48 h后的细胞,加入适量的RIPA裂解液,1200 r/min离心5 min,离心后提取细胞内总蛋白,采用BCA试剂盒检测蛋白浓度。每孔加入20 μg蛋白和适量SDS-PAGE上样缓冲液,在95~100 ℃水浴5 min将蛋白变性。以GAPDH作为内参,Western blotting检测各组DAB2IP蛋白的表达水平。
1.6 CCK-8增殖实验利用CCK-8法检测转染后细胞的增殖情况,HepG2以5 000个/孔的细胞密度接种于 96 孔板中,每组准备3个96孔板,在24、48、72 h 时分别取一个96孔板,每孔中加入10 μl CCK-8 试剂,在37 ℃细胞培养箱中继续培养 2 h后,使用酶标仪检测450 nm处各孔吸光度值(OD值)。
1.7 流式细胞仪检测细胞凋亡使用Annexin V-FITC/PI染色试剂盒对细胞进行凋亡检测,收集各组转染后培养48 h的HepG2细胞,用PBS洗涤细胞2次,加入结合缓冲液制成细胞悬液;按试剂盒说明书中建议的试剂体系用量依次加入Annexin V、PI后轻轻混匀,避光室温孵育15 min,流式细胞仪检测细胞凋亡率。
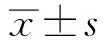
2 结果
2.1 癌组织及癌旁组织中miR-1266、DAB2IP表达情况肝癌组织中miR-1266的表达水平显著高于癌旁组织(P<0.01)(见图1A),DAB2IP的表达水平显著低于癌旁组织(P<0.05)(见图1B);对其表达水平进行Pearson相关性分析发现,肝癌组织中miR-1266与DAB2IP表达水平呈负相关(R=-0.79,P<0.01)(见图1C)。
注:A:与癌旁组织比较,**P<0.01;B:与癌旁组织比较,*P<0.05;C:miR-1266与DAB2IP表达水平的相关性分析。
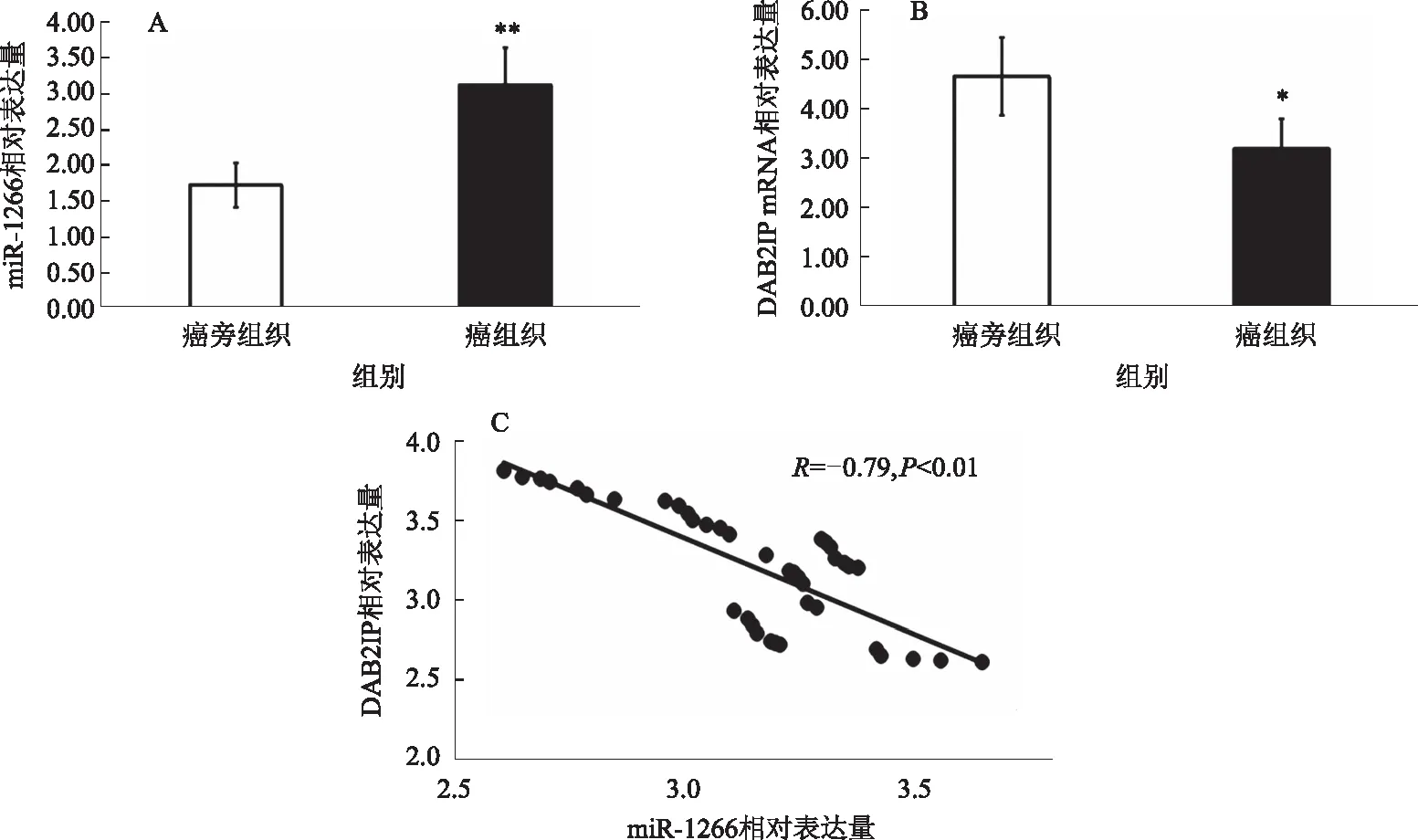
2.2 miR-1266靶向下调DAB2IP表达利用miRNA数据库预测miR-1266的靶基因,通过数据库筛选发现,miR-1266可以与DAB2IP基因的3′-UTR区结合(见图2A),是miR-1266的潜在靶基因。双荧光素酶报告基因实验检测结果显示,转染miR-1266 mimic显著抑制DAB2IP野生型质粒荧光强度(P<0.01),而对DAB2IP突变型质粒荧光强度无影响(P>0.05,见图2B)。Western blotting检测结果显示,转染miR-1266 mimics显著降低HepG2细胞中DAB2IP蛋白的表达(见图2C)。
2.3 miR-1266通过下调DAB2IP促进HepG2细胞增殖qRT-PCR结果显示,与NC组相比,转染miR-1266 mimics可以显著提高HepG2细胞中miR-1266的表达水平(P<0.001),miR-1266 mimics+pcDNA-DAB2IP共转染,miR-1266表达水平差异无统计学意义(P>0.05)(见图3A)。CCK-8 实验结果显示,与NC组相比,转染miR-1266 mimics显著促进了HepG2细胞的增殖活力(P<0.01),miR-1266 mimics+pcDNA-DAB2IP共转染,细胞的增殖活力差异无统计学意义(P>0.05)(见图3B)。
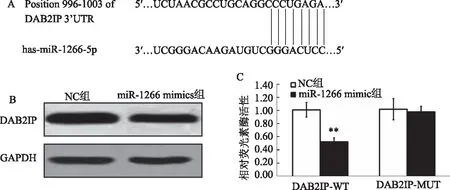
注:与NC组比较,**P<0.01。
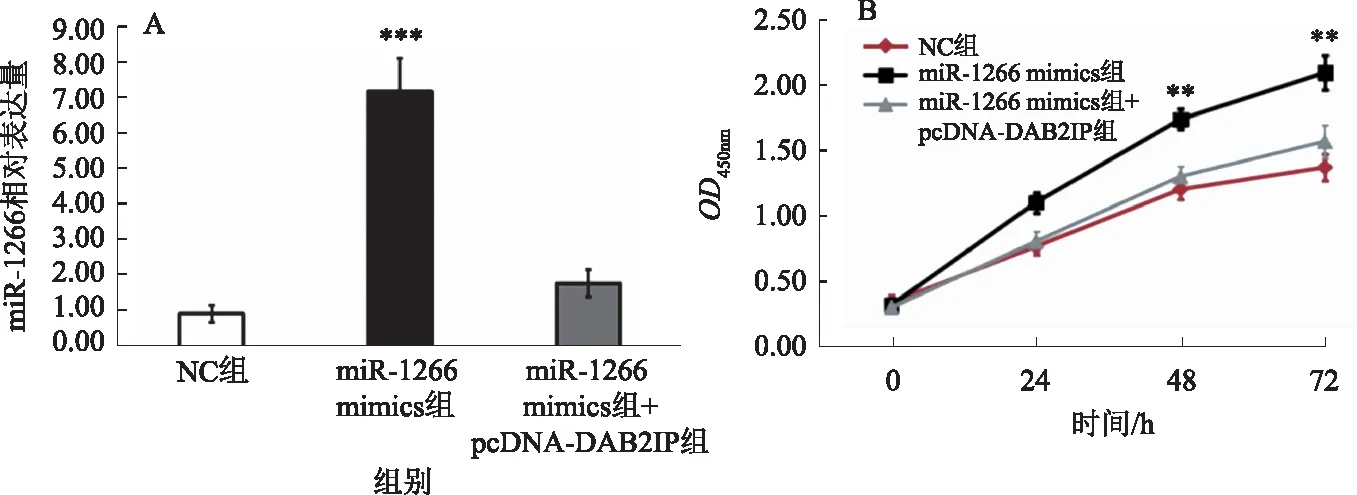
注:与NC组比较,**P<0.01,***P<0.001。
2.4 miR-1266通过下调DAB2IP抑制HepG2细胞凋亡Western blotting检测结果显示,与NC组相比,转染miR-1266 mimics可以显著降低HepG2细胞中DAB2IP蛋白的表达水平(P<0.01),miR-1266 mimics+pcDNA-DAB2IP共转染,DAB2IP蛋白的表达水平差异无统计学意义(P>0.05)(见图4A)。流式细胞仪检测结果显示,与NC组相比,转染miR-1266 mimics显著抑制了HepG2细胞的凋亡(P<0.001),miR-1266 mimics+pcDNA-DAB2IP共转染,细胞的凋亡率差异无统计学意义(P>0.05)(见图4B)。
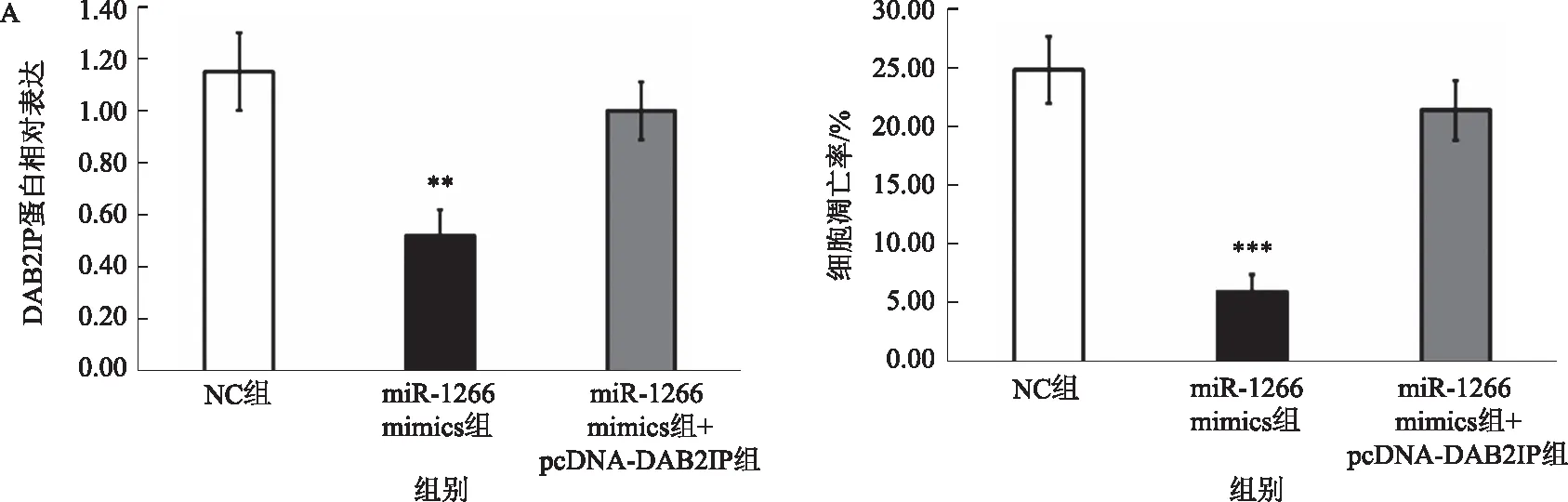
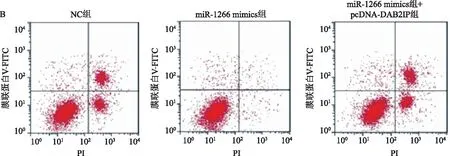
注:与NC组比较,**P<0.01,***P<0.001。
3 讨论
肝癌是世界十大恶性肿瘤之一,发病年龄多为40~50岁,男性多见于女性,死亡率居第3位,仅次于胃癌和食管癌[6]。肝癌发病症状早期不明显,病情发展到一定程度才会产生腹部疼痛、腹部包块、食欲下降、疲乏无力、日渐消瘦等症状,给早期诊断带来巨大困难。肝癌常发生在慢性肝炎肝硬化的基础上,与肝硬化症状相似,容易被患者忽略,且恶性程度高,病情进展快,治疗难度大,治疗效果差[7]。肝癌预后差的重要原因之一是肝癌发生、发展的分子机制目前仍不明确,缺乏有效的干预靶分子[8],因此,探索肝癌发生、发展机制,寻找有效的治疗靶点具有重要意义。
miRNA是一类长度为18~25个核苷酸的非编码RNA,成熟的miRNAs是由较长的初级转录物经过一系列核酸酶的剪切加工而产生的,随后组装进RNA诱导的沉默复合体,通过碱基互补配对的方式识别靶mRNA,并根据互补程度的不同指导沉默复合体降解靶mRNA或阻碍靶mRNA的翻译[9-10]。miR-1266是目前miRNA研究的热点之一,参与了多种癌症的调控。Sun等[11]研究发现,miR-1266通过靶向PRMT5抑制前列腺癌的生长和转移。Wang等[12]研究发现,miR-1266通过靶向DAB2IP促进宫颈癌细胞增殖、迁移和入侵。Ichihara等[13]发现,增加血清miR-1266水平参与寻常型银屑病的发展。DAB2IP是Ras-GTPase激活蛋白家族的成员之一,作为肿瘤抑制基因参与调节肿瘤细胞增殖、迁移、凋亡等生物学行为[14]。此外,DAB2IP还可以调控MAPK-ERK、P13K-Akt、ASK1-JNK、GSK-3B-β-catenin等多种信号传导通路。有研究发现,DAB2IP通过激活细胞凋亡信号调节激酶(ASK1)来促进肝癌细胞凋亡[15]。Lu等[16]研究发现,miR-556-3p通过负向调控DAB2IP促进食管癌细胞的增殖。Li等[17]研究发现,miR-182通过靶向DAB2IP促进大肠癌细胞增殖、侵袭和肿瘤生长。Feng等[18]发现,miR-556-3p通过负调控DAB2IP的表达,促进膀胱癌的增殖、迁移和侵袭。目前尚未发现miR-1266与DAB2IP的关系及其在肝癌中的功能的相关研究报道,本研究从miR-1266与DAB2IP在肝癌组织中的表达及其关系、miR-1266表达对肝癌增殖和凋亡的影响两方面进行分析,以期为肝癌患者的精准治疗提供更多的理论依据。
本研究首先利用qRT-PCR检测肝癌组织中miR-1266及DAB2IP的表达水平,发现肝癌组织中miR-1266表达上调,而DAB2IP表达下调,表明miR-1266和DAB2IP可能参与肝癌的发生、发展过程。进而分析其相关性发现,miR-1266与DAB2IP表达呈负相关,基于此,我们推测在肝癌中miR-1266表达可能负向调控DAB2IP的表达。其次,通过生物信息学网站预测发现,DAB2IP可能是miR-1266的靶基因,双荧光素酶报告实验进行验证,证实DAB2IP是miR-1266的靶基因,Western blotting实验发现miR-1266可引起DAB2IP蛋白表达下调,综合以上实验结果得出miR-1266靶向作用于DAB2IP基因并引起其表达下调。最后,利用脂质体转染技术向肝癌细胞HepG2中单独转染miR-1266 mimics、共转染miR-1266 mimics和pcDNA-DAB2IP,qRT-PCR和Western blotting检测发现,转染miR-1266 mimics使miR-1266表达上调,DAB2IP表达下调,共转染miR-1266 mimics和pcDNA-DAB2IP逆转了上述现象。CCK-8实验和流式细胞仪分别检测细胞增殖和凋亡发现,转染miR-1266 mimics促进了HepG2细胞的增殖,抑制了细胞凋亡,而共转染miR-1266 mimics和pcDNA-DAB2IP逆转了上述现象。由此可见,miR-1266通过靶向下调DAB2IP表达促进肝癌细胞增殖、抑制细胞凋亡。
综上所述,肝癌组织中miR-1266表达上调,而DAB2IP表达下调;DAB2IP是miR-1266的一个靶基因;miR-1266通过靶向下调DAB2IP表达促进肝癌细胞增殖、抑制细胞凋亡。

