NKT细胞在肝脏病理和生理中的作用
孙智强,李京涛,魏海梁,闫曙光,李日向,李 倩,常占杰
1.陕西中医药大学附属医院肝病科,陕西 咸阳 712046; 2.陕西中医药大学
由于肝脏和肠道解剖位置的特殊性,肝脏会受到大量肠道菌群及其代谢物(如脂多糖)引起的免疫反应。为避免肝组织损伤,肝脏对这些物质产生的免疫反应具有重要的调节作用。过量脂肪、酒精或病毒引起的肝脏炎症是损伤修复过程中重要组成部分。控制炎症对促进组织再生或病原体的有效免疫反应具有积极作用。然而,慢性炎症和相关的组织损伤修复与纤维化,肝硬化和癌症的发展密切相关。与其他外周器官相比,肝脏富含大量的天然免疫细胞,包括巨噬细胞、库普弗细胞(KCs)、树突状细胞(DC)、自然杀伤细胞(NK)和自然杀伤T细胞(NKT)。NKT细胞在小鼠肝脏中表达丰富,是连接先天免疫和适应性免疫的重要纽带[1],在炎症反应中起着至关重要的作用。由于NKT细胞2种亚型在免疫反应中具有相反的作用,而免疫应答是通过分泌促炎细胞因子和抗炎细胞因子介导的,因此,有必要区分它们在急性和慢性肝脏炎症状态中的不同作用。本文就NKT细胞在炎症性肝病中的作用及免疫耐受的维持等方面研究作一概述。
1 NKT细胞
NKT细胞是一种天生的T细胞,除了典型的NK细胞标志物外,还表达TCR-αβ链,在自身免疫性疾病、传染病和癌症等炎症性疾病中具有重要的免疫调节作用[2]。NKT细胞是天然免疫和适应性免疫之间的桥梁系统。NKT细胞可以通过主要组织的相容性复合物分子CD1d识别外源性和内源性脂类抗原。使用基因敲入Cxcr6gfp/+小鼠的研究表明,α-半乳糖基神经酰胺(αGalCer)注射后的几分钟内,Ⅰ型NKT细胞迁移到肝窦内增加[3]。NKT细胞在肝窦中的聚集表明,NKT细胞参与了各种免疫反应的诱导或逆转肝脏炎症的机制。
由于CD1d的限制性,将NKT细胞分为2种亚型:Ⅰ型NKT细胞即iNKT(invariant NKT)细胞和Ⅱ型NKT细胞即vNKT(variant NKT)细胞。iNKT细胞较vNKT细胞在小鼠体内多,约占小鼠肝内淋巴细胞的50%。iNKT细胞表达恒定不变的TCR-αβ,该基因主要由生殖细胞Vα基因(人Vα24,小鼠Vα14)和Jα18基因片段与一组更为多样的非生殖细胞Vβ基因(小鼠Vβ8.2、Vβ7或Vβ2和人Vβ11)组成[4]。在人体中,iNKT细胞约占循环T细胞的0.1%~1%。CD4-和CD4+iNKT细胞主要分泌Th1型和Th2型细胞因子。vNKT细胞比iNKT细胞表达更丰富,表达的TCR-α-和TCR-β链相对复杂。vNKT细胞中有一种主要的细胞亚群是与β连接的自糖脂硫化物反应,它表达了一个寡克隆TCR序列,主要是利用Vα3/Vα1-Jα7/Jα9和Vβ8.1/Vβ3.1-Jβ2.7基因片段[5]。从iNKT细胞TCR-αGalCer/CD1d复合物和vNKT细胞TCR-硫化物/CD1d复合物的晶体结构中发现,不同的分子基序在iNKT和vNKT细胞的识别中起着重要作用[6-7]。
1.1 iNKT细胞抗原识别与活化iNKT细胞能被小鼠体内多种糖脂抗原以CD1d依赖的方式激活,如αGalCer和异氯三己糖神经酰胺。除脂类抗原外,iNKT细胞还可通过Toll样受体(TLR)介导的信号和活化抗原提呈细胞(APC)分泌的细胞因子(IL-12、IL-18或IFN)而激活。活化后的iNKT细胞可分泌Th1-、Th2或Th17等细胞因子。因此,根据组织环境、APC和脂类抗原,iNKT细胞可以分泌不同的细胞因子谱。如iNKT细胞在缺血、毒素诱导的损伤或IL-18和IL-12的刺激下分泌IFN-γ;在αGalCer的刺激下分泌IFN-γ、IL-4和IL-17[8]。
活化后的iNKT细胞可进一步刺激DC细胞、NK细胞、B细胞及常规CD4+和CD8+T细胞,从而进一步介导肝脏损伤[9]。活化的iNKT细胞分泌的细胞因子和趋化因子可导致中性粒细胞、髓系细胞和单核细胞向肝脏聚集[10-12]。iNKT细胞可促进与Hedgehog通路有关纤维生成和骨桥蛋白(OPN)在内的细胞因子导致的肝星状细胞(HSC)活化[11]。活化的iNKT细胞可以通过Fas/FasL相互作用直接致肝细胞死亡,也可以通过激活NK细胞间接损伤肝细胞[13]。KCs位于门静脉(窦血管间隙)和系统循环的交界处,通过TLR和核苷酸结合寡聚结构域样受体的表达,可识别病原体相关分子模式和危险相关分子模式,激活免疫反应的关键因素。活化的KCs产生多种促炎细胞因子,如IL-1β、IL-18、TNF-α和IL-12,它们在调节iNKT细胞的聚集和活化中具有重要作用[14]。
1.2 vNKT细胞抗原识别与活化vNKT细胞主要由自身糖脂硫化物和β连接的糖脂而激活。其他磷脂,包括溶血磷脂酰胆碱、溶血磷脂和溶血素-血小板活化因子,也可在体外和体内通过CD1d依赖的方式刺激vNKT细胞的活化[15]。如感染HBV后肝细胞产生的溶血磷脂酰乙醇胺能够刺激vNKT细胞的激活[16]。iNKT细胞在肝脏损伤中主要发挥促炎作用,vNKT细胞能够抑制iNKT细胞诱导的促炎反应,从而保护肝脏免受损伤。此外,硫化物激活vNKT细胞并不能诱导B细胞、NK细胞或T细胞的活化[17]。因此,对vNKT细胞的研究揭示了一种主要的免疫调节途径,该途径证明vNKT细胞对肝脏缺血再灌注损伤具有保护作用。
1.3 iNKT和vNKT细胞间的交叉调节iNKT细胞在酒精、高脂饮食、缺血或肠源性微生物引起肝脏损伤后迅速激活。肝内APC(如KCs)和TLRs/细胞因子介导其活化,从而导致细胞因子/趋化因子依赖性的髓系细胞和中性粒细胞的聚集,并激活HSC和NK细胞[2]。这些细胞相互作用导致脂肪变性,纤维化和肝细胞坏死,甚至影响肝癌发生、发展。vNKT细胞在自身脂质的产生后可被激活,导致交叉调节途径的诱导,抑制iNKT细胞,使iNKT细胞功能丧失,阻断炎症级联和肝病的发生。相反,有实验数据表明iNKT可交叉调节vNKT活性。研究发现,硫化刺激vNKT细胞可完全抑制αGalCer在15~12 RM纤维肉瘤模型中的保护作用,但不完全阻断αGalCer对CT 26结肠癌肺转移的保护作用,iNKT细胞可能对vNKT细胞的活性有中度抑制作用[18]。更好地理解iNKT和vNKT细胞交叉调控机制对于炎症性肝病免疫反应结果的研究至关重要。
2 NKT细胞在肝脏病理状态中的作用
在大多数慢性肝病的实验模型中,包括肝脏缺血再灌注损伤、conA型肝炎、原发性胆汁性肝硬化(PBC)和非酒精性脂肪性肝病(NAFLD),iNKT细胞已被证实具有促进肝脏疾病发生、发展的作用。然而,在急性肝损伤模型中,iNKT细胞具有保护作用。如在小鼠胆道梗阻、胆汁淤积模型和急性CCl4诱导的纤维化模型中,iNKT细胞依赖性地抑制巨噬细胞炎症蛋白-2、KCs和TNFα的产生,导致中性粒细胞浸润和肝损伤的发生、发展[19-20]。这些数据表明,在急性肝损伤时,iNKT细胞激活可能具有保护作用,而在慢性疾病中,iNKT细胞激活可导致肝脏损伤。Wang等[21]发现,αGalCer介导的iNKT细胞的激活通过STAT-6方式促进中性粒细胞浸润和肝炎发生,而又能依赖STAT-1通路诱导中性粒细胞凋亡来改善iNKT肝炎。
2.1 酒精性肝病酒精性肝病(ALD)是由长期酗酒引起的一种常见疾病,也是一般人群中最常见的死亡原因之一。本病可从肝脂肪变性(脂肪肝)发展为酒精性肝炎(10%~35%),并最终发展为酒精性肝纤维化或肝硬化(8%~20%)。ALD的细胞和分子机制涉及天然免疫细胞(NK、NKT和γδT细胞)、实质细胞(肝细胞)和非实质细胞(窦内皮细胞、KCs、HSCs和DC)之间的复杂相互作用。饮酒后,通过脂多糖/TLR信号依赖机制激活KCs,导致多种促炎细胞因子和趋化因子的分泌增加,此外还会产生类二十烷酸和活性氧。Cui等[14]发现,KCs衍生的炎性小体激活和IL-1β释放对于肝NKT细胞的聚集和激活是必不可少的。总之,肠源性细菌及其代谢物,可通过核苷酸结合寡聚结构域样受体来激活KCs,从而导致NKT细胞活化。
在Lieber-DeCarli液体喂养的慢性+暴饮酒精的小鼠模型中发现,iNKT细胞数量显著增加,这与另一种通过胃管喂食酒精的小鼠模型得出的结果一致[10,12]。此外,Jα18-/-小鼠(缺乏iNKT细胞)和CD1d-/-小鼠(缺乏NKT细胞亚群)对酒精摄入后的肝损伤具有保护作用。Ⅰ型NKT细胞的活化是Gr-1+CD11b+细胞和中性粒细胞募集所必需的,这些细胞会导致肝组织损伤。因此,几种与炎症和中性粒细胞聚集有关的细胞因子和趋化因子,包括OPN、IL-1β、IL-6、TNFα、巨噬细胞炎症蛋白-2、MIP-1β和CXCR1在酒精性野生型小鼠肝脏中表达增强,而在缺乏iNKT细胞的小鼠中则无表达。此外,通过全反式维甲酸直接抑制iNKT细胞,或通过硫化物介导激活vNKT细胞的间接机制或注射抗CD1d阻断抗体,显著抑制了这种促炎级联,改善了ALD[10,12]。
2.2 NAFLDNAFLD是最常见的慢性肝病。NAFLD影响发达国家10%~20%的人口,而且随着糖尿病和肥胖症的增加,其发病率也在增加。NAFLD的定义是脂肪在肝脏内的异常积聚,即脂肪变性,可发展为严重的炎症细胞浸润或伴有纤维化或坏死的非酒精性脂肪性肝炎(NASH),或进展为肝硬化和肝细胞癌(HCC)。NKT细胞通过CD1d-脂质抗原识别被激活,导致肝脏炎症和NASH。高脂饮食诱导的脂肪肝增加了KCs的数量,增加了KCs中促炎性细胞因子的表达,导致NKT细胞在NAFLD发展过程中过度活化和细胞死亡,从而导致肝NKT细胞的耗竭。此外,NKT细胞的过继性转移降低了肝脏脂肪含量,随后导致ob/ob小鼠从宏观到微观的转变,并改善了葡萄糖耐量[22]。通过观察MCD诱导小鼠NASH过程中肝NKT细胞的蓄积,Hedgehog通路的激活介导NKT细胞的激活,从而促进HSC的肌纤维母细胞活化,导致NASH的纤维化进展[23]。
2.3 自身免疫性肝炎(AIH)AIH是一种慢性自身免疫性肝脏炎症,其特点是T细胞在无其他肝病的情况下肝小叶内浸润,并伴有血清转氨酶、高伽马球蛋白血症和肝细胞特异性自身抗体的增加。AIH有2种亚型:Ⅰ型为抗平滑肌抗原和抗核抗体的自身抗体,Ⅱ型为针对细胞色素P450 D26或甲酰基转移酶环脱氨酶的自身抗体。早期的研究发现,iNKT细胞具有致病性,而vNKT细胞的激活对ConA所致的肝炎具有保护作用[24]。PBC和AIH患者血清和肝脏中IL-17的高水平与疾病的严重程度密切相关,这表明iNKT细胞分泌的IL-17在肝脏疾病中具有一定的作用[25-26]。与对照组相比,PBC、慢性丙型肝炎、NASH和AIH患者肝活检门脉区的IL-17表达细胞明显增加[27]。在αGalCer引起的肝损伤小鼠模型中,CD4+iNKT细胞是IL-17的主要来源,在注射αGalcer前注射抗IL-17和单克隆抗体可明显加重肝炎、中性粒细胞的肝合成及促炎单核细胞IL-12和TNF-α的产生。与此形成对照的是,在注射αGalCer之前,外源性重组小鼠IL-17可以减轻肝炎并防止炎症单核细胞进入肝脏。因此,iNKT细胞分泌IL-17可能在AIH中起关键作用[28]。
2.4 慢性乙型肝炎(CHB)HBV感染在全世界肝硬化和原发性肝癌中占57%,每年造成100万人死亡。iNKT细胞可能在控制HBV感染中起着重要作用,特别是在HBV感染的早期阶段,通过IFN-γ的分泌,iNKT细胞可以抑制肝细胞中的HBV病毒复制[29]。肝细胞通过调节CD1d分子所呈现的激活和非激活脂质的平衡,直接调控iNKT细胞的动态平衡。因此,iNKT细胞作为HBV感染的早期预警系统,很大程度上改变了脂质代谢[7]。例如,vNKT细胞识别CD1d结合的溶血磷脂,一种由HBV诱导的分泌磷脂酶在肝细胞中产生的抗原性自身脂质,产生的vNKT细胞的活化导致IL-12介导的iNKT细胞的反活化,在病毒的控制中起着关键的作用[16]。然而,vNKT细胞也可引起HBV转基因小鼠肝脏损伤[30]。因此,NKT细胞在感染早期可以控制HBV病毒的复制,但NKT细胞也可通过肝细胞溶解、促炎细胞因子的产生、诱导肝细胞凋亡和抑制肝细胞增殖等多种机制参与慢性病毒性肝炎的肝损伤。
2.5 HCCHCC常与慢性炎症性肝病如NASH和病毒性肝炎有关。NKT细胞在癌症中具有双重作用:NKT细胞可以通过激活效应分子CD4/CD8+T细胞来促进抗肿瘤反应;还可以通过募集抑制因子或调节性T细胞诱导耐受或产生Th2细胞因子来加速肿瘤的生长,从而抑制肿瘤抗原特异性CD8+T细胞的增殖[31]。虽然NKT细胞在肝脏中大量存在,但很少有研究试图阐明其在肝癌中的作用。
研究表明,长期喂饲胆碱缺乏高脂饮食(CD-HFD)可诱导小鼠肝内CD8+T细胞和NKT细胞的活化,以及炎性细胞因子的分泌。NKT细胞只会引起脂肪变性,而CD8+细胞和NKT细胞协同作用会导致肝脏的损伤。肝细胞TLR4和典型的核因子-κB信号传导促进NASH到HCC的转变,表明NASH和肝癌的发生与不同的分子机制有关。CD4+iNKT细胞可通过抑制致癌β-catenin通路激活所引起的炎症反应而介导抗肿瘤作用。此外,NKT细胞对肝癌转移瘤的生长也有抑制作用[32]。NKT细胞在肿瘤免疫中的确切作用还存在争议,其功能需进一步验证。明确NKT细胞在不同病因及不同阶段肝癌细胞中的功能,有助于NKT细胞相关治疗更好地应用于患者。
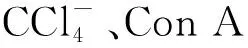
3 展望
本文讨论了NKT细胞活化的关键方面及其在炎症条件下的作用。目前,对NKT细胞研究主要集中于动物实验,缺乏临床研究。由于CD1d限制性,NKT细胞存在2种亚型,它们具有相反的功能,并且在疾病发展过程中可以在不同的时间点被不同的激活,这使得实验和临床研究变得更加复杂。不同类型的NKT细胞活化可导致多种细胞因子和趋化因子的分泌。此外,由于NKT细胞还调节其他关键免疫细胞的活性,如KCs、巨噬细胞、DC和主要的组织相容性复合体—限制CD4+/CD8+细胞,因此,对这些交叉调节影响的分子理解将是了解肝脏如何在免疫耐受和免疫之间保持平衡的关键。在慢性肝病的过程中,不同NKT细胞的作用是不可分割的、相互关联的,并且随着病情的发展而变化。在未来,我们的重点是研发特异性试剂来明确和鉴别人类的Ⅰ型和Ⅱ型NKT细胞亚群,并通过CD1d四聚体和其他方法区分在外周血单个核细胞和肝组织中的NKT激活试剂。

