蒿甲醚对小鼠恶唑酮结肠炎的抗炎作用及其机制的初步研究
沈天天
上海电力医院内科,上海 200050
炎症性肠病(inflammatory bowel disease,IBD)是一种以胃肠道慢性、进行性损伤为主要特征的自身免疫性疾病,严重危害患者的生命质量。近40年来,国内外对IBD胃肠道黏膜免疫损伤机制,尤其是炎症因子调控网络的研究和认识不断深化。其突出的成就是以肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)单抗英夫利昔(infliximab,IFX)为代表的生物制剂引入IBD的临床治疗。虽然IFX等生物制剂治疗克罗恩病(Crohn’s disease,CD)或溃疡性结肠炎(ulcerative colitis,UC)能够更快实现诱导缓解,显著提高黏膜愈合率,减少肠道慢性损伤如纤维化、梗阻、瘘管等并发症[1-2],但IBD的最终预后并未根本改观,只有不到40%的患者在短期内对抗TNF-α治疗表现为完全应答,且需要终生维持给药。而新的生物制剂价格昂贵,只有极少数患者能够支付长期给药的费用。近来有关这些药物对机体免疫机能产生不良干扰,严重不良反应事件的报道逐渐增多。因此,寻找开发新的安全有效的IBD治疗药物,是国内外医学生物学、药物学和制药学研究的一个重要领域。来自日本、韩国及我国的相关报道中,有不少文献是天然药物(中药)治疗IBD的研究资料[3]。
蒿甲醚是我国研制的新型抗疟药,系青蒿素的脂溶性衍生物。该药比青蒿素具有更强的抗疟作用,具有高效、速效、低毒等特点,尤其对恶性疟疾和脑型疟疾有效。由于脑型疟疾的发病机制与自身免疫有关,因而推测蒿甲醚除直接杀灭疟原虫外,可能还具有免疫调节功能。Wang等[4]研究发现,蒿甲醚能够抑制T细胞分裂增殖,并可抑制IL-2和IFN-γ的生成。在这方面,蒿甲醚的药理作用机制与治疗IBD的药物大致相同。恶唑酮诱导的小鼠结肠炎模型,表现为经典的Th2型免疫损伤[5],结肠病理损伤与人类UC非常相似。因此,我们以恶唑酮诱导的小鼠结肠炎模型,采用蒿甲醚作为干预因素,观察其对这一模型的影响,从病理组织学及TNF-α和IL-13等指标,初步评价并探索蒿甲醚干预小鼠恶唑酮结肠炎模型的作用和机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组:40只6~8周龄健康雄性BALB/c小鼠,体质量(19±2)g/只,购自上海西普尔-必凯实验动物有限公司,采用架式笼养,每笼5只。饲养环境:温度(23±2)℃,相对湿度50%~60%,人工建立12 h明暗周期。饲料由上海西普尔-必凯实验动物有限公司提供SPF级鼠颗粒饲料,饮用消毒过滤水。随机分为空白对照组(n=10)、结肠炎组(n=10)、地塞米松磷酸钠治疗组(DX组,n=10)和蒿甲醚治疗组(蒿甲醚组,n=10)。
1.1.2 材料和试剂:恶唑酮(日本和光纯药工业株式会社),蒿甲醚(陕西森弗生物技术有限公司),地塞米松磷酸钠(广州天心药业股份有限公司),橄榄油(国药集团化学试剂有限公司),戊巴比妥钠(上海西唐生物科技有限公司),无水乙醇(常熟杨园化工有限公司),甲醛(上海溶剂厂),塑料真空采血管(日本积水化学工业株式会社),抗凝EP管(美国AXYGEN公司),TNF-α、IL-13 ELISA试剂盒(奥地利Bender MedSystems公司),2%戊二醛PBS固定液、1%锇酸PBS固定液、环氧树脂618包埋液、枸橼酸铅等由上海交通大学医学院电镜室提供。
1.1.3 设备和仪器:移液器(法国GILSON公司),电子天平(上海天平仪器厂),台式离心机(德国Eppendorf公司),光学摄像显微镜(日本奥林巴斯光学工业株式会社),CM-120透射电子显微镜(荷兰菲利浦公司),酶标仪(美国BioTek公司),孵箱(上海华连医疗器械有限公司)。
1.2 实验方法
1.2.1 小鼠恶唑酮结肠炎模型的制备:参照Ekstrom等[6]和Heller等[7]的方法进行改良建立小鼠恶唑酮结肠炎模型:(1)小鼠腹部剃毛(面积2 cm×2 cm),第1天裸露皮肤处涂抹3%恶唑酮(100%乙醇溶液)0.2 ml致敏。(2)第6天禁食(不禁水)1 d。(3)第7天小鼠腹腔注射1%戊巴比妥钠0.2 ml麻醉,麻醉后经肛门插管约4 cm至乙状结肠,空白对照组小鼠用无菌注射器缓慢注入50%乙醇0.2 ml,其余3组小鼠用无菌注射器缓慢注入1%恶唑酮(50%乙醇溶液)0.2 ml,灌肠后将小鼠提尾倒置30 s以防反流。
1.2.2 小鼠恶唑酮结肠炎模型的药物干预:蒿甲醚:400 mg蒿甲醚溶于10 ml橄榄油。蒿甲醚治疗组每天剂量为100 mg/kg,以每只小鼠体质量20 g计算,给药1次/d,后腿肌注0.05 ml。地塞米松磷酸钠:5 mg地塞米松磷酸钠溶于25 ml双蒸水,DX治疗组每天剂量为成人的2倍,以每只小鼠体质量20 g计算,给药1次/d,后腿肌注0.05 ml。橄榄油:结肠炎组每天剂量与蒿甲醚治疗组相同,作为安慰剂,以每只小鼠体质量20 g计算,给药1次/d,后腿肌注0.05 ml。从灌肠造模1 d后开始,除空白对照组小鼠外其余3组小鼠连续给药4 d,每日在同一时间给药1次。
1.2.3 小鼠疾病活动情况的观察:从恶唑酮致敏之日开始每日观察小鼠体质量、精神状态、毛色、活动、进食、大便性状和便血情况,并进行疾病活动指数(DAI)评分。DAI评分=(体质量下降分数+大便性状分数+便血分数)/3。评分标准参照Cooper等[8]和Murano等[9]的方法改良。
1.2.4 小鼠结肠组织学改变的观察:(1)小鼠结肠HE染色切片光镜下观察:给药4 d后处死所有小鼠,腹部正中切口剖腹,取肛门至回盲部的结肠,沿肠系膜缘纵行剖开,PBS溶液冲洗干净后每只小鼠在直肠以上1~2 cm处远端结肠各取1块组织标本(10 mm×2 mm),10%甲醛固定,4 ℃冰箱保存。择日行常规石蜡包埋、切片(4 μm)、HE染色,光镜下观察。(2)小鼠结肠上皮细胞超微结构的观察:① 每只小鼠在直肠以上1~2 cm处远端结肠各取1块约1 mm3大小组织标本;② 前固定:2%戊二醛PBS固定液固定2 h(4 ℃);③ 漂洗:PBS缓冲液洗涤2次,每次10 min(4 ℃);④ 后固定:1%锇酸PBS固定液固定2 h(4 ℃);⑤ 漂洗:PBS缓冲液洗涤2次,每次10 min(4 ℃);⑥ 脱水:30%—50%—70%乙醇逐级脱水,每次10 min(70%乙醇含3%醋酸双氧铀),4 ℃块染,80%—95%—100%—100%乙醇逐级脱水,每次10 min;⑦ 置换:环氧丙烷2次,每次10 min;⑧ 浸透:环氧树脂618包埋液与环氧丙烷1∶1,2 h;环氧树脂618包埋液与环氧丙烷2∶1,过夜;纯环氧树脂618包埋液浸透(37 ℃,6 h);⑨ 包埋:60 ℃烘箱内放置48 h;切片:LKBV型超薄切片机切片;染色:枸橼酸铅电子染色;观察:使用PHILIP CM-120透射电镜观察标本。
1.2.5 小鼠循环血TNF-α和IL-13的测定:给药4 d后,对小鼠行眼球取血。固定小鼠头部,用高压灭菌弯嘴镊将小鼠一侧眼球拔除,塑料真空采血管采血,小鼠循环血4 ℃静置30 min后台式离心机离心(3 000 r/min,5 min),用移液器取上清液置于-80 ℃冰箱保存。ELISA法检测细胞因子含量:参照试剂盒说明书操作并绘制标准曲线,根据标准曲线方程计算小鼠血清TNF-α和IL-13的浓度。
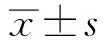
2 结果
2.1 小鼠一般情况空白对照组小鼠经3%恶唑酮皮肤致敏后24 h,出现懒动、毛色失去光泽。50%乙醇灌肠后体质量有所下降,随后逐渐增加,毛色恢复光泽,大便成形呈正常颗粒状,大便隐血均为(-)。结肠炎组经1%恶唑酮灌肠造模后体质量下降明显,大便稀或不成形,大便隐血阳性,4 d内死亡4只(4/10)。DX组死亡3只(3/10)。蒿甲醚组死亡2只(2/10)。
根据小鼠一般情况、便血等综合评定DAI,并进行组间比较,4组总体分布符合正态分布(P均>0.05),各组方差齐(P均>0.05)。结果显示,结肠炎组、DX组、蒿甲醚组在灌肠造模后DAI评分均明显高于空白对照组,差异有统计学意义(P<0.05);结肠炎组、DX组、蒿甲醚组之间两两比较,差异无统计学意义(P>0.05)。
结肠炎组、DX组、蒿甲醚组在给药第1~4天,DAI评分虽然有明显下降,但与空白对照组相比差异有统计学意义(P<0.05);结肠炎组、DX组、蒿甲醚组之间两两比较,差异无统计学意义(P>0.05)(见表1)。
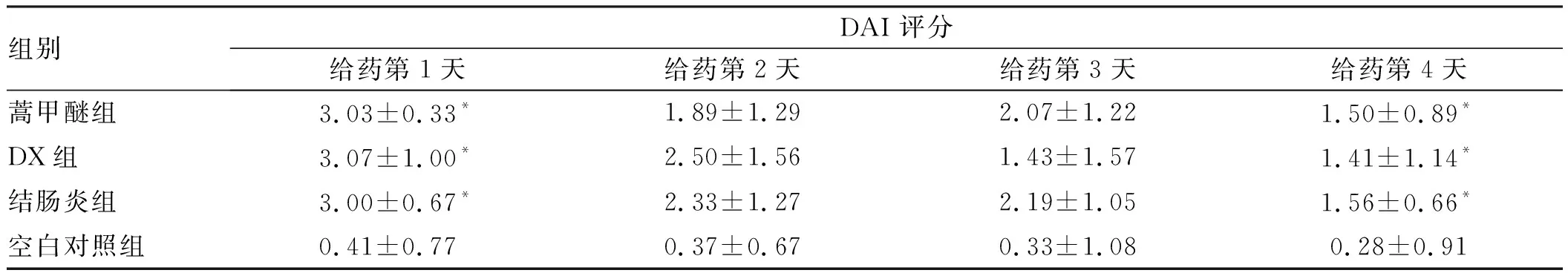
表1 实验性结肠炎小鼠DAI评分Tab 1 DAI score of experimental colitis mice
在线状图上可以见,结肠炎组、DX组和蒿甲醚组DAI与空白对照组DAI曲线呈明显分离趋势,而前三组趋势接近(见图1)。

图1 实验性结肠炎小鼠DAI评分趋势Fig 1 DAI score of experimental colitis mice
2.2 小鼠结肠病理及组织学改变空白对照组光镜下结肠黏膜结构基本正常,上皮完整。固有层腺体形态正常,隐窝结构正常。黏膜及黏膜下层无炎症细胞浸润或见少量中性粒细胞、淋巴细胞浸润。结肠炎组黏膜充血水肿,局灶性隐窝增宽、变形,隐窝细胞缺失、杯状细胞缺失,局部上皮脱落形成浅表性溃疡。黏膜及黏膜下层、黏膜肌层可见大量炎症细胞浸润,亦可见密集分布的淋巴细胞和单核细胞。
相比之下DX组结肠黏膜充血水肿轻于结肠炎组,光镜下可以见到局灶性隐窝增宽、变形,隐窝细胞缺失、杯状细胞缺失。黏膜及黏膜下层偶见少量炎症细胞;蒿甲醚组结肠黏膜轻度充血水肿,隐窝结构基本正常,偶见隐窝细胞缺失、杯状细胞缺失。黏膜及黏膜下层可见散在炎症细胞浸润,包括淋巴细胞、巨噬细胞和单核细胞(见图2)。

图2 小鼠结肠组织学改变(放大200倍) A: 空白对照组; B: 结肠炎组; C: DX组; D: 高甲醚组Fig 2 Histological changes in mice colon A: control group; B: colitis group; C: DX group; D: Artemether group
2.3 小鼠结肠上皮细胞超微结构改变透射电镜观察显示,空白对照组结肠上皮细胞排列紧密,微绒毛排列整齐,细胞间紧密连接、桥粒连接均正常。胞质内有丰富的线粒体、光面内质网和粗面内质网,腺体细胞形态正常。结肠炎组小鼠结肠上皮细胞脱落,结构破坏,微绒毛排列紊乱、缺失。胞浆空泡样变性,细胞核固缩,大量淋巴细胞浸润。相比之下,DX组结肠上皮细胞排列紧密,微绒毛排列较整齐,细胞间紧密连接、桥粒连接正常。可见少量线粒体肿胀,电子密度降低,脊溶解,细胞间可见较多淋巴细胞和成纤维细胞浸润;蒿甲醚组结肠上皮细胞排列紧密,微绒毛排列整齐,细胞间紧密连接、桥粒连接正常。胞质内可见大量的线粒体,少量线粒体肿胀,电子密度降低,脊溶解,腺体细胞基本正常,细胞间可见较多粒细胞、浆细胞、淋巴细胞和巨噬细胞浸润(见图3)。
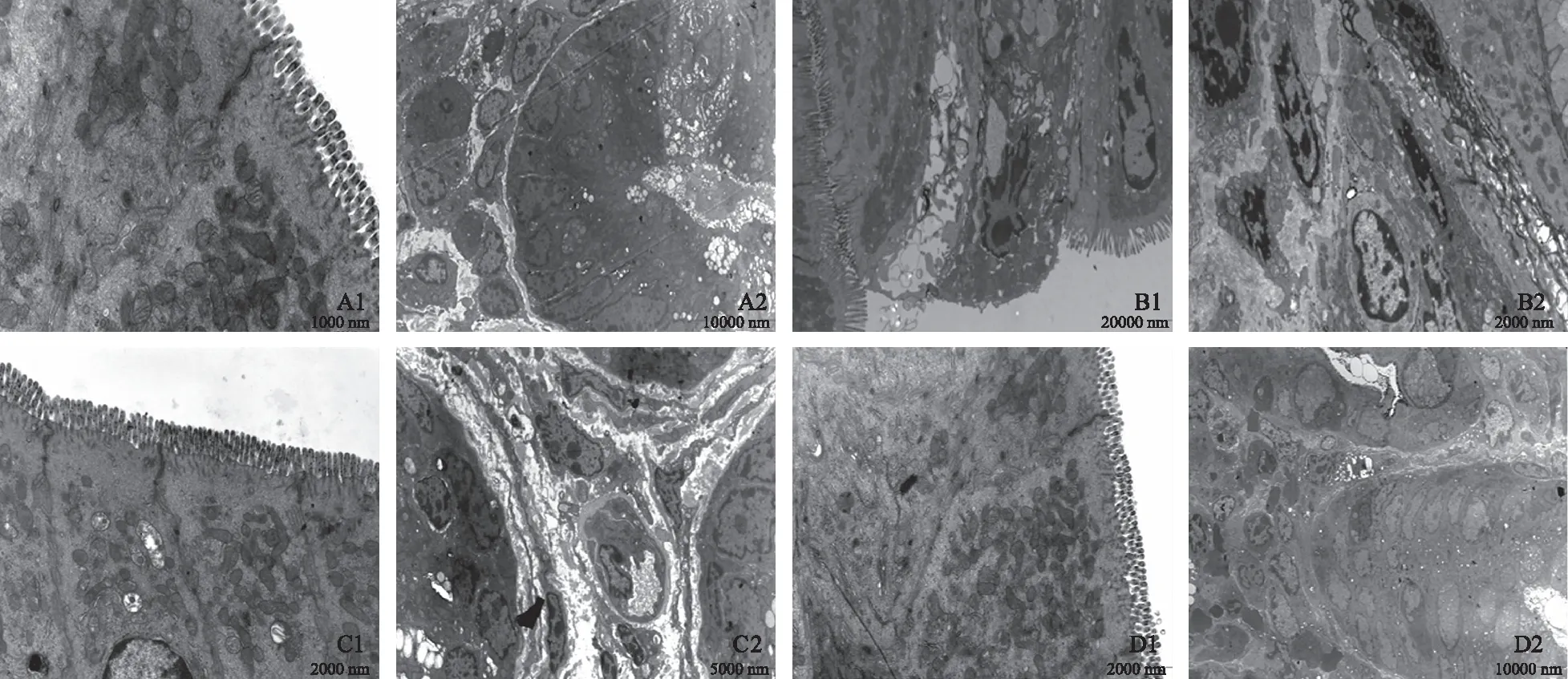
图3 小鼠结肠上皮细胞透射电镜下超微结构改变 A: 空白对照组; B: 结肠炎组; C: DX组; D: 高甲醚组Fig 3 Ultrastructural changes of colonic epithelial cells of mice under TEM A: control group; B: colitis group; C: DX group; D: Artemether group
2.4 小鼠循环血TNF-α和IL-13的检测结果应用ELISA方法检测小鼠循环血TNF-α与IL-13浓度,4组总体分别符合正态分布(P均>0.05),各组方差齐(P均>0.05)。结果显示,结肠炎组小鼠循环血中TNF-α表达高于空白对照组和DX组,差异有统计学意义(P<0.05);蒿甲醚组TNF-α均值虽低于结肠炎组,差异无统计学意义(P>0.05)。结肠炎组IL-13测定值低于空白对照组、DX组或蒿甲醚组,差异有统计学意义(P<0.05);而且蒿甲醚组与DX组比较,差异有统计学意义(P<0.05)(见表2)。
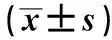
表2 小鼠循环血TNF-α、IL-13的表达与比较Tab 2 Expression and comparison of TNF-α and IL-13 in
3 讨论
过去认为IBD主要见于西方欧美国家,在我国则少见,但近年来我国的病例数呈逐年上升趋势[10]。Mosmann等[11]根据CD4+T细胞分泌细胞因子和生物功能的不同,将Th细胞分为Th1和Th2两大类。Th1细胞以表达IL-12、TNF-α和IFN-γ为主,介导细胞免疫;Th2细胞以表达IL-4、IL-5、IL-13为主,介导体液免疫。Th1和Th2细胞之间相互作用调节着机体免疫平衡,维持机体内环境的相对稳定。不少研究报道Th1/Th2亚群失衡可能是IBD的重要发病机制之一。在此基础上,生物治疗应运而生,通过调节体内的免疫格局来达到治疗IBD的目的,抗TNF-α抗体(英夫利昔单抗,IFX)是目前最常用的生物制剂,一项研究显示,对中重度CD患者早期给予IFX后可有效促进黏膜愈合,愈合后可维持3~4年无需继续使用IFX[12]。但IFX的缺点也很明显,费用昂贵且存在不良反应[13]。因此人们迫切希望找到一种疗效类似,价格又相对低廉的药物来治疗IBD。青蒿素是我国自主知识产权中药,其高效衍生物蒿甲醚已被世界卫生组织列为一线抗疟药,具有类似IFX的干预上述细胞因子的免疫调节功能,故我们尝试将其用于治疗IBD。
鉴于我国IBD的发病特点是以UC为主,因此在本实验中,我们选择了病理学特征与人类UC十分相似的小鼠恶唑酮急性结肠炎模型,以探讨蒿甲醚对实验性UC发病的治疗作用和可能的机制。恶唑酮诱导的小鼠结肠炎被认为是由NKT细胞活化并分泌IL-13启动的Th2型反应,细胞因子分泌则以IL-4过量生成为主[14,5]。本实验中,在恶唑酮灌肠造模到药物治疗结束期间,结肠炎组共死亡4只小鼠,DX组共死亡3只小鼠,蒿甲醚组共死亡2只小鼠,死亡率分别为:40%、30%和20%。陈曦等[15]报道,小鼠恶唑酮灌肠造模后如不予任何干预,4 d内死亡率在50%左右,本实验与之基本相符。而且小鼠灌肠造模后均满足DAI评分≥2,因此认为恶唑酮小鼠UC造模成功。
结肠黏膜充血水肿程度、上皮细胞完整性、杯状细胞和隐窝的缺失程度、炎症细胞的浸润程度,都是反映UC炎症程度的重要指标。本实验中,DX组和蒿甲醚组的上述指标均较结肠炎组为轻;DAI是全面反映UC疾病严重程度的重要指标,本实验中,DX组和蒿甲醚组的DAI评分均低于结肠炎组。以上提示:蒿甲醚具有和DX相似的抗炎、修复结肠组织、稳定细胞结构和改善UC症状的作用。但蒿甲醚组上皮细胞间炎症细胞浸润程度较DX组重,提示蒿甲醚抑制炎症细胞聚集的能力弱于地塞米松磷酸钠。
最后我们取小鼠循环血作ELISA检测,研究蒿甲醚对分属Th1类和Th2类的细胞因子TNF-α和IL-13的影响,以进一步探索蒿甲醚的治疗机制。小鼠急性恶唑酮结肠炎,受损的肠黏膜被大量炎症细胞浸润,其中活化的单核巨噬细胞等分泌大量的TNF-α是IBD发病中很重要的损伤性细胞因子之一。较早的报道就显示UC血清TNF-α的分泌水平及结肠黏膜mRNA的表达高于正常或未受累的结肠黏膜,并提示其与病情轻重和病变累及范围呈正相关[16]。TNF-α不仅能直接影响上皮细胞紧密连接蛋白的表达及分布,并能与IFN-γ呈协同作用,诱导MLCK等紧密连接调节蛋白的表达,从而进一步损伤肠黏膜组织,以旁分泌和自分泌的方式放大肠道的炎症反应[17]。而一旦抑制了TNF-α的合成、分泌,就能有效地抑制肠道局部的炎症反应[18]。Fischer等[19]研究表明,TNF-α单克隆抗体阿达木单抗可以缓解TNF-α引起的结肠癌细胞紧密连接蛋白表达减少所导致的细胞屏障功能紊乱及渗透性增加。本实验中,与DX组相比,结肠炎组的TNF-α水平明显升高,差异有统计学意义;而蒿甲醚组的均值虽然低于结肠炎组,但两者比较差异无统计学意义。因此我们认为,蒿甲醚抑制TNF-α合成和分泌的效果较弱,或可能并无直接的抑制作用。IL-13是白介素家族中的重要一员,与IL-4和IL-10存在交互影响。小鼠急性恶唑酮结肠炎类似于UC患者的临床免疫特征,主要表现为Th2型免疫应答,肠壁黏膜组织中激活的CD4+T细胞主要分泌IL-4和IL-13[20-21]。IL-4对Th2的分化最为关键,能刺激Ⅰ型和Ⅱ型两种受体,促进Th2的分化,后续的研究发现IL-13与IL-4共用一个受体[22],二者在结构和功能上有许多共同之处,故而认为IL-13可能是Th2型免疫应答的启动因子。IL-13被认为具有多重调节免疫靶细胞的作用,一方面可以通过延迟caspase-3和caspase-8的活化、诱导蛋白激酶B的活化和下调BCL-XL的表达,发挥抗肠上皮HT-29细胞凋亡的作用;另一方面可以诱导单核细胞多形性变化,上调整合素超家族和MHCⅡ类分子的表达,抑制IL-1、IL-6、IL-8和TNF-α等促炎因子的产生。在本实验中,结肠炎组IL-13表达低于其他各组,且差异均有统计学意义,而蒿甲醚组IL-13表达最高,且其与DX组的差异也有统计学意义。因此我们认为UC患者循环血IL-13浓度低于正常人,IL-13在UC中主要起抗炎作用,蒿甲醚能够有效上调循环血中IL-13的浓度,从而间接抑制TNF-α等促炎因子的产生,并且效果较地塞米松磷酸钠更佳。
综上所述,蒿甲醚能够减轻小鼠急性恶唑酮结肠炎的病情。其具体的治疗作用可能涉及如下机制:(1)直接抑制炎症细胞,减轻上皮细胞的损伤,稳定细胞结构和功能;(2)通过上调IL-13等抗炎因子的表达,间接抑制TNF-α等促炎因子的表达。蒿甲醚与地塞米松磷酸钠相比,在具体指标上互有优劣,但总体疗效相当。
目前有关IL-13等细胞因子在UC中的作用仍有很多争议,但Th1/Th2失衡在IBD发病机制中的重要地位是毋庸置疑的,纠正Th1/Th2失衡将成为今后治疗IBD的一个新思路。蒿甲醚虽对动物模型有效,是否适合人类UC患者、其应用指征、治疗的时机、剂量、疗程及不良反应与安全性等等,需要更多的动物实验资料、结合其对人体病变组织的作用及大样本随机对照临床试验进一步阐明。

