基因间长链非编码RNA 00511促进人胃癌细胞增殖的实验研究
付非非, 刘志利, 沈 冬, 张 婷, 陈 洁, 茅卫东
徐州医科大学江阴临床学院肿瘤科,江苏 江阴 214400
胃癌来自于胃壁最表层的黏膜上皮细胞,可累及胃的各个部位,以腺癌居多。在我国,胃癌的发生率和死亡率均排在第三位,是除肺癌、肝癌之外的第三大致死性肿瘤。据全国肿瘤登记中心发布的2015年中国癌症数据统计结果显示,我国现有胃癌患者约67.9万例,因胃癌死亡的患者约49.8万例[1-2]。虽然随着医疗水平的发展,手术水平日益提高,放化疗技术逐渐普及,靶向药物不断问世,胃癌患者的生活质量有所改善,但晚期胃癌患者的预后并不理想。胃癌的演变不仅取决于遗传因素、人体自身的生理状况,肿瘤本身特性也带来很大的影响,其中肿瘤的增殖是胃癌进展及预后不良的重要因素之一。因此,探索与胃癌细胞增殖有关的治疗靶点是一项十分艰巨而重要的任务。
长链非编码RNA(long noncoding RNA, lncRNA)是非编码RNA家族的重要成员之一,其转录本长度>200个核苷酸,无蛋白编码能力,但可在表观遗传学水平、转录及转录后水平参与调控[3-4]。随着科技的进步,在非编码RNA领域,研究者们不断展现出新的、有价值的研究成果,其在疾病中的作用特点和机制也一步步得到阐明[5-6]。与蛋白质编码基因一样,这些lncRNA也有癌基因和抑癌基因之分,其中研究相对较成熟的癌基因主要包括PVT1、HOTAIR、H19等[7-9],抑癌基因主要有MEG3、GAS5等[10-11]。基因间长链非编码RNA 00511(long intergenic noncoding RNA 00511,LINC00511)是一种新发现的lncRNA,定位于染色体17q24.3区域,全长1 716 nt,包括5个外显子[12]。最新研究报道,LINC00511在非小细胞肺癌、胰腺癌、乳腺癌、膀胱癌、舌癌、肝癌、骨肉瘤等[13-19]恶性肿瘤中显著表达,影响着肿瘤的增殖、侵袭和凋亡等生物学功能,甚至有希望成为评估肿瘤患者生存及预后的指标之一。但关于LINC00511与胃癌的相互作用及机制仍不清楚。本研究通过实验探讨LINC00511在胃癌组织中的表达情况及在AGS、SGC-7901细胞增殖过程中的作用情况。
1 材料与方法
1.1 材料
1.1.1 细胞和组织:人胃癌细胞株AGS、SGC-7901购自中国医学科学院上海细胞库,正常胃黏膜上皮细胞(GES-1)及胃癌细胞株MGC-803由徐州医科大学江阴临床学院中心实验室保种。51例胃癌组织标本(癌组织和癌旁组织)来自于徐州医科大学江阴临床学院2011年5月至2014年5月被确诊为胃癌并行手术切除的患者。男29例,女22例;年龄21~81岁,中位年龄65岁;肿瘤大小:>3 cm者25例,≤3 cm者26例;肿瘤部位:胃窦部34例,胃体或贲门部17例;浸润深度:T1~T2期23例,T3~T4期28例;淋巴结转移:有淋巴结转移者33例,无淋巴结转移者18例。患者手术前均未接受任何抗肿瘤治疗。所有组织切除后立即置于液氮中冷冻,并于-80 ℃冰箱中保存。本研究已通过徐州医科大学江阴临床学院医学伦理委员会批准,审批号:(2018)伦审研第(035)号,已取得患者及家属的知情同意,并签署知情同意书。
1.1.2 主要试剂与仪器:试剂:Trizol(美国Invitrogen公司)、PrimeScript RT试剂盒、SYBR Premix Ex TaqⅡ(日本TaKaRa公司)、RPMI-1640、F12K培养基、胎牛血清、Opti-MEM(美国Invitrogen公司)、转染试剂脂质体2000(美国Invitrogen公司)、sh-RNA表达载体(吉玛基因);仪器:离心机(Thermo公司)、紫外分光光度计(Eppendorf公司)、PCR仪(Bio-rad公司);引物序列(上海生物工程有限公司合成):GAPDH:上游5′-AGCCACATCGCTCAGACAC-3′,下游5′-GCCCAATACGACCAAATCC-3′;LINC00511:上游5′-CAGAACTGGTCGCTGCCTTCAC-3′,下游5′-CGATGAGGTCATACGCCGTAAGTC-3′。
1.2 方法
1.2.1 细胞培养和转染:培养基配置:胃癌细胞AGS:90%F12K+10%FBS,SGC-7901:90%RPMI-1640+10%FBS,MGC-803和GES-1:90%DMEM+10%FBS,培养条件:温度37 ℃、体积分数为5%的CO2。每隔2 d更换完全培养基,当细胞汇合度为80%~90%时开始传代。取对数生长期的细胞(AGS、SGC-7901、MGC-803),胰酶消化后以1×105/孔接种于6孔板,继续恒温培养。待细胞密度达到80%时,采用阳离子脂质体法进行转染(用于转染的sh-NC、sh-LINC00511由苏州吉玛基因公司合成),操作步骤严格按Lipo2000说明书进行,转染后的细胞分别标记为sh-NC组、sh-LINC00511组。转染后6 h更换质量浓度为100 g/L胎牛血清的培养基继续培养,48 h后收样进行qRT-PCR检测转染效率。干扰序列由苏州吉玛基因公司设计合成:sh-1#: GCTGACCCTGAACTTGAATCT,sh-2#: TTCTCCGAACGTGTCACGT。
1.2.2 RNA提取及qRT-PCR:用Trizol试剂提取总RNA。采用PrimeScript RT试剂盒将RNA逆转录cDNA,按SYBR Premix Ex TaqⅡ说明书进行PCR反应,检测LINC00511的表达水平。结果用GAPDH的表达量进行标准化,每个体系设置3个复孔。反应总体系20 μl:cDNA模板0.5 μl,2×SYBR Green PCR Master Mix 10 μl,RNase Free ddH2O 7.9 μl,上下游引物各0.8 μl。设置反应条件:预变性:95 ℃,30 s,变性:95 ℃,5 s,退火:60 ℃,30 s;共设置40个循环。以上实验重复3次,实验数据采用公式2-△△ct计算。
1.2.3 CCK8检测细胞增殖:按上述方法转染2株胃癌细胞,分别标记为sh-NC组和sh-LINC00511组,继续培养48 h,胰蛋白酶消化,调整离心机转速1000 r/min,离心5 min,显微镜下调整细胞浓度为1×105ml-1,以每孔细胞悬液100 μl接种于6孔板中,置于恒温培养箱中培养24 h,设置条件为温度37 ℃、体积分数为5%的CO2。每孔加CCK8试剂10 μl,继续培养1 h,取出培养1~5 d的各组细胞,用酶标仪测定在450 nm处的吸光度值(OD450 nm),分析数据并绘制增殖曲线。每组设置5个复孔,取平均值,同时设置不含细胞的培养基作对比。
1.2.4 克隆形成实验:用同样的方法转染2株胃癌细胞,分别标记为sh-NC组和sh-LINC00511组,继续培养48 h,胰蛋白酶消化,调整离心机转速1000 r/min,离心5 min,显微镜下调整细胞浓度,以每孔500个细胞接种于6孔板中。补足质量浓度为100 g/L胎牛血清的培养基1.5 ml,置于培养箱中培养2周至细胞集落形成(每3 d更换新鲜培养基)。多聚甲醛固定细胞10 min后弃去固定液,加入适量结晶紫染色15 min,然后用去离子水清洗晾干后,拍照计数。以上实验重复3次。
1.3 统计学分析采用SPSS 21.0软件进行统计学分析,LINC00511在胃癌组织及细胞系中表达水平的比较采用t检验,LINC00511表达水平与临床病理特征之间的相关性分析采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 LINC00511在胃癌组织及细胞株中的表达对51例胃癌患者的组织标本(癌组织、癌旁组织)中LINC00511的表达量进行检测。可以发现,LINC00511在胃癌及癌旁组织中的表达差异有统计学意义(P<0.05,见图1)。用同样的技术对GSE-1及胃癌细胞AGS、SGC-7901、MGC-803中LINC00511的表达量进行检测。结果表明,相对于GSE-1而言,LINC00511在胃癌细胞系中的表达量显著升高(P<0.05,见图2)。
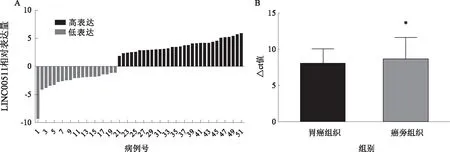
注:与胃癌组织相比,*P<0.05。
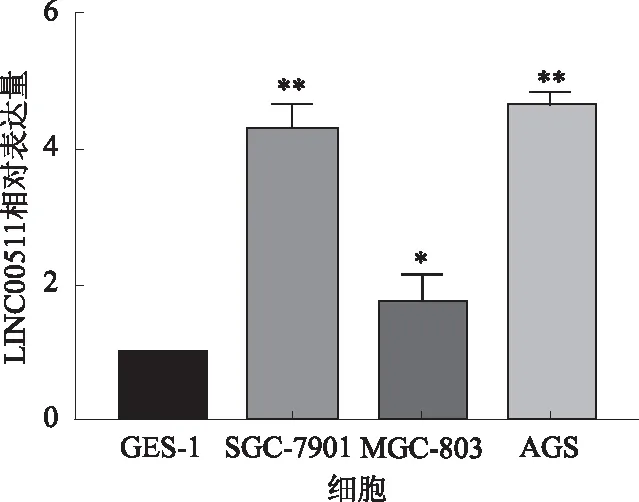
注:与GES-1相比,*P<0.05,**P<0.01。
2.2 胃癌组织中LINC00511表达水平与临床病理资料的关系按照LINC00511在胃癌组织中的表达程度将51例胃癌患者分为两组(2-△△ct≤1为低表达组,2-△△ct>1为高表达组),分析其表达水平与临床病理资料之间的相关性。结果显示,LINC00511的表达与胃癌的浸润深度和淋巴结转移情况有相关性(P<0.05),而与患者性别、年龄、肿瘤部位、分化程度及肿瘤大小无相关性(P>0.05,见表1)。

表1 LINC00511的表达水平与临床病理特征的关系Tab 1 Correlation between LINC00511 expression and clinicopathological characteristics
2.3 sh-1#、sh-2#对胃癌细胞的干扰效率本课题组设计合成了2种sh-LINC00511质粒表达载体(分别表示为sh-1#、sh-2#),转染胃癌细胞AGS、SGC-7901,并对转染效果进行qRT-PCR检测。结果表明:与sh-NC组相比,转染sh-1#后,LINC00511在胃癌细胞AGS、SGC-7901中的表达效率分别为0.56±0.04和0.77±0.08(P<0.05);转染sh-2#后,LINC00511在胃癌细胞AGS、SGC-7901中的表达效率分别为0.39±0.05和0.48±0.05(P<0.01,见图3),sh-2#干扰效率优于sh-1#,以下实验采用sh-2#做进一步干扰。
2.4 下调LINC00511的表达对细胞增殖功能的影响CCK8实验显示,转染sh-LINC00511后,胃癌细胞AGS和SGC-7901的增殖显著受限(P<0.05,见图4)。克隆形成实验表明,转染sh-LINC00511的胃癌细胞AGS、SGC-7901的克隆数显著减少(P<0.01,见图5)。
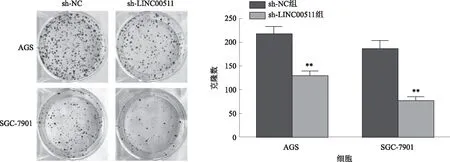
注:与sh-NC组比较,**P<0.01。图5 克隆形成实验检测转染后细胞能力的变化
3 讨论
胃癌发生的诱因及病因众多,目前认为,不良的生活环境、不规律的作息方式、不健康的饮食习惯及幽门螺杆菌感染等因素可刺激胃黏膜上皮细胞慢性炎症的产生,久而久之诱发其向癌变转化。在此变化过程中,胃黏膜上皮细胞增殖和凋亡的动态平衡难以维持,癌基因(ras、c-myc、bcl-2)的激活及抑癌基因(野生型p53、APC、DCC)的失活,使胃上皮细胞增殖能力活跃而凋亡能力低下,从而逐渐进展为胃癌。更重要的是,基因测序及分子生物学技术日益成熟,研究者们愈来愈认识到LincRNA在细胞生物活动中的重要作用。有研究发现,LincRNA几乎参与到胃癌细胞增殖、侵袭及凋亡的全过程,甚至可以作为评估胃癌患者预后指标之一。如在胃癌中,lncRNA HOTAIR经过海绵化作用与miR-331-3p竞争,减弱其对于下游靶基因HER2的负性调控作用,从而促进胃癌细胞的恶性生物学行为,发挥癌基因的功能[20]。相反,LincRNA MEG3则表现为抑癌基因的作用,LincRNA MEG3的表达量越低,胃癌细胞增殖及侵袭能力越强,凋亡能力越弱[21]。
LincRNA存在一个具有标志性的功能区—K4、K36功能区,是LincRNA的一个共同特征。这一功能区的组成包括其启动子区组蛋白H第4位赖氨酸的三甲基化(H,K4me3)及转录区在组蛋白H3第36位赖氨酸的三甲基化(H3, K36me3),这也是其保守性所在之处。Guttman等[22-23]通过分析不同类型细胞的染色质状态图得出一个有趣的结果,小鼠体内约1 600个LincRNA,在这些LincRNA中,至少有95%展现出很强的进化保守性。从这方面来说,LINCRNA可能是生物体生命活动的重要参与者。单核苷酸多态性(SNPs)是因为单个核苷酸碱基的变化而造成的核算序列的多态性。对LincRNA而言,SNP分布少,但功能十分强大,作用范围更广泛。有文献[24]报道,大多数SNPs会直接影响LincRNA的表达水平,而对临近蛋白编码基因的影响甚微。有学者发现[25],LincRNA-ENST00000515084上C等位基因的变异使乳腺癌的患病风险增大。SNP这一特点可能与LincRNA的致病性有关。
近年来,作为一个全新的lncRNA,LINC00511受到越来越多研究者的关注。作为lncRNA家族的成员之一,LINC00511已被发现与多种疾病,尤其是肿瘤的演变和发展息息相关,其作用机制也各有不同。在胰腺癌中,过度表达的LINC00511经过海绵化作用降低hsa-miR-29b-3p的表达,削弱其对于靶基因VEGFA的负性调控作用,使VEGFA的表达水平升高,促进肿瘤的演变及进展[14];而对于骨肉瘤(OS)而言,LINC00511对OS细胞MG63功能的影响是下调miR-765的表达及促进上皮间充质转化(EMT)进程来实现的[19]。本研究通过qRT-PCR的方法进行检测,发现LINC00511在胃癌组织和细胞中高表达。LINC00511的表达水平降低,胃癌细胞的增殖能力明显受限。进一步分析临床资料发现,LINC00511的表达和肿瘤的淋巴结转移情况相关。
综上所述,在胃癌及癌旁组织中存在差异表达的LINC00511,LINC00511表达程度高的患者肿瘤浸润程度更深,更容易出现淋巴结转移。高表达的LINC00511能够促进胃癌细胞AGS、SGC-7901的增殖,可能成为胃癌发生、发展的重要因素之一,为胃癌的诊断及靶点的寻找提供了新的思路。然而,关于LINC00511在胃癌侵袭和凋亡中的作用及具体机制仍需要进一步探索。

