LINC01224靶向miR-125b对口腔鳞癌细胞增殖及凋亡的影响
马立亚,王东旭,庞真贞
(1.保定市第四中心医院口腔科,河北保定 072350;2.保定市第一中心医院口腔科,河北保定 071000)
口腔鳞癌(OSCC)属于临床常见的头颈部恶性肿瘤。长链非编码RNA(LncRNA)在OSCC组织及细胞系中表达异常并可调控OSCC细胞增殖、迁移及侵袭等生物学行为[1-3]。 LncRNA LINC01224在肝癌中表达上调,沉默LINC01224表达可抑制肝癌进展[4]。有学者通过生物信息学分析结果发现,miR-125b可能为LINC01224的靶基因,上调miR-125b表达可抑制乳腺癌细胞增殖并诱导细胞凋亡[5]。但LINC01224能否通过调控miR-125b的表达从而影响OSCC细胞增殖及凋亡过程尚未可知。因此,本研究通过检测OSCC患者组织中LINC01224的表达水平并分析其对OSCC细胞增殖及凋亡的影响,探讨LINC01224对miR-125b的靶向调控作用,旨在为揭示OSCC发生及发展的分子机制提供实验依据。
1 材料与方法
1.1研究对象 收集2017年2月至2018年3月保定市第四中心医院口腔科收治的35例OSCC患者为研究对象,其中男25例,女10例,年龄(56.4±10.2)岁,均经手术后病理组织学证实为OSCC。纳入标准:患者未接受放疗或化疗等治疗;临床资料完整者。排除标准:合并其他恶性肿瘤患者;合并其他基础性疾病患者。于术中切除OSCC癌组织及癌旁组织,置于液氮中保存,术后转移至-80 ℃保存。本研究经医院医学伦理委员会批准(批准文号:2017000152),患者知情同意。
1.2主要仪器及试剂 口腔鳞癌细胞系CAL-27(美国ATCC细胞库)。杜氏改良培养基(DMEM)、胎牛血清(美国Gibco公司),胰蛋白酶、Lipofectamine 2000(美国Thermo Fisher公司),Trizol试剂(美国Invitrogen公司),反转录试剂盒、SYBR Green试剂盒(北京天根生化科技公司),LI NC01224小分子干扰RNA(si-LINC01224)、乱序无意义阴性序列(si-NC)、miR-125b寡核苷酸模拟物(miR-125b mimics)及阴性对照mimic NC序列(miR-NC)、miR-125b特异性寡核苷酸抑制剂(anti-miR-125b)及其阴性对照(anti-miR-NC)均购自广州锐博生物科技公司,甲基噻唑基四唑(methylthiazolyl tetrazolium,MTT)、二甲基亚砜(dimethylsulfoxide,DMSO)均购自美国Sigma公司,膜联蛋白V(annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡试剂盒、RIPA裂解液、二喹啉甲酸(bicinchoninicacid,BCA)蛋白定量检测试剂盒(北京全式金生物技术公司),兔抗人半胱氨酰天冬氨酸特异性蛋白酶3前体蛋白(pro-cysteinyl aspartate-specific protease-3,pro-caspase-3)、增殖标记蛋白细胞增殖核抗原67(antigen identified by monoclonal antibody,Ki67)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(clv-caspase-3)、兔抗人P21单克隆抗体(美国CST公司),辣根过氧化物酶(HRP)标记的山羊抗兔二抗(武汉艾美捷科技公司)。 StepOnePlus实时荧光定量PCR仪(美国ABI公司),Nanodrop2000c超微量分光光度计(北京众力挽生物科技公司),CytoFLEX流式细胞仪(美国贝克曼库尔特公司),CA-2000酶联仪(上海掌动医疗科技公司),DYCZ-24DN电泳仪(北京海天友诚科技公司)。
1.3方法
1.3.1细胞转染及实验分组 CAL-27细胞培养于含10%胎牛血清、100 U/mL青霉素与100 μg/mL链霉素的DMEM完全培养基,置于37 ℃、5%CO2培养箱中培养,每隔2 d更换液1次。待细胞生长至80%融合度时,采用2.5 g/L胰蛋白酶消化,加入培养基制备细胞悬液,调整细胞密度为5×104/mL,按照每孔100 μL的细胞密度接种于24孔细胞培养板,参照Lipofectamine 2000说明书分别将si-NC(20 μmol/L)、si-LINC01224(20 μmol/L)、si-LINC01224(20 μmol/L)与anti-miR-NC(20 μmol/L)、si-LINC01224(20 μmol/L)与anti-miR-125b(20 μmol/L)转染至CAL-27细胞,设si-NC组(20 μmol/L)、si-LINC01224组(20 μmol/L)、si-LINC01224+anti-miR-NC组(si-LINC01224 20 μmol/L+anti-miR-NC 20 μmol/L)、si-LINC01224+anti-miR-125b组(si-LINC01224 20 μmol/L+anti-miR-125b 20 μmol/L),转染6 h后将培养基更换为含10%胎牛血清的DMEM完全培养基,继续培养48 h,收集对数期细胞进行功能验证。
1.3.2RNA提取及逆转录反应 取出冻存的OSCC癌组织、癌旁组织及各组转染后的CAL-27细胞,采用Trizol法提取组织及细胞中的总RNA,应用Nanodrop2000c超微量分光光度计检测RNA浓度与纯度(浓度406.4 ng/μL,纯度约为1.906),置于-80 ℃保存。取2 ng RNA进行后续实验,按照反转录试剂盒说明书将RNA反转录为cDNA,置于-20 ℃保存。
1.3.3实时荧光定量聚合酶链反应(qRT-PCR)检测 根据GenBank中LINC01224及miR-125b基因的序列号(分别为GI:703491628、GI:440524748),采用Primer Premier 5.0软件设计引物,并送上海生工公司合成。LINC01224上游引物序列:5′-TGACACTTCTTGCCTGCAAC-3′,下游引物序列:5′-ACTTCTGCTTCCCGAGTTCA-3′,产物片段136 bp;miR-125b上游引物序列:5′-CCCTGAGACCCTAACTTGTGA-3′,下游引物序列:5′-GGTCTGTGTGTCTCCTCTGA-3′,产物片段152 bp;U6上游引物序列:5′-GCTTCGGCAGCACATATACT-3′,下游引物序列:5′-GTGCAGGGTCCGAGGTATTC-3′,产物片段255 bp;GAPDH上游引物序列:5′-AACGGATTTGGTCGTATTG-3′,下游引物序列:5′-GGAAGATGGTGATGGGATT-3′,产物片段325 bp。以cDNA为模板进行qRT-PCR反应。PCR总反应体系为25 μL,包括10 μmol/L上、下游引物各1 μL,10 μmol/L dNTPs 4 μL,10×PCR buffer 1 μL,模板DNA 2 μL,无菌ddH2O补足体积至25 μL。LINC01224以GAPDH为内参,miR-125b以U6为内参。反应参数:95 ℃预变性3 min;95 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,共35个循环;72 ℃ 5 min。于60 ℃时用StepOnePlus软件采集荧光信号并进行熔解曲线分析,采用2-ΔΔCt法计算LINC01224、miR-125b相对表达水平。
1.3.4细胞周期检测 收集各组对数期的CAL-27细胞,采用2.5 g/L胰蛋白酶消化,DMEM完全培养基调整细胞密度为1×106/mL,4 ℃、1 071×g离心5 min,加入预冷PBS洗涤后,500 μL预冷PBS重悬细胞,加入预冷70%乙醇3.5 mL,充分混匀,4 ℃温育24 h。取出细胞悬液,4 ℃、9 990×g离心5 min,弃上清液,PBS洗涤,9 990×g离心5 min后弃上清液。向细胞沉淀中加入50 μL RNaseA,37 ℃温育30 min,加入PI染色液450 μL,4 ℃温育30 min,应用流式细胞仪检测G1期、S期、M期细胞比例。
1.3.5MTT试验检测细胞增殖 收集各组对数期的CAL-27细胞接种于96孔细胞培养板(3×104个/孔),每组设置3个复孔,转染48 h时每孔加入5 mg/mL MTT溶液20 μL,37 ℃培养箱继续培养4 h。4 ℃条件下经1 300×g离心5 min,弃上清液,每孔加入150 μL DMSO溶液,室温避光振荡温育5 min。用酶联仪检测各孔吸光度值(A值),计算细胞存活率,公式为:细胞存活率=(各实验组A值-空白对照组A值)/(正常对照组A值-空白对照组A值)×100%。实验重复3次。
1.3.6流式细胞术检测细胞凋亡率 收集各组对数期的CAL-27细胞,预冷PBS清洗,4 ℃、3 000×g离心5 min,弃上清液,加入500 μL Binding Buffer悬浮细胞,依次分别加入5 μL annexin V-FITC与5 μL PI染液,充分混匀,室温避光温育10 min,用流式细胞仪检测各组细胞凋亡率。凋亡率=(早期凋亡细胞+晚期凋亡细胞)/细胞总数×100%。
1.3.7双荧光素酶报告试验检测LINC01224的靶基因 采用StarBase软件(http://starbase.sysu.edu.cn/agoClipRNA.php?source=mRNA)预测LINC01224与miR-125b存在结合位点,将含有结合位点及突变位点的序列片段分别插入荧光素酶报告基因载体构建野生型载体WT-LINC01224、突变型载体MUT-LINC01224,将miR-NC、miR-125b mimics分别与WT-LINC01224、MUT-LINC01224共转染至CAL-27细胞,转染条件同1.3.1。置于37 ℃培养箱中继续培养48 h,收集细胞并检测其荧光素酶活性(萤火虫荧光素酶活性/海肾荧光素酶活性)。
1.3.8western blot检测 收集各组对数期的CAL-27细胞(5×103个/孔),加入400 μL RIPA裂解液提取细胞总蛋白质。采用BCA法测定蛋白质浓度。将上述蛋白质样品按200 μg的总蛋白质量进行聚丙烯酰胺凝胶电泳(积层胶采用80 V电压,分离胶采用100 V电压),转移至PVDF膜上。转膜结束后将膜置于50 g/L脱脂牛奶中室温封闭1 h,加入兔抗人pro-caspase-3、Ki67、clv-caspase-3、P21抗体(均1∶1 000稀释)。 TBS/T洗膜3次,每次5 min,加入HRP标记的羊抗兔IgG、羊抗鼠IgG二抗(1∶5 000稀释),37 ℃温育l h。TBS/T洗膜5次后,曝光并采用Image J软件对条带进行灰度扫描及结果判读。实验重复3次。

2 结果
2.1LINC01224在OSCC患者癌组织及癌旁组织中的表达 与癌旁组织比较,OSCC患者癌组织中LINC01224的表达水平(2.43±0.17 vs 1.00±0.05)显著升高(t=98.345,P<0.05),miR-125b的表达水平(0.98±0.06 vs 0.22±0.02)显著降低(t=71.091,P<0.05)。
2.2抑制LINC01224对CAL-27细胞增殖的影响 与si-NC组比较,si-LINC01224组细胞存活率显著降低(P<0.05),G1期细胞比例显著增加(P<0.05),S期细胞比例显著减少(P<0.05);Ki67蛋白水平显著降低(P<0.05),P21蛋白水平显著升高(P<0.05)。见图1、表1。
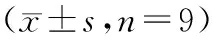
表1 抑制LINC01224对CAL-27细胞增殖的影响
2.3抑制LINC01224对CAL-27细胞凋亡的影响 与si-NC组比较,si-LINC01224组细胞凋亡率显著升高(P<0.05),pro-caspase-3蛋白水平显著降低(P<0.05),clv-caspase-3蛋白水平显著升高(P<0.05)。见图2、表2。
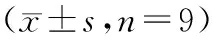
表2 抑制LINC01224对CAL-27细胞凋亡的影响
2.4LINC01224靶向调控miR-125b StarBase软件预测结果显示LINC01224与miR-125b存在结合位点,共转染野生型载体WT-LINC01224的细胞试验中,与miR-NC组(0.97±0.06)比较,miR-125b组荧光素酶活性(0.38±0.04)显著降低(t=24.545,P<0.05);共转染突变型载体MUT-LINC01224的细胞试验中,miR-125b组荧光素酶活性(0.99±0.06)与miR-NC组(0.96±0.06)比较差异无统计学意义(P>0.05)。与si-NC组(1.01±0.06)比较,si-LINC01224组细胞中miR-125b的表达水平(2.96±0.08)显著升高(t=58.500,P<0.05)。
2.5抑制miR-125b可逆转抑制LINC01224对CAL-27细胞增殖、凋亡的影响 与si-LINC01224+anti-miR-NC组比较,si-LINC01224+anti-miR-125b组细胞存活率显著升高(P<0.05),细胞凋亡率显著降低(P<0.05),G1期细胞比例显著减少(P<0.05),S期细胞比例显著增加(P<0.05),pro-caspase-3、Ki67蛋白水平显著升高(P<0.05),clv-caspase-3、P21蛋白水平显著降低(P<0.05)。见图3、表3、表4。
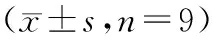
表3 抑制miR-125b可逆转抑制LINC01224对CAL-27细胞增殖、凋亡的影响
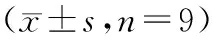
表4 western blot检测pro-caspase-3、clv-caspase-3、Ki67、P21蛋白的表达
3 讨论
研究发现,LINC01224在乳腺癌中呈高表达并可作为评估乳腺癌患者预后的生物学标志物[6]。本研究结果显示,LINC01224在OSCC组织中呈高表达,提示LINC01224在OSCC发生过程中可能发挥重要调控作用。我们还发现抑制LINC01224表达后OSCC细胞增殖能力显著降低,细胞凋亡率显著增高,提示抑制LINC01224表达可抑制OSCC细胞增殖,促进细胞凋亡。Ki67是肿瘤细胞增殖所需的DNA结合蛋白,其在肿瘤增殖各期均有表达;P21可负向调控细胞周期,抑制细胞增殖[7-8]。细胞凋亡过程与caspase级联反应密切相关,caspase-3被激活后可诱导细胞凋亡[9]。本研究结果显示,抑制LINC01224表达后G1期细胞比例显著增加,S期细胞比例显著减少,Ki67、pro-caspase-3表达下调,P21、clv-caspase-3表达上调,提示抑制LINC01224表达可能通过促进P21、clv-caspase-3表达及抑制Ki67、pro-caspase-3表达,从而抑制细胞增殖,诱导细胞周期阻滞及促进细胞凋亡。
为进一步探究LINC01224在OSCC发生、发展过程中的作用机制,本研究通过双荧光素酶报告试验及qRT-PCR证实LINC01224可靶向结合miR-125b,并可负向调控miR-125b的表达。据报道,miR-125b在食管鳞癌组织及细胞系中表达下调,其表达水平与TNM分期、淋巴结转移等临床病理参数密切相关,表达水平降低预示患者预后不良,并可能是影响患者预后的危险因素[10]。此外,miR-125b可抑制胰腺癌细胞迁移及侵袭[11]。另有报道显示,miR-125b过表达可靶向抑制Bak1表达,从而抑制白血病细胞增殖及促进细胞凋亡[12]。上述研究提示miR-125b在肿瘤中可能发挥抑癌基因作用。本研究为验证LINC01224是否通过调控miR-125b表达,从而影响OSCC细胞增殖及凋亡,进一步将si-LINC01224与anti-miR-125b共转染至OSCC细胞,结果显示其细胞增殖能力明显增强,细胞凋亡率降低,pro-caspase-3、Ki67表达上调,clv-caspase-3、P21表达下调,提示LINC01224能抑制miR-125b的表达从而促进细胞增殖,抑制细胞凋亡。
综上所述,LINC01224在OSCC患者癌组织中呈高表达,通过体外细胞实验证实,LINC01224可调控miR-125b表达,从而促进OSCC细胞增殖及抑制细胞凋亡,LINC01224是OSCC诊断及靶向治疗的潜在靶点。但LINC01224/miR-125b调控下游靶基因表达的可能作用机制尚需进一步探究。

