阿帕替尼治疗2例肺鳞癌临床报道并文献复习
娄金书,高作文,宋德生
东部战区总医院(原解放军第八六医院)肿瘤内科,安徽 当涂 243100
肺鳞癌作为非小细胞肺癌的一个常见病理类型,一线或多线治疗进展后尚无标准治疗方案,无论是化疗还是靶向治疗均未取得突破性进展,尤其是可供选择的抗血管生成药物不多。阿帕替尼是一种靶向血管内皮生长因子2(VEGFR2)的口服小分子酪氨酸激酶抑制剂,2014 年10 月被国家食品与药品监督管理总局(CFDA)用于晚期胃腺癌和(或)胃-食管结合部腺癌三线及三线以上的治疗[1]。近来多个Ⅱ期临床研究显示,阿帕替尼在非小细胞肺癌治疗领域表现出了较好疗效及可耐受的安全性,但针对肺鳞癌临床研究较罕见。现报告阿帕替尼治疗2 例肺鳞癌的病例,并复习国内外相关文献,报告如下。
1 病例资料
病例1:男性,65 岁,既往有高血压病史10 余年,口服“左旋氨氯地平2.5 mg 1/d”,无嗜烟史。2015 年11 月因“发现颈部包块半月”就诊,胸部CT 提示左下肺大小3.7 cm×5.0 cm×4.0 cm 肿块,伴纵隔及左侧腋窝淋巴结转移(最大直径2.5 cm),心包腔积液。2015 年11 月20 日行左颈部淋巴结活检,病理示转移性中分化鳞癌。2015年11月20日—2016年3月31日予以“紫杉醇聚合物胶束400 mg+顺铂120 mg”化疗5 周期;2 周期后疗效评价为部分缓解(PR)。2016 年4 月27 日查胸部CT 见肺部病灶缩小,纵隔、左肺门、左侧腋下淋巴结部分较前进一步增大。2016年6 月17 日改行二线吉西他滨+奈达铂化疗2 周期,后行局部放疗至2017年1月结束,放疗剂量为:左肺、左侧腋下立体定向放疗45 Gy/13 F,双侧颈部及纵膈淋巴结三维适行放疗50 Gy/25 F。放疗后复查CT 示病灶有缩小,疗效评价稳定,随访至2017 年6 月5 日,复查CT, 左下肺肿块大小1.1 cm×1.5 cm;2017 年8 月29 日,左下肺占位性病变大小2.7 cm×3.0 cm×2.4 cm,左侧肺部肿块病灶较前增大,胸水增多,予以胸腔穿刺抽液术,胸腔内注射重组人白介素-2 100 万u。2017 年10 月10 日查胸部CT,左下肺肿块大小4.8 cm×3.8 cm,伴纵隔及左侧腋窝淋巴结转移,最大直径1.2 cm(见图A1)。2017 年10 月15 日开始口服阿帕替尼500 mg 1/d,2017 年12 月28 日胸部CT 示左下肺肿块大小3.1 cm×3.2 cm ,腋下淋巴结较前有缩小,最大直径1.0 cm(见图A2)。随访2018年4月17日、2018年8月3 日、 2018 年10 月24 日、 2019 年3 月8 日左下肺肿块及淋巴结较前无明显变化,胸水未再增长,无进展生存期(PFS)已达16.5月(见图A3-图A6)。
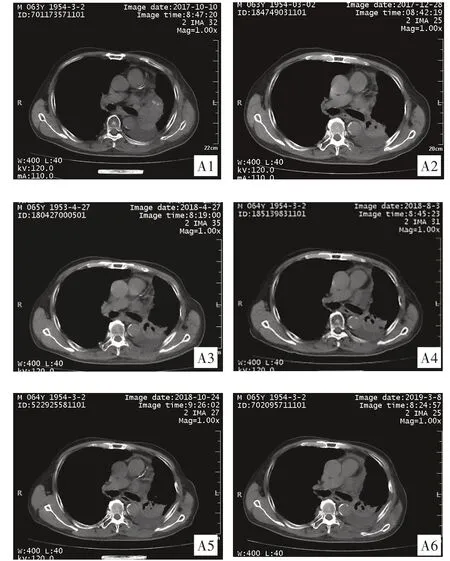
图A1:阿帕替尼使用前,左下肺肿块大小4.8 cm×3.8 cm(纵膈窗);图A2:阿帕替尼使用后,肿块大小3.1 cm×3.2 cm(纵膈窗);图A3-图A6:左下肺肿块及淋巴结较前无明显变化,胸水未再增长。
病例2:男性,67 岁,既往有高血压病史10 余年,口服“硝苯地平缓释片10 mg 2/d”,嗜烟史40 支/d×20 余年。 2016 年11 月15 日CT 示两上肺结节,左侧较大,纵膈淋巴结肿大,行肺穿刺,病理示恶性肿瘤细胞,倾向鳞癌;予4 周期(吉西他滨1.4 gd1,d8+顺铂30 mgd2-d4 方案) 化疗至2017 年4 月。进展后行放疗:左肺病灶,4550 Gy/13F,放疗后左上肺肿块已基本消失显示不清,后予单药多西他赛100 mg 化疗5 周期至2017 年12 月13日,随访至2018 年2 月1 日,右肺肿块有增大,直径2.1 cm ,原1.2 cm(见图B1)。 2018 年2 月7 日开始口服阿帕替尼250 mg 1/d, 2018 年3 月5 日胸部CT 见右肺肿块缩小直径1.3 cm,空洞形成,左肺病灶无变化(见图B2)。随访2018 年8 月3 日、2018 年11 月5 日、2019 年1 月7 日(见图B3-图B5)病灶稳定,随访2019 年4 月29 日(见图B6)病情进展,无进展生存期(PFS)为14.7月。
2 讨论
近年来,NSCLC 的分子靶向药物取得了显著进展,但可用于肺鳞癌的血管靶向药物选择较少,主要有阿法替尼、重组人血管内皮抑素(恩度)、雷莫芦单抗、耐昔妥珠单抗(Necitumumab)、尼达尼布、安罗替尼等;临床研究显示,这些药物大多需化疗药物联合,且效果差强人意。
阿帕替尼可高度选择性地抑制VEGFR-2 酪氨酸激酶的活性,阻断其下游信号转导,VEGF-2 通过激活丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,从而促进血管内皮细胞增殖[2]。阿帕替尼作用于受体酪氨酸激酶,如C-Kit、RET 和C-src,还可通过调节、PLCγ1 /ERK1 /2 和PI3K/Akt /mTOR 通路抑制肿瘤细胞抗凋亡作用,阻断RET /SRC 抑制肿瘤细胞的迁徙及侵袭[3];此外,基础研究显示促进肺癌干细胞凋亡,降低耐药蛋白P-gp 和ATP 结合盒式转运蛋白(ABC)G2 的表达水平,提高阿霉素和紫杉醇在耐药细胞移植裸鼠体内的疗效[4]。

图B1:阿帕替尼使用前肿块直径2.1 cm ,原1.2 cm (肺窗);图B2:阿帕替尼使用后肿块缩小直径1.3 cm;图B3-图B5:肿块无明显变化;图B6:肿块增大,病情进展。
国内外阿帕替尼在晚期NSCLC治疗领域临床报道日益增多,但在肺鳞癌的治疗领域鲜有报道,多为小样本的研究。Shi 等[5]报道阿帕替尼联合替吉奥方案作为晚期肺鳞癌二线或后线治疗16例晚期肺鳞癌患者,其中7例患者可评估疗效,部分缓解1 例,疾病稳定6 例。陶云霞等[6]报道阿帕替尼单药或联合化疗17 例鳞癌患者,其中10 例为肺鳞癌。 15 例患者可评价疗效,部分缓解7 例(46.7%),稳定7例(46.7%),肺鳞癌的中位PFS为6.1个月。
需要特别注意的不良反应有蛋白尿、高血压、手足皮肤反应、出血等[7],病例1患者出现尿蛋白+3,24小时尿蛋白6.72 g/L, 阿帕替尼减量250 mg 1/d 后复查尿蛋白+2,24小时尿蛋白3.14 g/L。国内临床指南推荐如出现>2级以上的蛋白尿,则需暂停或调整剂量,如出现肾功能损害或肾病综合征则立即停药。本文的2 例患者虽有基础高血压,口服阿帕替尼后未引起血压明显增高。2 例患者均未出现咯血,但对于靠近大气道的中央型肺癌等尚需谨慎评估使用。其他一般不良反应有乏力、腹泻、厌食、骨髓抑制、口腔粘膜反应等,在本文的2 例患者治疗过程中均未出现。
阿帕替尼在胃癌的临床研究中使用剂量850 mg/d[1],但在肺癌的一些临床研究中多采用的剂量为250 mg/d~500 mg/d[8-10],其可能原因是大部分患者为晚期肺癌,都给予过一线或多线化疗,体质及耐受性较差;另文献报道[11-13],胃癌的后续实际临床应用中剂量也多为500 mg/d,故笔者认为阿帕替尼在肺癌的使用剂量应以250 mg/d~500 mg/d为宜。
一项阿帕替尼治疗的胃癌回顾性研究提示,高血压、蛋白尿或手足综合征是转移性胃癌患者抗肿瘤功效的可行生物标志物[14]。田牛等[15]报道阿帕替尼治疗21 例晚期NSCLC 中观察到P53 蛋白表达高者效果更显著;有研究发现[16],VEGFR-2 是阿帕替尼治疗鼻咽癌疗效的重要预测指标;还有崔博豪等[17]报道肺癌驱动蛋白超家族5B-转染重排(KIF5B-RET)融合基因可能成为阿帕替尼潜在靶点。
阿帕替尼对肺鳞癌有一定疗效,或可以作为晚期肺鳞癌的药物之一,但需密切注意高血压、蛋白尿、出血等严重不良事件的发生,阿帕替尼如何与现有的治疗手段如化放疗、免疫检查点抑制剂等联合,是否有更有效的预测指标,如何选择最佳的获益人群等,尚需进一步的临床研究。

