电子束辐照对高聚原花青素聚合度的影响
汪宇炜,林柳月,胡诗婷,汪澜,刘洁,2*
(1.湖北科技学院核技术与化学生物学院,湖北咸宁 437100;2.辐射化学与功能材料湖北省重点实验室,湖北咸宁 437100)
原花青素(Proanthocyanidins,PC)是一种常见的聚多酚类黄酮,广泛存在于自然界的植物中,如葡萄籽中原花青素含量很丰富[1]。研究表明,葡萄籽原花青素具有良好的抗氧化功能,可以很好地清除自由基,医治一些由自由基造成的疾病,还有抗毒消炎、防治心血管疾病等功效[2-3]。按聚合度差异可将原花青素分为3类:聚合度为1的单体,具体包括表儿茶素、没食子酸、儿茶素等,聚合度在2~4的称为低聚原花青素,聚合度在5以上的称为高聚原花青素[4]。高聚原花青素的分子量比低聚体大,受到空间位阻的影响更大,其抗氧化能力往往低于低聚体[5]。因此,为了使原花青素的利用效益达到最大化,有必要对高聚原花青素进行降解处理来提高其使用价值。
目前,降解高聚原花青素主要有化学降解法、生物降解法和物理降解法[6-8]。电子束辐照降解作为物理法的一种,具有方便、清洁且易于实现工业化生产等优点。已有研究采用电子束辐照技术降解高分子聚合物和有机小分子,而利用电子束辐照降解高聚原花青素却未见报道。本研究采用电子束辐照的方法来降解高聚原花青素,对经过不同剂量电子束辐照后的高聚原花青素样品,用香草醛盐酸法测定其平均聚合度的变化,以期为电子束辐照原花青素的应用提供参考。
1 材料与方法
1.1 材料与试剂
98%葡萄籽高聚原花青素,西安艾诺医药科技有限责任公司;香草醛、冰乙酸、盐酸、无水乙醇、甲醇,分析纯,国药集团化学试剂有限公司;(+)-儿茶素,分析纯,sigma试剂公司。
1.2 仪器与设备
7200可见分光光度计,上海尤尼柯有限公司;UV-2300紫外可见分光光度计,日本日立公司;AYU-120分析天平,日本岛津公司;1 MeV电子加速器,美国沃氏公司。
1.3 试验方法
1.3.1 高聚原花青素的提纯
称取一定量葡萄籽高聚原花青素,按照原花青素固体与乙醇1∶200(g∶mL)的固液比,用无水乙醇溶解原花青素固体,静置12 h,过滤,滤液在45 ℃旋蒸去除乙醇,旋蒸后得到的固体置于45 ℃红外干燥箱干燥,即为接下来实验要用到的高聚原花青素样品。
1.3.2 电子束辐照处理
准备6个密封袋,分别称取0.2 g高聚原花青素样品,置入密封袋中平铺均匀,用胶带封口固定,并送样辐照。辐照总剂量设定为90 kGy、180 kGy、210 kGy、270 kGy、330 kGy和 390 kGy,剂量率为30 kGy/s。
1.3.3 香草醛盐酸法测定高聚原花青素平均聚合度
1.3.3.1 测定波长的确定
取10 mL具塞比色管,依次加入1.0 mL原花青素甲醇溶液、5.0 mL香草醛甲醇溶液和1.5 mL盐酸甲醇溶液,用无水甲醇定容至刻度,加塞振荡使其混合均匀,避光反应20 min后,立即于360~650 nm范围扫描吸收光谱,据此选择测定波长。另取10 mL具塞比色管,依次加入1.0 mL原花青素乙酸溶液、5.0 mL香草醛乙酸溶液和1.5 mL盐酸乙酸溶液,用乙酸定容至刻度,加塞振荡使其混合均匀,避光反应5 min后,立即于360~650 nm范围扫描吸收光谱,据此选择测定波长。
1.3.3.2 显色条件单因素实验
按照“1.3.3.1”配制显色溶液,依次改变香草醛溶液和原花青素溶液体积比为2∶1、3∶1、4∶1和5∶1,分别考察显色溶液避光恒温20 ℃、30 ℃和40 ℃情况下30 min内吸光度的变化情况(每次实验测3次,结果取平均值,以下均同),确定香草醛溶液和原花青素溶液最佳体积比、最佳反应温度和反应时间。
1.3.3.3 标准曲线的建立
采用(+)-儿茶素为标准品,在香草醛与标准品最佳反应体积比以及最佳反应温度和反应时间条件下,配制不同浓度的(+)-儿茶素标准显色系列溶液,测定每份溶液的吸光度值,分别绘制吸光度值与(+)-儿茶素甲醇溶液质量浓度的标准曲线和吸光度值与(+)-儿茶素乙酸溶液物质的量浓度标准曲线。
1.3.3.4 平均聚合度的测定
将辐照前后的原花青素样品分别用甲醇和乙酸溶解,配制成一定浓度,在相同条件下进行显色反应并测定吸光度值,所得的吸光度数据代入对应的标准曲线中得到比色管中溶液的浓度,进而换算出样品溶液的浓度,再按照公式1计算原花青素的平均聚合度[9]。

式中,m为原花青素的质量,μg;n为原花青素物质的量,μmol;M为(+)-儿茶素的相对分子质量(290 g/mol)。
2 结果与分析
2.1 测定波长的确定
图1为原花青素-香草醛在甲醇体系和乙酸体系中的可见吸收光谱图。由图1可知,两者均在500 nm处吸收最强。因此,测定高聚原花青素平均聚合度的实验中,均可选择500 nm作为测定波长。

图1 原花青素-香草醛体系可见吸收光谱图
2.2 香草醛-原花青素体积比和反应时间的确定
甲醇体系中,香草醛-原花青素体积比分别为2∶1、3∶1、4∶1和5∶1时,显色溶液在500 nm处的吸光度值随时间变化如图2所示。由图2可知,加入的香草醛甲醇溶液与原花青素甲醇溶液体积比为4∶1时,反应在20 min基本完成且吸光度值最稳定。因此实验选取香草醛甲醇溶液和原花青素甲醇溶液体积比为4∶1,反应时间为20 min。
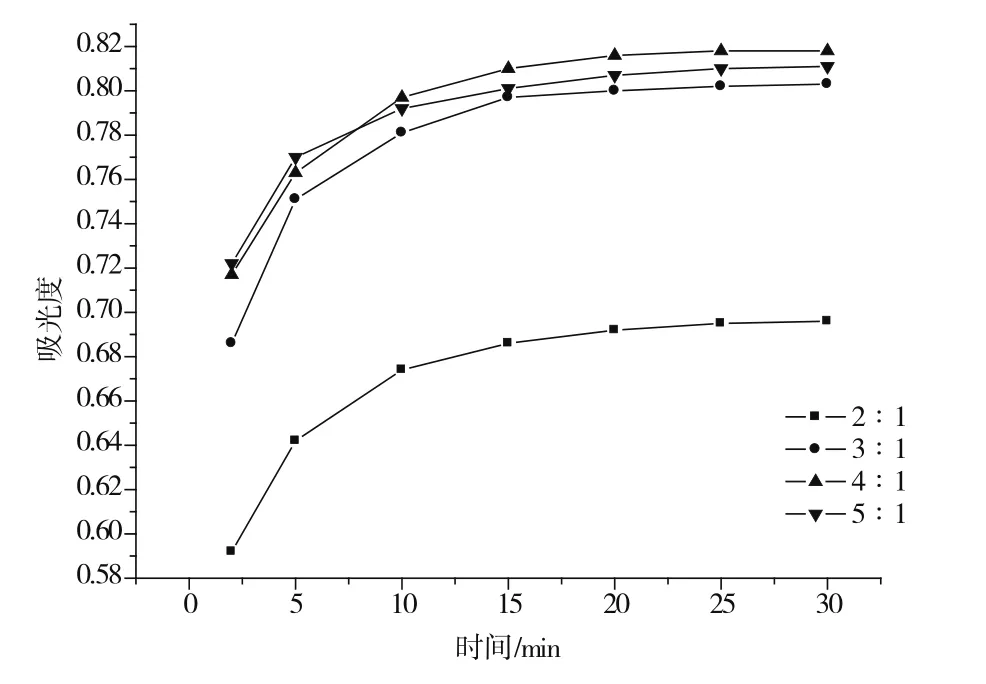
图2 甲醇体系中不同香草醛-原花青素体积比时吸光度值随时间变化
乙酸体系中,香草醛-原花青素体积比分别为2∶1、3∶1、4∶1和5∶1时,显色溶液在500 nm处的吸光度值随时间变化如图3所示。由图3可知,加入的香草醛乙酸溶液与原花青素乙酸溶液体积比为3∶1时,反应在5 min基本完成。因此,实验选取香草醛乙酸溶液和原花青素乙酸溶液体积比为3∶1,反应时间为5 min。
2.3 反应温度的确定
在上述条件下分别考察甲醇体系显色溶液在20 ℃、30 ℃和40 ℃恒温水浴中反应20 min后吸光度值的变化,以及乙酸体系显色溶液在20 ℃、30 ℃和40 ℃恒温水浴中反应5 min后吸光度值的变化,发现吸光度值均随反应温度升高而降低(图4)。因此均选择20 ℃作为反应温度。
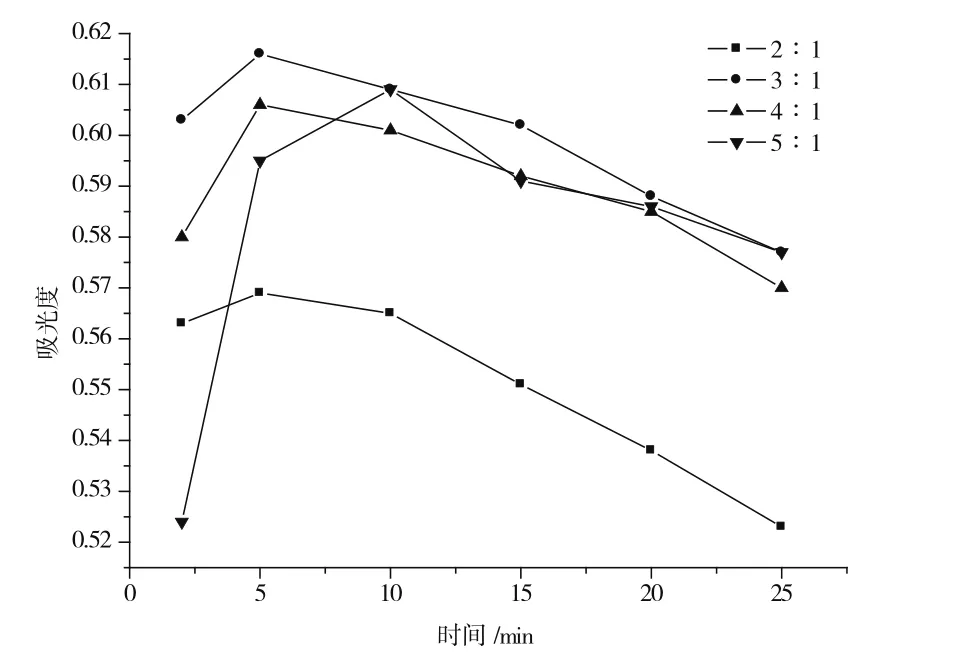
图3 乙酸体系中不同香草醛-原花青素体积比时吸光度值随时间变化
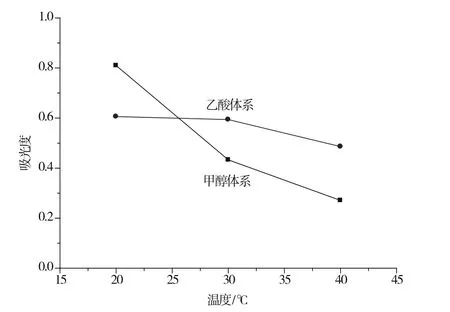
图4 反应温度的影响
2.4 标准曲线的建立
以(+)-儿茶素为标准品,在甲醇体系中采用香草醛盐酸法测定原花青素的质量,得到吸光度与(+)-儿茶素质量浓度(μg/mL)之间的线性方程为y=0.001 37x-0.022 6,R=0.998 1;在乙酸体系中采用香草醛盐酸法测定原花青素物质的量,得到吸光度与(+)-儿茶素物质的量浓度(μmol/mL)之间的线性方程为y=32.244 7x-0.217 5,R=0.996 9。由图5和图6可知,在实验浓度范围内线性关系良好,且吸光度值基本处于朗伯-比尔定律最佳读数范围。
2.5 实际平均聚合度的测定
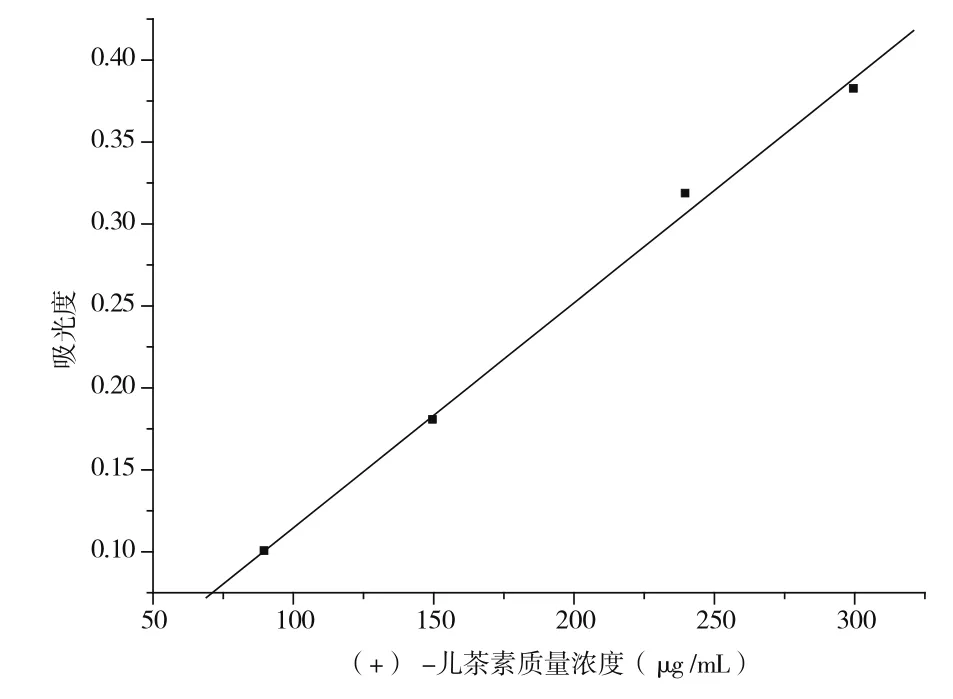
图5 (+)-儿茶素质量浓度标准曲线

图6 (+)-儿茶素物质的量浓度标准曲线
经不同剂量电子束辐照后的葡萄籽高聚原花青素样品,在甲醇体系中采用香草醛盐酸法显色,测得吸光度值代入图5标准曲线中,可得质量浓度。在乙酸体系中采用香草醛盐酸法显色,测得吸光度值代入图6标准曲线中,可得物质的量浓度。结合两者,乘以修正系数,得到平均聚合度,具体如表1所示。由表1可知,电子束辐照总剂量从0 kGy升到180 kGy时,高聚原花青素的平均聚合度由14.40降到14.12,只下降1.94%;当辐照总剂量从180 kGy增加到270 kGy时,高聚原花青素的平均聚合度从14.12降到12.48,下降11.61%;当辐照总剂量从270 kGy升至330 kGy,高聚原花青素的平均聚合度从12.48降到9.08,下降27.24%;再增加辐照总剂量,从330 kGy到390 kGy,高聚原花青素的聚合度不仅没有降低,反而增加到11.07,增加21.92%,这可能是由于降解后的小分子重新聚合引起[10]。电子束辐照过程中,产生的活性自由基使高聚原花青素断链,平均聚合度降低,得到分子量较低的小分子。同时,如果自由基反应不能及时终止,得到的小分子有可能重新聚合。
3 结论
不同溶剂条件下,香草醛盐酸法的最适合反应条件存在差异:以甲醇为溶剂,测定原花青素质量浓度时,香草醛甲醇溶液与原花青素甲醇溶液的体积比为4∶1,在20 ℃水浴中避光反应20 min;以乙酸为溶剂,测定原花青素物质的量浓度时,香草醛乙酸溶液与原花青素乙酸溶液的体积比应为3∶1,在20 ℃水浴中避光反应5 min。电子束辐照总剂量在0~390 kGy时,随着剂量增加,高聚原花青素的平均聚合度先降低后升高,说明电子束辐照能够降解高聚原花青素,但需要注意选择合适的辐照剂量;另外,还需进一步考察电子束辐照对高聚原花青素生物活性的影响。

表1 不同剂量电子束辐照后原花青素平均聚合度的变化

