可生物降解壳聚糖/香草醛抑菌膜的制备及性能
罗华丽,房震
(1.烟台职业学院食品与生化工程系,山东 烟台 264670; 2.烟台先进材料与绿色制造山东省重点实验室,山东 烟台 264006)
全球每年用于伤口处理的敷料用量急剧增长[1],过去传统处理伤口的方法是使用棉纱布覆盖伤口,可以吸收伤口渗出物,保持伤口干燥,避免伤口被细菌感染。理想的伤口敷料应当能够提供湿润、无毒、绿色、安全的环境,以利于组织再生。理想的创面敷料应当透气防污、可吸收脓液、无黏附、易更换,同时应价廉、无毒、可生物降解、吸液性和透气性良好,有助于构建一个伤口组织生长的良好微观环境,敷料最好本身具有优良的抗菌性能[2-3]。薄膜敷料因自身透明,易于观察伤口愈合状况,堪称一种理想的医用敷料,同时其可以维持伤口的湿润状态,有利于伤口愈合,是生物医药领域的研究热点。近年来,随着细菌耐药性的增强导致严重感染和伤口难以愈合的事件频发,因此对具有抗菌功效的伤口敷料的需求日益紧迫[4]。以往的技术路线是添加抗菌剂,但伤口敷料使用后因丢弃导致抗菌剂在自然环境中扩散而造成诸多环境问题,因此寻找一种既具有生物抗菌性且在自然界可以实现生物降解,又对人体安全无毒,甚至达到可食用级别的新型材料,是未来研发的新方向。薄膜敷料一方面具有止血护创、抗菌无毒、促进愈合等作用;另一方面具有携带方便、疗效可靠、体积小等优点,是开发绿色环保的伤口敷料的热点之一,具有很好的研究价值。
聚-β-(1,4)-2-氨基-2-脱氧-D-葡萄糖,简称壳聚糖,是唯一天然存在的阳离子聚合物[5],将虾皮蟹壳等海洋生物废弃物脱钙、脱蛋白制得甲壳素,再经脱乙酰制备得到壳聚糖[6]。因其良好的生物相容性、可生物降解性、抗菌止血性和生物黏附性,可用作理想的伤口敷料[9]。由于壳聚糖分子链上的胺基可以和香草醛的醛基反应,可制备具有特殊功效的材料[7]。木质素是自然界中含量最丰富的天然芳香族高分子聚合物。香草醛化学名称为3-甲氧基-4-羟基苯甲醛,是从木质素工业生产得到的唯一芳香单体,属于天然可食用单醛类调味剂[8]。香草兰是一种名贵的天然香料植物,经乙醇提取、过滤也可得到香草醛[10]。利用壳聚糖和香草醛等生物质材料,有望制成医用水凝胶[11]、止血绷带[12]、止血海绵[13]、薄膜敷料[14]等新型医用材料。
笔者利用壳聚糖与香草醛交联反应成席夫碱结构,制备壳聚糖/香草醛抗菌薄膜[15],具有良好的抗菌性和生物相容性,以期为新型伤口敷料的开发提供新思路[16](如图1a所示)。与传统的伤口敷料相比,壳聚糖薄膜可生物降解,从而避免了对创伤性伤口的清创问题。同时其表现出良好的溶胀能力和吸收液体的性能,这可以确保渗出物的排出,维持有助于伤口愈合的潮湿环境。该薄膜具有更高的稳定性、可生物降解性和pH敏感性,对大肠杆菌和金黄色葡萄球菌具有良好的抗菌性能,在治疗皮肤病变方面具有巨大的应用潜力。

图1 壳聚糖/香草醛膜的研究思路和反应路线
1 实验部分
1.1 主要原材料
壳聚糖:脱乙酰度≥95%,黏度100~200 MPa.s,上海麦克林生化科技有限公司;
香草醛:分析纯,上海麦克林生化科技有限公司;
乙醇:分析纯,纯度≥99.7%,阿拉丁控股集团有限公司;
溶菌酶:20 000 μg,中美康士生物科技有限公司;
冰乙酸:分析纯,纯度≥99%,阿拉丁控股集团有限公司;
其他试剂均为国药集团化学试剂有限公司提供。
1.2 主要仪器及设备
电子天平:BCE124-1CCN 型,北京赛多利斯天平有限公司;
冷冻干燥机:SCIENTZ-10N/C 型,宁波新芝生物科技股份有限公司;
万能材料试验机:AGS-X 500 N型,日本岛津公司;接触角测量仪:Theta Flex型,瑞典Biolin公司;傅里叶变换红外光谱(FTIR)仪:IR Tracer-100型,日本岛津公司;
扫描电子显微镜(SEM):8230型,德国ZEISS公司;
雾度计:HM-150 型,日本村上色彩MCRL 公司;
热重(TG)分析仪:Q500 型,瑞士梅特勒托利多公司;
台式空气浴恒温摇床:YCT-80B 型,上海捷呈实验仪器有限公司。
1.3 壳聚糖/香草醛抑菌膜的制备
壳聚糖/香草醛膜的合成是通过壳聚糖与香草醛的酸缩合反应生成席夫碱进行的,如图1b 所示。将0.48 g壳聚糖(相当于2.32×10-3mmol的葡萄糖胺重复单元的质量)[17],溶于24 mL 的0.7%乙酸溶液,放置水浴加热至70 ℃,将不同物质的量之比的质量分数为2%的香草醛乙醇溶液缓慢滴加入壳聚糖溶液中,维持磁力搅拌一段时间,敞开瓶口,乙醇挥发后瓶中体积接近24 mL 时停止反应,转移至塑料培养皿中,随后置于55 ℃烘箱中存放24 h后制备壳聚糖/香草醛膜。设计不同配方制备壳聚糖/香草醛膜,通过壳聚糖与香草醛的缩合反应生成席夫碱,改变壳聚糖链上胺基与香草醛上醛基之间的摩尔比,制备了一系列壳聚糖/香草醛膜,将壳聚糖/香草醛膜物质的量之比分别为3∶1,5∶1,7∶1的样品分别命名为1#,2#,3#,制备的不同配比壳聚糖/香草醛膜如图2所示。

图2 不同配比壳聚糖/香草醛薄膜
1.4 测试与表征
(1) FTIR测试。采用FTIR仪测试,扫描范围为4 000~400 cm-1,分辨率为0.5 cm-1,扫描频率为40次,样品经溴化钾压片后进行测试。
(2)微观形貌观测。采用SEM 观测试样断面的微观形貌。
(3)接触角测试仪。采用接触角测试仪,以水为媒介,测试壳聚糖膜在空气中水的接触角。依照GB/T 30693-2014测量试样与去离子水的接触角。
(4)力学性能测试。采用万能材料试验机,在室温下测试壳聚糖/香草醛膜试样的断裂伸长率和拉伸强度。拉伸试样尺寸为100 mm×10 mm×0.1 mm,夹距保持50 mm,拉伸速率为25 mm/min。依照GB/T 1040.3-2006 使用UTM5504 型力学试验机测定力学性能。
(5)透光性测试。使用雾度计测试壳聚糖膜的透光性。壳聚糖/香草醛膜厚度为0.1 mm,制备成直径10 cm的圆形膜片。
(6)热稳定性能测试。采用TG分析仪测定热稳定性能,N2保护,升温速度15 ℃/min,温度范围30~800 ℃。
(7)抗微生物活性测试。
使用大肠杆菌ATCC25922进行抑菌试验,大肠杆菌储存在-20 ℃下的20%~40%甘油中。称取胰蛋白胨10 g、酵母浸粉5 g、氯化钠10 g、去离子水1000 mL、琼脂粉18 g 于三角瓶中,经121 ℃/202 kPa灭菌20 min后,趁热倒入15 mL培养基于10 cm直径的大平板中。取0.2 mL 微生物混悬液在平板已凝固的LB 培养基面涂抹均匀后,在平板上打4 mm孔径,并加入4 μg壳聚糖/香草醛膜碎粉。随后置于37 ℃气浴摇床孵育24 h,以评估其抗微生物性能,以壳聚糖作为对照实验,在标准条件下测量抑菌圈直径。试验一式三份,以验证结果并计算平均值。按照抑制率(%)=(处理菌落直径-对照菌落直径)/处理菌落直径×100%计算抑菌率。
2 结果与讨论
2.1 FTIR测试
将壳聚糖/香草醛膜在FTIR光谱仪上扫描400~4 000 cm-1的光谱范围,分别对纯香草醛、纯壳聚糖和1#样品进行溴化钾压片,测定三者的FTIR 图谱,如图3 所示。由图3 可以看出,壳聚糖在1 590 cm-1处NH—CO 的振动峰及香草醛在1 660 cm-1处的C=O 吸收峰消失了,而制成的壳聚糖/香草醛膜在1 636 cm-1处出现C=N 的席夫碱结构峰,证明壳聚糖的胺基与香草醛的醛基反应形成席夫碱结构[18]。
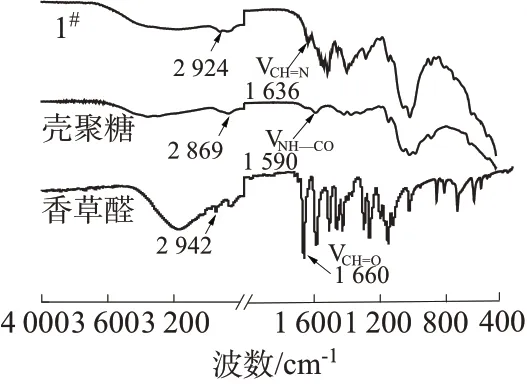
图3 1#壳聚糖/香草醛膜的FTIR图
2.2 壳聚糖/香草醛膜的形貌
采用溶液浇注法[19]制备壳聚糖/香草醛膜,其外观如图4所示,随着香草醛比例的增加,膜的颜色逐渐变成深黄色。由图2 可知,使用相机拍摄壳聚糖膜材表面光滑、致密透明。由图4 观测其表面较为平整,但是仍形成一定粗糙度的表面,有利于形成类似荷叶表面的疏水作用[20]。随着香草醛比例的减少,膜的粗糙度有一定程度的增加。

图4 不同物质的量比壳聚糖/香草醛膜表面的SEM图
2.3 壳聚糖/香草醛膜的接触角测试
图5 为不同壳聚糖/香草醛比的膜接触角测试图,表1 为壳聚糖膜接触角记录。由图5 和表1 可知,壳聚糖/香草醛膜在空气中的接触角略大于90°,处于临界值,具有一定的疏水性,但是疏水性不显著。据参考文献[14]报道,壳聚糖膜既有一定的亲水性,又有一定的疏水性。由于壳聚糖/香草醛膜表面的微纳结构,使得接触角略大于90°,表现出一定的疏水性。然而随着香草醛添加量的增大,壳聚糖膜的接触角逐渐从113.7°降低至93.4°。香草醛本身溶于水,具有一定的亲水性。随着壳聚糖链上香草醛的引入,膜的亲水性有所提升,因此接触角呈降低趋势。

图5 不同壳聚糖/香草醛物质的量比的膜接触角测试图
2.4 壳聚糖/香草醛膜的力学性能测试
图6 为壳聚糖/香草醛膜的应力-应变曲线。由图6 可见,随着添加香草醛比例的增加,壳聚糖/香草醛膜的拉伸应力逐渐增高而应变逐渐降低。3#样品最大拉伸应力可达3.5 MPa,应变为3.25%;2#样品最大拉伸应力可达4.1 MPa,应变仅为2.25%;1#样品最大拉伸应力可达5.5 MPa,应变仅为1.6%。三种配比的壳聚糖/香草醛膜在经过屈服点后都出现了应变增强现象,这可能是因为在拉伸过程中材料的体积不变,但是横截面积发生收缩,使分子链之间变得更加紧凑,出现新的物理交联,从而在曲线中体现出应变增强。随着香草醛加入量的增加,壳聚糖/香草醛膜的拉伸强度有所增加,其主要原因在于香草醛接枝壳聚糖后,壳聚糖主链间的摩擦力和壳聚糖/香草醛膜氢键作用力有所提升,从而表现为拉伸强度的增强[21]。
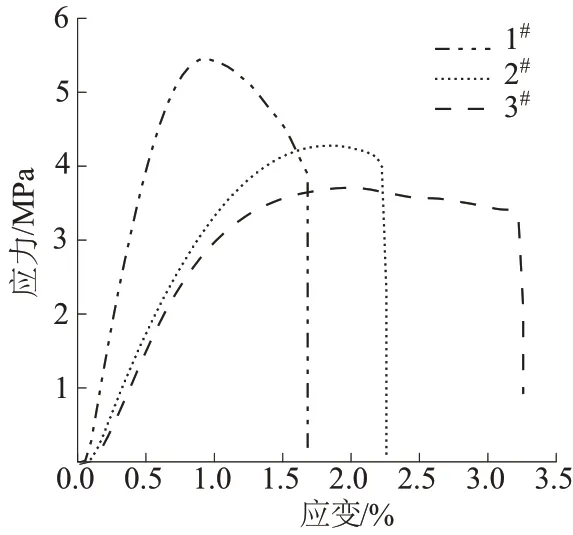
图6 壳聚糖膜的应力-应变曲线
2.5 壳聚糖/香草醛膜的透光性测试
图7 为不同比例壳聚糖/香草醛膜透光率变化趋势图,由图7 可见,3#样品的透光率达87.13%,1#样品的透光率达49.58%。这是由于香草醛的醛基和壳聚糖上的氨基反应形成亚胺结构与香草醛的芳环结构形成共轭π键,赋予壳聚糖/香草醛膜显黄色[22],随着香草醛用量的增加,壳聚糖/香草醛膜的透光率下降[23]。

图7 不同比例壳聚糖/香草醛膜透光率
2.6 壳聚糖/香草醛膜热稳定性能测试
图8为所制备的壳聚糖膜的TG图;图9为不同比例壳聚糖/香草醛膜DTG 曲线。如图8 和图9 所示,随着香草醛用量增加,壳聚糖膜整体热稳定性有所提高,热重损失有所降低,这是由于壳聚糖分子中还原性NH2被香草醛结构通过C=N 双键交联和形成有序团簇的作用所致。TG曲线中第一个台阶没有醛类物质的快速挥发所引起的质量损失[24],由FTIR 图可见,壳聚糖和香草醛主要形成亚胺键,其质量损失主要原因是水与胺单元之间的氢键断裂及水分的挥发所致[18]。1#膜的最大失重速率温度在265 ℃,该温度体现了壳聚糖与香草醛交联密度达到最大值。DTG 曲线显示在265 ℃时质量损失速率达到最大(0.5%/℃)。第二个台阶主要是C—C键的断裂、C—H 断裂、C—O 断裂[25]所致,质量进一步下降。Res为残留质量百分比,由表2可见1#膜的Ts最大,为85.554,说明热稳定性达到最好。

图8 不同比例壳聚糖/香草醛膜的TG图
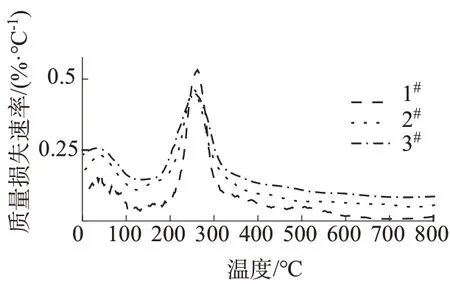
图9 不同比例壳聚糖/香草醛膜DTG图
2.7 壳聚糖/香草醛膜的降解性能测试
在模拟感染伤口环境的条件[26]下,根据24 h 内的质量损失评估壳聚糖/香草醛膜的生物降解行为。即依次将1#,2#,3#膜切成正方形的小块并称重,分别放入3 个5 mL 样品瓶中各加入5 mL pH=8.0 Tris-HCl 缓冲液,加入溶菌酶1 mg 于37 ℃恒温酶解。选择溶菌酶是因为它存在于伤口液中,并且能够将壳聚糖水解成低聚物。如图8a所示,生物降解发生在三个不同降解速率的阶段。图10为壳聚糖/香草醛物质的量比分别为3∶1,5∶1,7∶1的膜降解性能测试图。由图10a可知,第一阶段的前3小时内,1#,2#,3#样品的质量突然分别下降了22%,21%,20%。在接下来第二阶段的9 h,生物降解以较慢的方式继续,壳聚糖/香草醛膜的质量损失率分别为15%,3%,1%。此外,在接下来第三阶段的12 h里,1#,2#,3#膜的质量损失率分别为20%,15%,4%。第一阶段的质量损失大与溶菌酶催化的连续N-乙酰-D-葡糖胺单元之间的O—C 键断裂有关,导致壳聚糖低聚物及其扩散到介质中。溶菌酶加速壳聚糖降解是以内切方式作用于壳聚糖,切断壳聚糖糖链上的β-1,4糖苷键[27]。第一阶段的大量质量损失与溶菌酶催化的连续N-乙酰-D-葡糖胺单元之间的O—C 键断裂有关,导致壳聚糖低聚物及其扩散到介质中[28]。第二阶段预计溶菌酶催化的O—C键的断裂及亚胺键的断裂所致。第三阶段是溶菌酶导致的O—C键的断裂和壳聚糖的溶解侵蚀所致[29]。
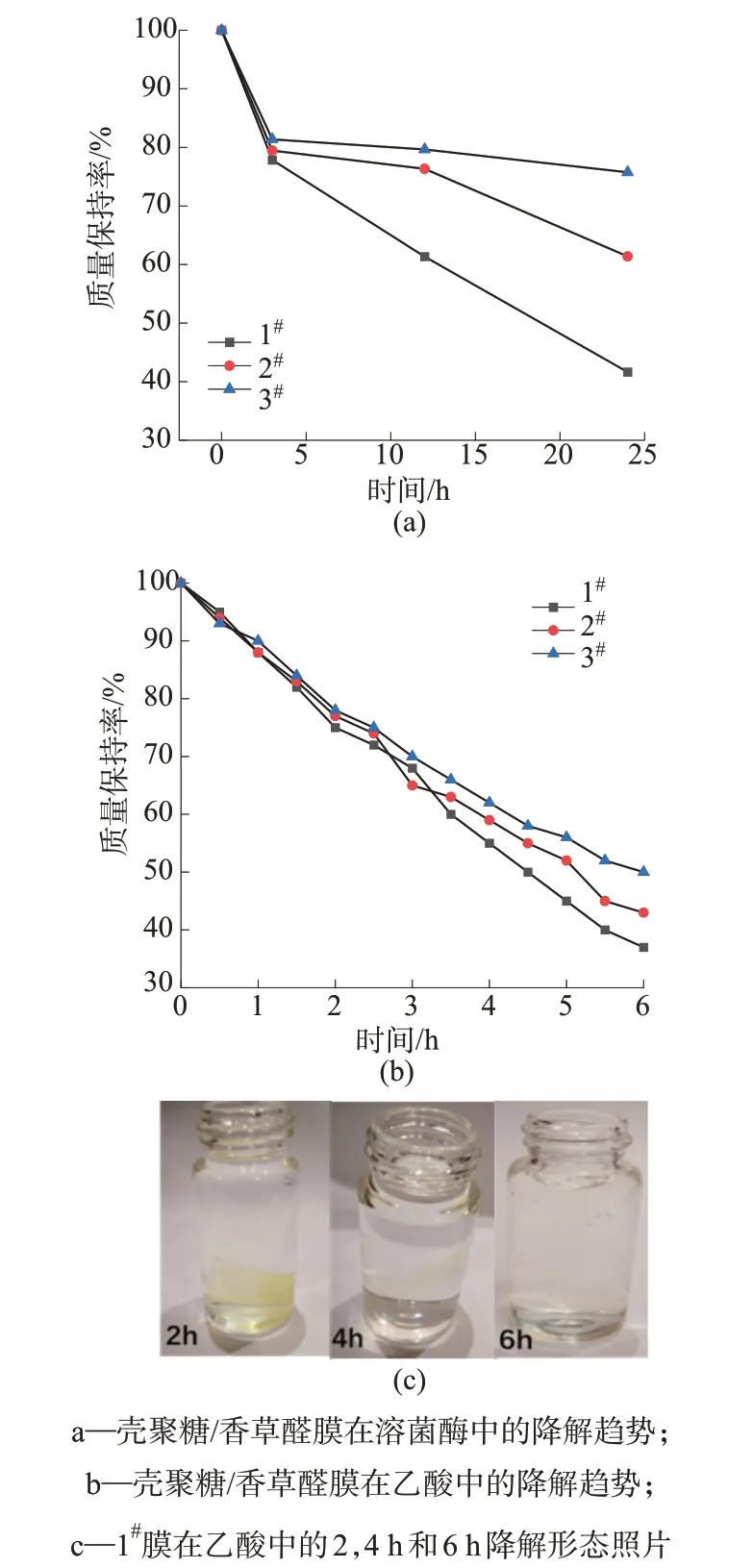
图10 壳聚糖/香草醛膜的降解性能测试图
研究壳聚糖/香草醛膜在乙酸溶液中降解趋势。分别称取0.1 g 的1#,2#,3#膜放入20 mL 5%乙酸溶液中观察其降解行为。由膜浸入乙酸溶液后,发生溶胀降解,每隔0.5 h,将溶胀降解的膜过滤、干燥后称量,计算膜的质量损失比例。
如图10b 所示,膜降解发生在三个不同降解速率的阶段。因此,第一阶段的前2 h,1#,2#,3#膜的质量分别下降了25%,23%,22%(见图10b)。在接下来第二阶段的2 h,乙酸降解以较慢的方式继续,壳聚糖/香草醛膜的质量损失分别为20%,18%,16%。此外,在接下来第三阶段的2 h里,1#,2#,3#膜质量损失率为18%,16%,12%。第一阶段的质量损失大于乙酸和壳聚糖/香草醛膜接触溶胀降解成壳聚糖低聚物扩散到介质中[30];第二阶段乙酸与席夫碱结构发生可逆反应,导致亚胺键的断裂所致;第三阶段是由于O—C键的断裂和壳聚糖的溶解侵蚀所致。
2.8 抗微生物活性
通过圆盘扩散法[31]对大肠杆菌ATCC25922 进行抑菌试验,如图11 所示。将壳聚糖/香草醛膜剪成8 mm× 8 mm 正方形膜片,贴敷在已涂布菌液的LB培养基平板中央,从图12a1~图12a3可以观察到膜上没有生长大肠杆菌,说明膜本身具有一定的抑菌效果。由于膜本身的抑菌成分无法有效向外围扩散,所以外围抑菌圈不显著。

图11 不同壳聚糖/香草醛膜粉抑菌效果

图12 壳聚糖/香草醛膜抑菌效果
表3 为不同壳聚糖/香草醛膜粉抑菌圈直径数据。由表3可见,随着香草醛比例的增加,膜粉的抑菌率有所下降,这是由于壳聚糖本身带有的氨基在微生物抑制中起到重要的作用,而壳聚糖和香草醛反应占据一定比例的胺基,从而表现出随着香草醛的加入量的增长,抑菌率略有下降。因此,进一步增强壳聚糖/香草醛膜的抑菌率可以考虑引入抑菌效果更强的基团,以协同增强壳聚糖本身的抑菌作用。

表3 不同壳聚糖/香草醛膜粉抑菌圈直径数据
将灭菌滤纸圆片(5 mm)吸取足量壳聚糖/香草醛制膜液,贴敷在经染菌LB培养基平板中央,放置37 ℃培养箱中孵育24 h,观察微生物生长状况,如图12b1~图12b3所示。
表4 为不同壳聚糖/香草醛制膜液抑菌圈直径数据。从表4数据可知,壳聚糖/香草醛制膜液由于液体扩散作用良好,3∶1,5∶1,7∶1 三种比例壳聚糖/香草醛制膜液的抑菌率可达85.54%,88.23%和88.53%,具有良好的抑菌效果。
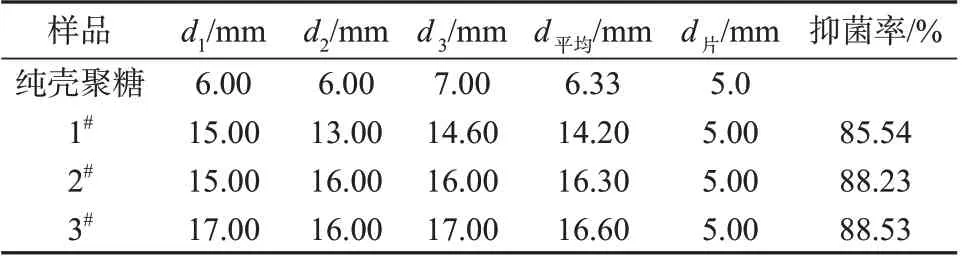
表4 不同壳聚糖/香草醛制膜液抑菌圈直径数据
3 结论
(1)采用浇注法制备不同比例的壳聚糖/香草醛膜,FTIR分析表明壳聚糖的胺基与香草醛的醛基发生反应,形成席夫碱结构。
(2)力学性能分析表明,随着香草醛比例的增加,壳聚糖/香草醛膜的拉伸强度逐渐增强,最大可达5.5 MPa;随着香草醛用量增加,壳聚糖膜整体热稳定性有所提高,热重损失有所降低。
(3)不透明度分析表明,随着香草醛添加量的增大,壳聚糖膜的透光性逐渐降低,透光率低至49.58%,壳聚糖膜具备合适的透光性,便于观察伤口情况。
(4)体外溶菌酶酶解实验考察壳聚糖/香草醛膜在溶菌酶溶液中酶解24 h 的质量损失率可达58%。非常适合用作皮肤伤口敷料且具有优良的可降解性能。乙酸降解实验发现,壳聚糖/香草醛膜6 h 即可被溶胀降解达50%,具有显著的酸降解特性。
(5)抗微生物活性试验分别考察壳聚糖/香草醛制膜液、膜粉、膜片等三种形式,对大肠杆菌的抑菌效果,发现制膜液的扩散作用良好,具有显著的抑菌效果。壳聚糖/香草醛膜粉由于没有充分的液体浸润,无法有效快速扩散,壳聚糖/香草醛膜粉的抑菌率稍低。壳聚糖/香草醛膜片上没有生长大肠杆菌,说明壳聚糖/香草醛膜本身具有一定的抑菌效果。
总之,壳聚糖、香草醛属于可食用材料,开发新型可降解壳聚糖香草醛抗菌膜,有望用于抗菌止血的伤口敷料、可食用包装材料等领域,为天然食品级可降解伤口敷料开拓了新途径。为了进一步提升壳聚糖/香草醛膜的抑菌性能,可以考虑进一步改性,引入抑菌效果更强的基团,以协同增强壳聚糖膜的抑菌作用。

