脱氧雪腐镰刀菌烯醇的生物转化及其隐蔽型毒素的形成研究进展
唐语谦,潘药银,刘晨迪,杨继国,
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.华南协同创新研究院,广东 东莞 523808)
真菌毒素是真菌在特定条件下产生的次级代谢产物,其中脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)是目前世界分布最为广泛、影响较大的真菌毒素之一。其属B族单端孢霉烯族化合物,俗称呕吐毒素,主要由禾谷镰刀菌(Fusarium graminearum)和黄色镰刀菌(Fusarium culmorum)侵染小麦、大麦、玉米等粮食作物产生[1]。在潮湿、温热等气候条件下,DON毒素的产生不可避免,它会引发小麦赤霉病等植物病症,并经由谷物或饲料通过食物链富集至人体内,给世界粮食产业造成巨大经济损失,也给人类健康带来重大威胁[2]。除此之外,DON能够在植物和微生物作用下转化形成隐蔽型毒素,增加了谷类作物及其副产品的风险[3-4]。
DON的生物转化主要包括植物转化、微生物降解及动物体内代谢,不同生物对DON的作用模式存在一定差异,这影响到其衍生物类型、毒性效果及分布。大量研究表明,生物脱毒具有作用条件温和、安全环保、对食品营养影响较小等优点[5],但也应注意到经植物或微生物代谢转化后毒素衍生物的形成。这些毒素衍生物在常规提取条件(乙腈-水或甲醇-水)下完全或部分稳定,其亲水性比毒素单体更强,而且缺乏商业化的标准品,传统分析技术难以检测,故称为隐蔽型毒素[6]。
随着对DON的研究逐渐深入,人们发现隐蔽型毒素可与原型毒素同时存在,有些甚至比原型毒素的毒性作用更大。在某些情况下,隐蔽型毒素的浓度可能超过加工食品中原型毒素的水平,而且一些隐蔽型毒素会在体内代谢过程中重新转化为DON,给人类和动物健康造成潜在风险[5]。目前已发现的隐蔽型DON毒素主要有:DON-3-葡萄糖苷(DON-3-glucoside,DON-3-G)、3-乙酰-DON(3-acetyl-DON,3-Ac-DON)、15-乙酰-DON(15-acetyl-DON,15-Ac-DON)、DON-3-葡糖苷酸(DON-3-glucoside acid,DON-3-GlcA)、DON-15-葡糖苷酸(DON-15-glucoside acid,DON-15-GlcA)、3-酮基-DON(3-ketone-DON,3-keto-DON)、3-异构-DON(3-epimerization-DON,3-epi-DON)和脱环氧DON(deepoxy-DON,DOM-1)。现阶段研究较多的是DON-3-G[7],联合国粮食及农业组织和世界卫生组织下的食品添加剂联合专家委员会已将DON-3-G归类为人类及动物健康潜在危害物,并将其作为DON类真菌毒素膳食暴露的重要指标[8]。但目前世界各国粮食和饲料安全标准还主要集中于DON的限量,未考虑到隐蔽型毒素的监测与限量。本文简要介绍DON及其隐蔽型毒素的分布及危害,各类生物对DON的转化模式及隐蔽型毒素的形成以及生物脱毒取得的进展,以期为DON及其隐蔽型毒素的降解研究提供参考。
1 DON及其隐蔽型毒素类型及分布
1.1 DON的隐蔽型毒素类型
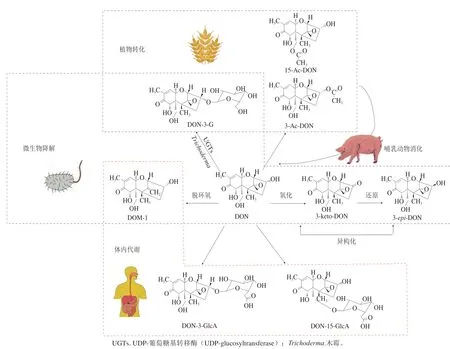
图1 DON及其隐蔽型毒素[7]Fig. 1 DON and its masked forms[7]
DON最早由日本学者Yoshizawa等[9]于1973年从镰刀菌感染的大麦粒中分离得到,化学名称为3,7,15-三羟基-12,13-环氧单端孢霉-9-烯-8-酮(化学式为C15H20O6),分子质量为296.32 Da,无色针状晶体,可溶于水和极性有机溶剂[10]。DON化学性质稳定,一般的食品加工不能破坏其结构,碱性条件下或高压处理才可破坏部分毒素,且可在环境和食物链中长期存在,已被欧盟致癌物分类标准定为三级致癌物。DON的隐蔽型毒素主要分为三类:第一类是共轭结合物,主要有DON-3-G、3-Ac-DON、15-Ac-DON、DON-3-GlcA、DON-15-GlcA;第二类是氧化还原产物,主要有3-keto-DON、3-epi-DON;第三类是脱环氧化合物,主要是DOM-1。DON及其隐蔽型毒素的结构式如图1[7]。
1.2 DON及其隐蔽型毒素的分布
DON对粮食作物及以其为基础的饲料和食品的污染是一个全球性问题。在我国,污染主要发生在长江中下游温暖潮湿地区。近年来,由于全球变暖和农业系统的变化,逐渐蔓延到中国西北等高纬度地区,如东北、山东等以种植小麦为主的地区也常出现DON暴露量超标的情况[11-15]。在美洲,巴西、美国等地常检测出DON及其隐蔽型毒素,欧洲、非洲以及沿海等地区均有相关检测报道[16-21]。近几年全球部分国家和地区的毒素检出情况见表1[14-21]。
DON的隐蔽型毒素以DON-3-G为主,它通常与DON原型及衍生型3-Ac-DON、15-Ac-DON共存于小麦、大麦、玉米等粮食作物及其副产品中[12-17],在酿造啤酒过程中,作为原料的大麦特别容易受到毒素污染。Jeroen等[22]在47 个国家的406 种啤酒中发现DON和DON-3-G的质量浓度总和为10~475 μg/L,在27 种精酿啤酒中,污染物浓度超过了欧洲科学委员会设定的1 µg/(kgmb·d)的每日耐受摄入量。分析谷物及其副产品的DON水平是从源头监测毒素污染的有效途径,而其代谢产物也可作为DON暴露的有效生物标志物[23]。Maria等[24]在大部分英国儿童和青少年尿液中检测到游离DON和DON-GlcA,33%~63%的儿童和5%~46%的青少年的膳食DON暴露水平超过暂定每日最大耐受摄入量,此外,Deng Chunli等[25]也在中国河南省的居民尿液样本中检测到低水平的游离DOM-1。以上研究表明,人群中DON及其隐蔽型毒素已经广泛存在,并对食品安全和人体代谢构成了风险。
2 各类生物对DON的转化途径
不同生物对DON的转化模式存在一定差异,这影响到其形成的隐蔽型毒素类型、分布及毒性作用(图1):1)DON及共轭结合物(DON-3-G、3-Ac-DON、15-Ac-DON)常共存于小麦、大麦等植物中,一方面是由于镰刀菌会天然产生少量的3-Ac-DON、15-Ac-DON[26];另一方面被镰刀菌感染的植物通过自身防御机制形成DON功能化共轭形式,改变了DON的水溶性和毒性作用[27],其中C3位羟基葡糖苷化和乙酰化是植物防御机制的解毒作用,而C15位羟基乙酰化使其具有更高的毒性;2)DON-3-G、Ac-DONs在哺乳动物的消化道中经肠道微生物作用又重新水解释放DON,同样存在一定毒性作用的影响[28-29];3)脱环氧化合物DOM-1及氧化还原产物(3-keto-DON、3-epi-DON)主要是在农田土壤或动物胃肠道的微生物降解DON过程中形成,微生物还通过不同代谢机制改变毒素结构,进而实现对毒素的生物降解;4)DON在人体内代谢后随尿液排除过程中,大部分以其原型或葡糖苷酸结合物(DON-GlcA)的形式存在,主要是DON-3-GlcA、DON-15-GlcA,葡萄糖醛酸化是哺乳动物中主要的II期结合途径,在DON解毒和生物转化中起重要作用[30]。小部分DON可以通过人体肠道微生物群解毒成脱环氧DOM-1,并随尿液排出体外[25,31]。
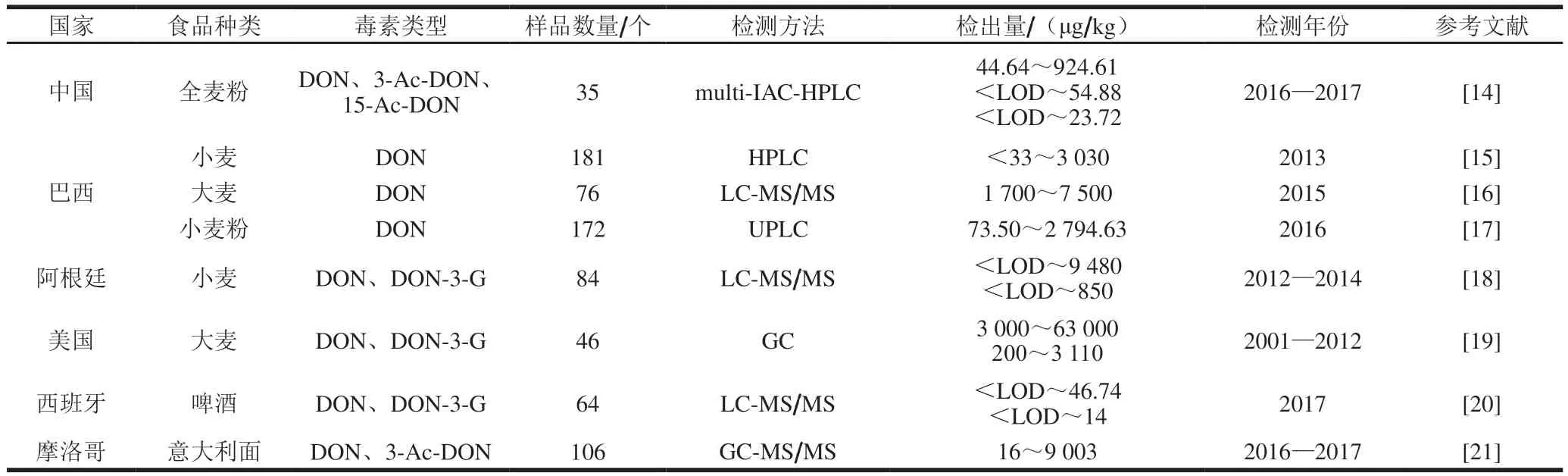
表1 近几年全球部分国家和地区DON及其隐蔽型毒素检出情况Table 1 Detection rates of DON and its masked forms in some countries and regions in recent years
2.1 植物对DON的改性
2.1.1 C3位葡萄糖苷化
DON-3-G是植物对DON最常见的修饰形式之一,抗赤霉病的小麦[32]、水稻[33]、拟南芥[34]等植物中存在一种UGTs,它能催化内源性葡萄糖分子与DON C3位的羟基结合形成DON-3-G[35],DON向DON-3-G转化程度受多种因素影响。Ovando-Martinez等[32]发现春小麦的种类及地域都极大地影响着其DON与DON-3-G的含量及DON糖基化的效率,这与植物抗性程度有关。目前,研究人员引入UGTs的基因片段以增强植物对镰刀菌的抗性,Li Xin等[36]将HvUGT13248导入小麦中成功表达,该转基因小麦不仅可以抑制DON的积累,同时可有效地使DON转化成DON-3-G。
2.1.2 C3位乙酰化
DON共轭结合物的形成并不局限于糖基转化,还可通过携带Tri基因的植物与乙酰基结合转化为3-Ac-DON。其中Tri101是一个编码单端孢霉烯-3-O-乙酰转移酶关键的调控基因,可在大麦和小麦中稳定表达和遗传[37]。Okubara等[38]实现FsTRI101在玉米UBI启动子控制下在小麦中成功表达,其胚乳提取物中检测到Tri101编码的乙酰转移酶活性,赋予了小麦一定的DON耐受性并使其具有更高水平的镰刀菌抗性。为了进一步研究谷类作物对3-Ac-DON是否有足够的抗性,Ohsato等[39]构建了稳定表达和遗传Tri101的转基因水稻植株,对比野生型水稻根部生长状况,发现3-Ac-DON对表现出乙酰化能力的转基因作物没有毒性。
不同植物对镰刀菌侵染易感性存在差异,且受母体毒素DON不同浓度的影响,将DON转化为DON-3-G、3-Ac-DON的能力有所不同。然而,利用转基因技术使植物表达恰当的UGTs或3-乙酰基转移酶,以提高植物对镰刀菌抗性、降低DON毒素积累是有争议的。因为乙酰化和糖基化结合的DON共轭化合物可以通过内源性微生物菌落或酶在哺乳动物的消化过程中分裂,不能保证其结构的稳定[28-29]。
2.2 微生物对DON的降解
2.2.1 霉菌
目前,国内外关于霉菌生物转化DON及相应的隐蔽型毒素形成的研究较少且结构尚未明确。He Chenghua等[40]以DON毒素为唯一碳源从土壤中分离到一株可以转化DON的塔宾曲霉(Aspergillus tubingensis)菌株NJA-1,14 d后可转化94.4%的DON,其作用机制初步猜测是C8酮基水合作用,或环氧基团开环形成两个羟基。吴娱等[41]发现DON经米曲霉(Aspergillus oryzae)菌株As-W.6发酵后也能实现较高降解率,降解产物分子质量减少了13.9 Da,产物未明。糖基化修饰在微生物对DON的代谢中很少见。但Tian Ye等[42]发现木霉(Trichoderma)可以将DON转化为DON-3-G,推测这是木霉在与镰刀菌竞争过程中产生了和植物类似的自我保护机制。
2.2.2 细菌
2.2.2.1 脱环氧作用
已有研究表明DON毒素脱环氧代谢是其主要解毒代谢机制,大多由动物的瘤胃和肠道微生物完成,研究者陆续从鸡肠、鲶鱼消化物等中筛选出具有降解DON为DOM-1能力的细菌菌群[43-44],有梭菌属(Clostridiumsp.)菌株WJ06和伊格尔兹氏菌属(Eggerthellasp.)菌株DII-9、真杆菌属(Eubacteriumsp.)[27]。Fuchs等[45]从牛瘤胃中分离出一株厌氧优杆菌属细菌BBSH 797,已被开发为动物饲料中DON脱毒的商业产品Mycofix。Awad等[46]测试了这种微生物饲料添加剂在肉鸡中的体内功效,证明它能减轻DON对小肠葡萄糖转运的毒性作用。但已报道的具有脱环氧作用的细菌大多是绝对厌氧的,实际应用中其功效会受到一定的影响。
2.2.2.2 C3位氧化
DON分子C3位的羟基能够被多种微生物氧化成为酮基,形成产物3-keto-DON,其分子质量相比DON减少了2 Da(图2[47])。Shima等[48]分离自日本农田土壤中的根癌农杆菌属(Agrobacterium rhizobium)菌株E3-39,其分泌的胞外酶将DON氧化形成3-keto-DON。随后,从中国、加拿大等国家的土壤中也陆续分离到具有DON氧化活性的细菌,这些菌株均属于德沃斯氏菌属(Devosiasp.)[48-49]。最近,He Weijie等[50]从小麦赤霉病流行的农田土壤中分离到一株同样具有C3位氧化活性的鞘氨醇单胞菌属(Sphingomonassp.)菌株S3-4,他们利用BAC文库筛选克隆得到了SphingomonasS3-4中参与催化C3位氧化的关键酶AKR18A1,该酶属于醛酮还原酶超家族。

图2 DON的氧化[47]Fig. 2 Oxidation of DON[47]
2.2.2.3 C3位差向异构化
大量研究推测,C3位差向异构化过程由两步反应组成:第一步是DON先经关键酶氧化C3位的—OH(R构象)生成3-keto-DON;第二步是3-keto-DON由酮还原C3位的=O成S构象的—OH,从而完成由DON向3-epi-DON的差向异构化(图3[51])。

图3 DON差向异构化[51]Fig. 3 Epimerization of DON[51]
目前具有差向异构化能力的细菌已有不少报道,主要有类诺卡氏菌(Nocardioidessp.)、德沃斯式菌属(Devosiasp.)和嗜热菌科的一个新属Paradevosia shaoguanensis,但是对关键酶的分离纯化及特性研究较少[27]。
分离自农田土壤的类诺卡氏菌属(Nocardioidessp.)菌株WSN05-2,是第一个被报道具有DON异构化活性的菌株[52]。之后,Sato等[53]从土壤样品中分离出的13 株有氧DON降解细菌能将DON转化为3-epi-DON,其中9 种属于革兰氏阳性的诺卡氏菌属,4 种属于革兰氏阴性的德沃斯式菌属,表明实现差向异构的降解菌至少分布在两个系统发育限制属中。
目前针对德沃斯式菌属的酶促差向异构化的研究更为深入,德沃斯式菌同属的不同菌株表现出来差向异构化的能力存在差异,这与菌株是否表达参与DON氧化及3-keto-DON还原的关键酶有关。Hassan等[54]将DON与7 种Devosia属菌株一起孵育,发现只有D. mutans17-2-E-8能将DON差向异构化为3-epi-DON,其他菌株没有显示出差向异构化DON的能力,但这几种Devosia菌株均能不同程度地将3-keto-DON转化为3-epi-DON。随后,同课题组的Carere等[55]从D. mutans17-2-E-8中克隆了参与催化DON氧化形成3-keto-DON的基因,转化大肠杆菌进行表达,进一步测试了表达的降解酶DepA活性及其转化DON的能力,发现该酶属于吡咯喹啉醌依赖的乙醇脱氢酶,接着用同样方法分离出参与异构化第二步反应的关键酶DepB,该酶属于醛酮还原酶超家族[54]。最近,Wang Gang等[56]报道D.insulaeA16对DON及其隐蔽型毒素3-Ac-DON和15-Ac-DON的最终产物降解为3-keto-DON,无法催化3-keto-DON转化为3-epi-DON,表明D. insulaeA16缺乏特异性还原3-keto-DON的酶。这也进一步证实了DON差向异构化以3-keto-DON作为中间体,通过两步催化完成DON差向异构化(表2)。
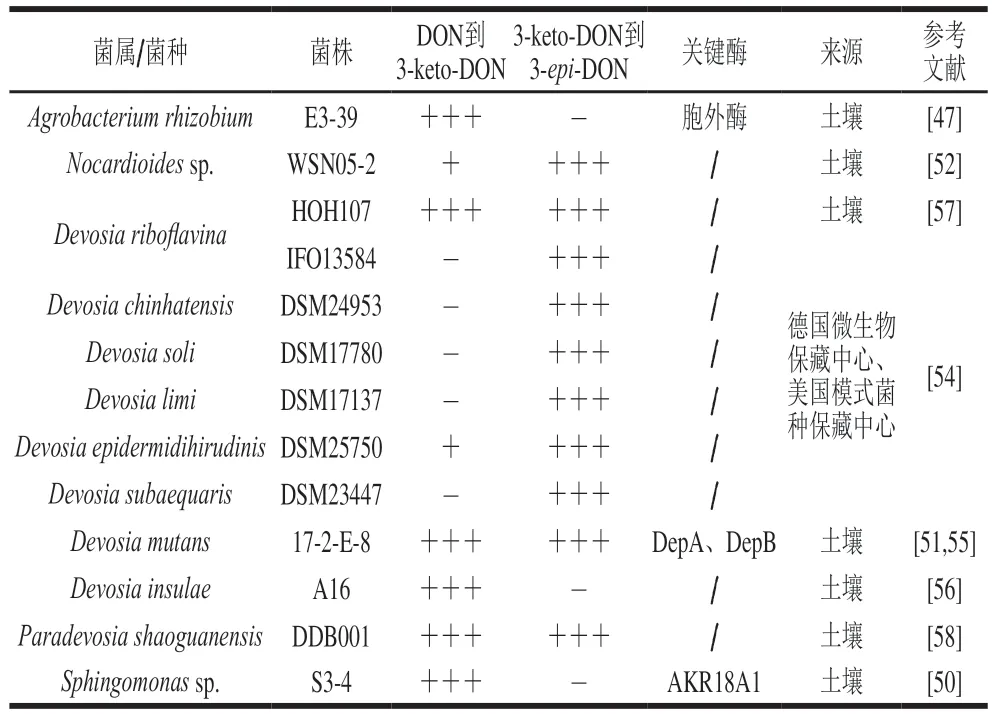
表2 参与DON氧化和差向异构化的细菌及关键酶Table 2 Bacteria and key enzymes involved in oxidation and emipmerization of DON
2.3 动物体内对DON的代谢
毒物动力学研究结果显示,DON被摄入后首先穿过肠道屏障,在消化道中被微生物或在机体的肠黏膜、肝脏、肾脏等器官中降解成多种代谢产物,主要包括葡糖苷酸结合物(DON-glucoside acid,DON-GlcA)、DOM-1,进而随尿液及粪便排出体外。不同动物对DON的肠道吸收和代谢过程存在较大差异,这与细菌在肠道内的定位及关键酶有关[24,59-60]。
2.3.1 葡萄糖醛酸化
DON与葡萄糖醛酸在UGTs的催化下发生共轭作用形成DON-GlcA,主要包括DON-3-GlcA和DON-15-GlcA,且UGTs在肝脏、小肠和肾脏中分布广泛[61]。Maul等[62]在体外模拟DON葡萄糖醛酸化时,发现肝脏微粒体也可促进DON-GlcA的形成,因为DON-GlcA的脂水分配系数(lgP值)较低,降低了其穿过细胞膜或结合核糖体的效率,进而更利于排出体外[63]。有研究显示,人摄入的DON约91%以DON-GlcA的形式排出体外,并且以DON-15-GlcA为主[24-25,64]。
2.3.2 脱环氧作用
在2.2.2.1节细菌脱环氧作用中已经介绍DOM-1主要是在家禽和反刍动物的肠道微生物催化下脱环氧形成的,而人和单胃动物(猪和啮齿动物)只在小肠结肠区具有高分布脱环氧菌群,很大比例的DON穿过小肠上皮细胞进入血液循环而被迅速吸收,而只有小部分的DON到达结肠后被细菌代谢成DOM-1[65]。例如猪摄入DON后,仅有约20%代谢为DOM-1通过粪便排出[66]。
3 不同转化途径对DON隐蔽型毒素毒性的影响
DON污染农作物及粮食制品后,会对人类和动物产生广泛的毒性效应,主要症状为头昏、腹泻、恶心、厌食、呕吐以及白细胞缺乏症[67]。这是由于DON与核糖体的结合抑制了蛋白质合成的延伸,同时伴随着核内毒素应激的发生,导致参与信号传导的关键细胞激酶的活化,从而产生毒性作用[2]。DON经不同转化途径后形成不同隐蔽型毒素,其毒性也发生了不同的改变(图4和表3)[47,68-72]。
对于DON-3-G,葡萄糖苷造成一定空间位阻,导致其难以进入核糖体肽基转移酶中心的A位口袋,无法引起核糖体毒素应激,故而降低DON毒性作用[68]。研究发现3-Ac-DON、15-Ac-DON对肠屏障完整性会产生不同程度的影响,增殖细胞的细胞毒性从小到大可排列为3-Ac-DON≤DON<15-Ac-DON[70],故C3位羟基乙酰化被认为是植物防御机制的解毒作用,而C15位羟基被乙酰化能激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径使其具有更高的毒性[73]。共轭结合型的隐蔽型毒素由于引入结合物,形成了空间位阻,一定程度降低了DON毒性作用(15-Ac-DON除外)。但DON-3-G、Ac-DONs在哺乳动物的消化道中经肠道微生物作用又重新水解释放DON,同样存在一定毒性作用的影响[74]。
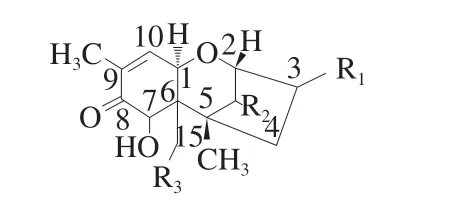
表4 DON的化学结构式Fig. 4 The structure of DON

表3 DON及其隐蔽型毒素的毒性分析Table 3 Toxicity of DON and its masked forms
DON分子结构中C3位的羟基和C12和C13位的环氧基团是主要的致毒性基团,从农田土壤或动物胃肠道筛选得到具有DON降解作用的细菌,作用机制就集中在这两个致毒基团上[2]。脱环氧形成的DOM-1、C3位的-OH氧化、差向异构化得到的3-keto-DON和3-epi-DON是目前研究过程发现毒性作用较小的毒素衍生物。由于环氧基团的损失,DOM-1仅形成两个氢键,导致与核糖体的结合较不稳定,且不会激活MAPK途径,不同类型的细胞毒性实验结果表明DOM-1对多种细胞毒性极低,几乎无毒[72]。大量研究证明3-keto-DON免疫抑制毒性是DON的1/10,而3-epi-DON是一种接无毒的代谢物[47,71]。分子模拟显示C3位羟基的氢原子与环氧基团的氧原子之间的距离减小,有助于增加3-epi-DON的稳定性,并影响其与核糖体的结合能力,对于降低DON毒性有着至关重要的作用[69]。
4 DON隐蔽型毒素的检测方法
在以往检测农作物及其制品中DON含量时,通常忽略了隐蔽型真菌毒素的存在及其危害性。检测主要依靠色谱分析,包括薄层色谱、GC、HPLC,辅以免疫亲和柱净化(immunoaffinity chromatography,IAC)、固相萃取等样品制备方法[4,14-15]。其中HPLC是常用的真菌毒素检测方法,但隐蔽型毒素在常规HPLC检测条件下,由于缺乏商业化的标准品,假阳性干扰较大[15]。在DON隐蔽型毒素检测方法研究进程中,研究人员主要从两个方面突破:一方面,利用合成、纯化等方法得到隐蔽型毒素标品以供检测,目前已有的标准品有3-Ac-DON、15-Ac-DON、DON-3-G;另一方面,进一步采用LC-MS/MS、GC-MS/MS、UPLC-MS/MS等串联质谱法实现DON隐蔽型毒素的定性和定量检测[20-21,24]。
LC-MS/MS是目前最常用的隐蔽型毒素定量分析方法,借助有效的色谱分离以及特征的碎片离子,可同时检测混合样品中的不同组分,故而可以对隐蔽型毒素及其原型、代谢物甚至不同类型的毒素同时进行定量分析[6]。Palacios等[18]运用LC-MS/MS第一次在阿根廷不同地区收获的小麦中检测到DON-3-G和少量的乙酰化衍生物。UPLC是在HPLC基础上,以1.7 μm的超细色谱柱填料为核心的新型色谱分离分析技术,可以极大地提高分离效率和分析速率[75]。Deng Chunli等[25]建立了IAC-UPLC-MS/MS检测方法,运用于河南省居民尿液样品中DON及其隐蔽型毒素的风险评估,样品前处理回收率为78.5%~112%,定量限为0.2~2 μg/L,极大地提高了检测效率和准确性。
5 结 语
DON在生物作用下会转化形成各种隐蔽型毒素,其中植物对DON的修饰是共轭结合,微生物主要是脱环氧作用和氧化还原作用,在动物体内大部分代谢为葡萄糖醛酸结合物。这些生物转化往往并不彻底,使中毒症状更加复杂,增加了粮食及其副产品的安全风险。
为了实现对DON的高效生物脱毒,以下方面还需进一步研究:1)通过富集高选择性培养基,利用聚合酶链式反应变性凝胶电泳细菌谱和有效的分子技术增加从复杂的微生物群筛选微生物的机会,以脱环氧和C3位差向异构化为方向筛选安全、降解能力强的降解菌;2)使用活性酶也是真菌毒素降解的另一种研究方向,进一步加强对DON降解微生物中发挥作用的关键酶的提取纯化,并通过酶活性研究和分子模拟技术增强其对隐蔽型毒素的降解效果;3)进一步提高检测技术,量化隐蔽型毒素的含量并制定限量标准,最大限度地降低污染物对公众健康的风险;4)生物脱毒的微生物制剂可作为添加剂应用于食品和饲料工业,但需严格确保其功效及安全性。

