基于食源性细菌群体淬灭的生物膜控制研究进展
王飞飞,吴豪益,林 晨,张 岩,傅玲琳,王彦波,
(1.浙江工商大学食品与生物工程学院,浙江 杭州 310018;2.河北省食品检验研究院,河北 石家庄 050091)
细菌生物膜广泛存在于各种食品和食品加工表面,研究发现细菌生物膜不仅可以引起食源性疾病爆发,与食品腐败也有着显著的相关性,严重制约了食品工业的健康发展[1]。鉴于此,食源性细菌生物膜的控制引起了广泛的关注。研究表明,细菌生物膜是细菌在生长过程中,为了适应生存环境,由细菌自身分泌的多糖、DNA、蛋白质等胞外多聚物(extracellular polymeric substances,EPS)组成的一个具有三维立体空间结构的生态群落[2]。在生物膜的保护下,细菌能耐受高浓度的抗菌剂和食品防腐剂,显著增加食品安全风险[3]。进一步探究发现,群体感应(quorum sensing,QS)系统在食源性细菌生物膜形成的各阶段起着关键调控作用,因此,通过特定的方法有效阻断细菌Q S 系统即群体淬灭(q u o r u m quenching,QQ),成为一种新型的控制细菌生物膜的手段,得到了广泛研究[4]。
1 基于食源性细菌群体感应系统的生物膜形成
当细菌细胞接触到食品或食品加工表面时,通过鞭毛、菌毛和一些表面蛋白等进行细胞的初始附着,逐渐形成生物膜微菌落,微菌落通过细胞增殖生长并产生大量EPS,负责细胞间的黏附并形成细胞支架,从而维持生物膜的三维结构。细胞被紧密地包裹在生物膜中,逐渐实现信号分子的积累,并通过QS信号分子进行交流。反过来,响应种群密度阈值触发的QS参与调节生物膜形成的各个阶段,从而形成一个完整的“附着-微菌落形成-成熟-分散”生物膜生命周期[1](图1)。
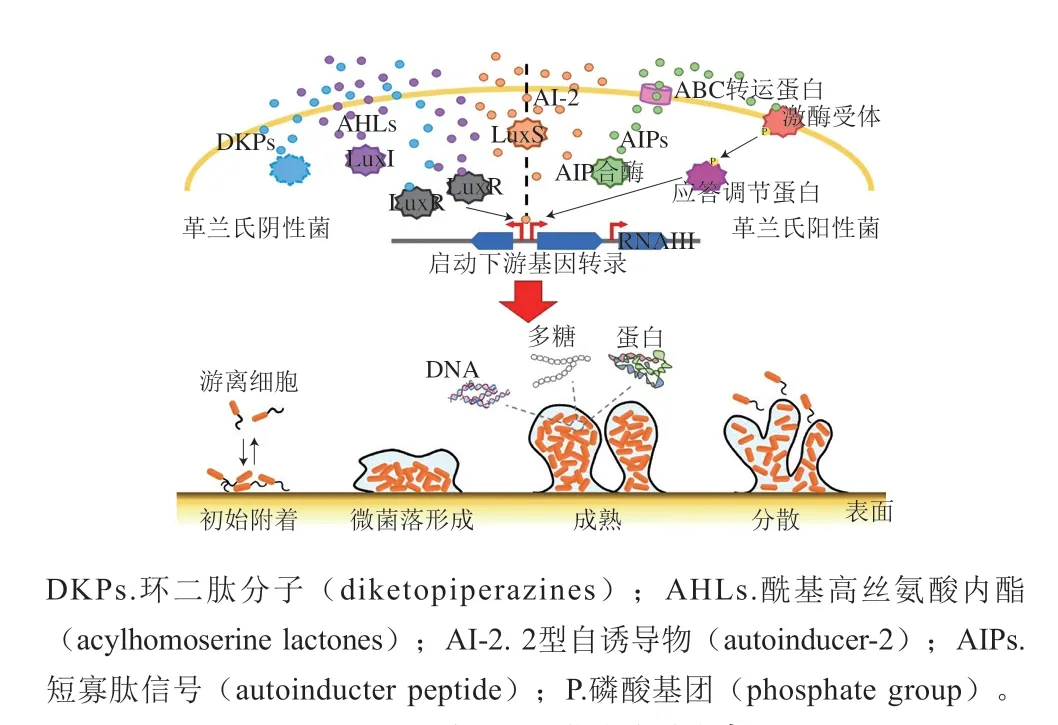
图1 QS系统调控细菌生物膜生命周期Fig. 1 Regulation of the QS system on the biofilm life cycle
细菌QS系统依赖于细胞外化学信号分子即自诱导因子的产生、释放和检测。这些信号分子在环境中进行局部积累,当达到适当的阈值浓度后,与受体蛋白相互作用,导致细菌特定基因的表达发生相应变化。在革兰氏阴性菌中,酰基高丝氨酸内酯(acylhomoserine lactones,AHLs)信号分子由一种LuxI型酶合成。在AHLs达到适当的阈值浓度后激活LuxR受体蛋白,使靶效应基因得以转录[5-7]。革兰氏阳性菌可以产生AIP,并通过ABC转运蛋白运输到细胞外,由膜结合的激酶受体传感器和细胞质应答调节蛋白组成的双组分以及调节效应器RNAIII来改变靶基因表达。AI-2则被认为是种间通用的信号分子,广泛存在于革兰氏阳性菌和革兰氏阴性菌中,而LuxS是合成AI-2的关键酶,LuxS催化S-核糖同型半胱氨酸裂解为同型半胱氨酸和4,5-二羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD),DPD随后进行自发重排和修饰,形成一种分子混合物,统称为AI-2[8]。
研究表明,QS系统信号分子的合成在食源性细菌生物膜形成中起着重要作用。首先是负责编码AHLs信号分子合成酶的luxI型基因,洋葱伯克霍尔德菌(Burkholderia cenocepacia)具有两套QS系统cepIR和cciIR,其中,基因cepI和cciI分别编码合成C6-HSL和C8-HSL信号分子的LuxI型信号分子合成酶。研究发现Burkholderia cenocepaciaK56-2的cepI和B. cenocepaciaJ2315的cepI和cciI突变株在生物膜形成方面存在缺陷[9-10]。同样地,编码合成AHLs信号分子的luxI型基因ahyI和swrI突变分别导致嗜水气单胞菌(Aeromonas hydrophila)和液化沙雷氏菌(Serratia liquefaciens)形成缺乏微菌落的未成熟生物膜[11]。此外,luxS基因缺失会影响AI-2的合成从而影响弧菌属(Vibriospp.)、链球菌属(Streptococcusspp.)、葡萄球菌属(Staphylococcusspp.)生物膜的形成[12-13]。AIP和调节效应器RNAIII生成能力缺失影响金黄色葡萄球菌(Staphylococcus aureus)的生物膜形成[14]。由此可见,不管是革兰氏阴性菌还是阳性菌,信号分子合成酶基因的缺失或突变都可以通过阻碍信号分子合成,从而影响信号传导进而影响生物膜形成。
近年来,研究进一步阐明了QS系统调控细菌生物膜形成的分子机制。在生物膜形成的初始阶段,QS系统通过调节黏附素和鞭毛等相关基因的表达来调控细菌与表面的附着能力。研究发现,luxR基因缺失导致波罗的海希瓦氏菌(Shewanella baltica)鞭毛马达基因pomA表达下调,从而导致生物膜形成能力受损[15];S. aureus的luxS突变体通过改变rfb基因的表达来调节依赖于多糖黏附素的生物膜形成[16]。此外,QS系统可以通过调节EPS的分泌来调控生物膜的成熟。泰兰伯克霍尔德氏菌(Burkholderia thailandensis)luxR的同源基因btaR1突变体通过降低EPS中的岩藻糖含量,从而形成丧失穹顶结构的生物膜[17];Pseudomonas aeruginosa的3 个QS系统(las、rhl和pqs)均可通过调节EPS中eDNA的释放,从而影响生物膜结构[18];pqsQS系统还能通过调控前噬菌体进而诱导细胞裂解,引起eDNA释放,影响生物膜形成[18];此外,生物膜约30%的EPS蛋白来自膜泡(membrane vesicle,MV),而MV的产生受las和pqsQS系统调控[19];同样地,枯草芽孢杆菌(Bacillus subtilis)QS系统oppA、oppF、comX、comP和comA的基因突变,也能导致EPS中eDNA的释放缺陷,从而影响生物膜形成[20]。QS系统在生物膜的分散阶段也起着重要的调控作用。在生物膜成熟后期,创伤弧菌(Vibrio vulnificus)的LuxR同源蛋白SmcR通过诱导荚膜多糖基因簇的转录产生荚膜多糖,其亲水性促进了生物膜结构的分散[21];S. aureus的agrQS系统通过控制psm基因的表达产生表面活性剂从而促进生物膜分散以及生物膜的传播定植[22]。
2 基于食源性细菌群体淬灭的生物膜控制
目前,食品工业仍在使用常规的细菌生物膜控制手段,包括良好的生产卫生、合理生产线的运行以及有效使用清洁消毒剂等[1]。随着生物膜对常规消毒剂的抵抗力日益增强,为了满足食品加工系统对食品安全的要求,需要一种更有效、更环保的控制手段。QS淬灭剂是一类在不影响细菌生长的情况下,以QS系统为作用靶点,通过干扰、阻断细菌QS系统从而达到有效控制生物膜的新型化合物;因此,基于QQ的生物膜控制还可以最大限度地减少细菌耐药性的产生。根据QS调控细菌生物膜形成的分子机制,目前QQ机制主要有以下几种:抑制信号分子的合成、信号分子酶解失活、与信号分子受体结合(比如阻断信号分子-受体复合物的形成)[23-24]。
2.1 抑制信号分子的合成
在信号分子合成阶段,抑制信号分子合成过程酶的活性、抑制信号分子前体物质的合成、添加前体物质类似物等都可以起到抑制信号分子合成的作用。AHL是由LuxI家族蛋白将一个酰基载体蛋白的脂肪酰基衍生物转移到S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)的氨基上而形成的。因此,SAM或脂肪酸生物合成抑制剂可用作AHL信号产生的抑制剂;另外,腺苷同型半胱氨酸和5-甲基硫代腺苷等各种SAM类似物通过竞争SAM催化位点也可以抑制AHL信号的产生[8]。Christensen等[25]利用高通量酶联体外筛选技术得到一系列AHL合成酶的潜在抑制剂,其中化合物1~3(化合物筛选结果见Pubchem数据库,http://pubchem.ncbi.nlm.nih.gov/assay/assay.cgi?aid=720554,accession no. AID 720554)可以显著抑制鼻疽伯克霍尔德氏菌(Burkholderia mallei)BmaI1和鼠疫耶尔森氏菌(Yersinia pestis)YspI的AHL信号分子合成活性。肉桂醛可以与信号分子合成酶LasI和RhlI的底物结合位点相互作用,抑制P. aeruginosaQS系统关键下游基因lasB、rhlA和pqsA的表达,从而影响生物膜形成[26]。同样地,真菌次生代谢物氨丁酸可以通过抑制信号分子合成酶AgrB的活性来抑制不同革兰氏阳性菌AIP的生物合成[27]。此外,有研究表明与LuxS催化位点同源的小分子肽5411(MHTLEHLFAGFM)和5906(MLFAGFM)通过与LuxS特异性结合从而抑制迟缓爱德华氏菌(Edwardsiella tarda)AI-2的产生,进而使生物膜得到控制[28]。
2.2 信号分子的酶解
合成的QS信号分子可以通过酶进行降解,以防止其积累和随后的QS系统激活。这些酶通过降解产生的信号分子,进而控制生物膜形成。目前,关于酶解QS信号分子的研究主要集中在AHL信号分子。AHL内酯酶和酰化酶分别水解AHL分子的高丝氨酸内酯(homoserine lactone,HSL)环和酰基侧链的酰胺键从而直接降解AHL信号分子[29],AHL分子氧化还原酶可以将信号分子中的羰基还原成羟基从而使其失活[8]。从鼠尾菌Muricauda oleariaTh120中分离出来的内酯酶MomL具有同等降解长链和短链AHL的能力[30],但是其对生物膜形成的影响有待验证。蜡状芽孢杆菌VT96(Bacillus cereusVT96)产生的AHL内酯酶AiiA可直接控制P. aeruginosaPAO1中胞外多糖的产生及生物膜的形成[31]。芽孢杆菌产生的AHL内酯酶AiiAAI96通过酶解威隆气单胞菌LP-11(Aeromonas veroniiLP-11)产生的AHL,从而降低其蛋白酶活性和细胞泳动性[32]。丁香假单胞菌(Pseudomonas syringae)能产生AHL酰化酶HacA和HacB,P. syringaeHacA和HacB缺失株的生物膜形成能力明显增强[33],说明HacA和HacB能够破坏AHL分子的酰胺键从而控制生物膜形成。目前,还鲜有涉及AHL信号分子氧化还原酶在控制生物膜形成中的研究,此外,AIP和AI-2信号分子的降解酶有待挖掘。虽然这些酶的酶解作用是降解信号分子的主要途径,但这些酶普遍活性偏低、专一性不够高、活性受环境影响大,因此,在信号分子降解酶的筛选优化以及分子改造方面需要进一步研究。
2.3 与信号分子受体结合
根据QS系统响应机制,达到阈值浓度的信号分子与相应受体蛋白特异结合后,通过信号转导从而激活细菌生物膜形成相关基因的转录,最终影响生物膜形成。基于此,一些人工合成或天然化合物可通过与信号分子竞争受体结合位点,也可以通过非竞争性的方式与受体结合,阻断信号向细胞内传递,从而达到控制生物膜的目的。
目前,关于AHL信号分子的竞争性受体,研究主要集中于其酰基侧链或内酯部分的修饰,以及其中心酰胺结构的改变,用以开发分子类似物,以达到控制生物膜形成的目的[34]。研究表明,采用环戊基或环己酮环取代内酯环得到的AHL类似物(C9-CPA和C10-CPA)可以显著影响粘质沙雷氏菌(Serratia marcescens)和P. aeruginosa的生物膜形成[35-36]。在酰基侧链修饰芳香基团而得到的AHL类似物(苯丙酰高丝氨酸内酯和苯氧乙酰高丝氨酸内酯)则可以抑制P. aeruginosa生物膜的形成[37]。此外,邻氨基苯甲酸甲酯能与C4-HSL竞争结合LuxR受体,进一步抑制luxI和luxR基因表达,从而影响温和气单胞菌(Aeromonas sobria)生物膜形成[38]。薄荷醇可以通过与LasR和PqsR受体相互作用分别抑制las和pqsQS系统-调控的下游转录,从而干扰P. aeruginosa的生物膜形成[39]。
对于AI-2型QS系统,AI-2和DPD类似物都可以竞争性地抑制信号分子与受体结合,从而阻断QS通路。DPD衍生物包括Ac2-DPD、烷基-DPD和DPD碳酸盐,以及DPD结构类似物如5-羟基-2,3-戊烷二酮和4-羟基-5-甲基-3-(2H)-呋喃酮都可以干扰AI-2型QS系统;一些含二醇化合物(包括邻苯三酚)、硼酸和砜已被证明可以有效拮抗AI-2与周质受体LuxP的结合[8,40];恶唑硼酸盐(含负电荷硼原子的杂环水合物)和吩噻嗪也能干扰AI-2型QS系统[41-42],但是这些化合物在生物膜控制方面的应用鲜有报道。在生物膜控制方面,熊果酸、异丁基-DPD、异丁基-DPD与庆大霉素联用、苯基-DPD以及苯基-DPD与庆大霉素联用能抑制大肠杆菌(Escherichia coli)和P. aeruginosa生物膜的形成,并能清除预先形成的生物膜[43-44]。此外,信号类似物4-甲氧羰基苯基硼酸和SAM腺苷衍生物LMC-21在不影响细菌生长的同时,可降低鳗弧菌(Vibrio anguillarum)和创伤弧菌(Vibrio vulnificus)的生物膜总量[45]。
对于AIP型QS系统,包括截短类似物(Tr-AIP-I、Tr-AIP-II和Tr-AIP-IV)和N-乙酰化的类似物Tr-(Ala)-AIP-I在内的AIP信号的类似物对Staphylococcus spp.的QS系统均有抑制作用[46]。另外,发光杆菌属(Photobacterium)产生的环缩肽磺酰胺A和B,以及罗伊氏乳杆菌RC-14产生的环二肽L-Tyr-L-Pro和L-Phe-L-Pro能干扰agr QS系统[47-48]。然而,目前关于这些化合物在生物膜控制中的研究很少。在生物膜控制方面,研究最广泛的AIP型QS系统抑制肽是RNAIII抑制肽,该抑制肽及其类似物和非肽类似物金缕梅单宁能干扰RAP/TRAP QS系统[49-51]。进一步的研究表明,金缕梅单宁可以通过与QS受体TraP结合,改变S. aureus细胞壁合成和eDNA的释放,从而影响生物膜的形成及其抗生素敏感性[52]。
3 结 语
虽然目前已逐渐将QS淬灭剂作为新型的生物膜清除剂,并提出将两种或两种以上不同的控制技术相结合的方法来控制生物膜形成,比如QS淬灭剂和传统抗生素联用,利用纳米技术对QS淬灭剂进行改造等产生的协同效应可以显著增加生物膜消除效率,并在一定程度上避免细菌耐药性的产生。随着对新鲜食品、即食食品、加工食品的需求增加和对食品安全性要求的提高,仍有必要开展以下几方面研究。
目前,大量研究发现天然植物和微生物提取物可以作为QS淬灭剂,但其淬灭机制还有待研究确认。例如,Choi等[53]发现山茱萸提取物具有抗QS活性,并显著抑制P. aeruginosa、小肠结肠炎耶尔森菌(Yersinia enterocolitica)和A. tumefaciens生物膜的形成。百里香精油、香芹酚和百里酚能显著抑制P. fluorescens KM121 AHLs的产生,降低细胞泳动性和鞭毛基因的mRNA水平[54]。黑衣草提取物合成的氧化锌纳米颗粒展现出了广谱AHL型QS抑制能力,并通过降低细胞群集运动和EPS产生从而广谱抑制4 种食物致病菌的生物膜形成,还可以清除预先形成的生物膜[55]。极端嗜盐古生菌提取物反式4-(2-羧基-乙烯基)苯甲酸在lasB-gfp、rhlA-gfp和pqsA-gfp生物传感菌株上显示出了QS淬灭性能,并且显著抑制了P. aeruginosa生物膜形成[56]。Prateeksha等[57]发现地衣内生菌提取物可以淬灭QS信号分子,从而减少P. aeruginosa PAO1胞外多糖和微菌落的形成。解析这些天然提取物的化学结构,进一步挖掘其作用靶点,有助于丰富群体淬灭机制,为QS淬灭剂的产业化合成提供理论基础。
目前仅已知一小部分细菌的QS系统调控生物膜形成的分子机制,且细菌间的QS调控网络仍然不清晰。阐明各食源性致病菌和特定腐败菌的QS机制,以及QS对其生物被膜形成的调控机制,有利于为特异性筛选QS淬灭剂提供靶点。
由于不同阶段的生物膜形成调控机制不同,相应生物膜控制策略的选择也不同;因此,研究需致力于确定生物膜阶段特异性转录组,以鉴定参与生物膜发育不同阶段的基因以及各种调控型RNA,并提供生物膜阶段特异性防控靶点,从而达到更高效的生物膜控制效果。
生物膜中的细菌基因表达是异质的,并且会随着外界环境的改变分化出不同表型的亚群,而目前大多数实验室都是在静态条件下进行生物膜研究的,对这种异质基因表达如何在变化的环境中促进生物膜的灵活性和可塑性的贡献知之甚少,新兴单细胞分析等技术的发展为探索单细胞生物的多细胞性提供了可能,对其进行阐明有助于扩展生物膜形成调控理论知识和开发生物膜消除的新方法。

