多糖对肿瘤细胞自噬调控作用的研究进展
徐涵禹,李雨婷,金周雨,,宋 慧,2,
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.吉林农业大学 教育部食药用菌工程研究中心,吉林 长春 130118)
多糖作为生物大分子物质与蛋白质、核苷酸等共同在生物体的生长发育中有极其重要的作用,多糖具有调节免疫系统、抑制肿瘤细胞的生长、使肿瘤细胞周期阻滞并诱导其发生细胞凋亡[1]、抗心血管的生成和转移[2-3]等方面的作用。目前,多糖因其高效率和低毒性的特点,已成为医药科学领域研究的重点。
自噬是一种细胞程序性死亡机制,类似于细胞凋亡和坏死,调节细胞发生自噬性死亡[4],其在进化上是一种高度保守的自我降解过程,在细胞应激反应及存活中起到关键作用[5]。细胞自噬是在细胞内基因表达调控下进行的一种主动过程[6-7]。自噬在人体健康和疾病中的重要性得到了更广泛的关注,其中尤为重要的是自噬在癌症中的作用[8]。本文将围绕多糖对肿瘤细胞自噬的影响展开综述。
1 细胞自噬
1.1 自噬的过程
细胞自噬是指细胞在外界因素的影响下,对其内部受损的细胞器、错误折叠的蛋白质和侵入机体的病原体进行降解的生物学过程[9]。根据胞内物质运送至溶酶体内的途径不同,将自噬分为巨自噬、微自噬[10]及分子伴侣介导的自噬[11]。巨自噬是在即将发生自噬的细胞质中出现大量游离的膜性结构,这些膜性结构逐渐包裹受损的蛋白质和细胞器,形成独立有核的囊状结构并逐渐延伸成为自噬囊泡,然后自噬囊泡边缘融合形成自噬小体,随后自噬小体与溶酶体融合形成自噬溶酶体,最后降解所包裹的内容物的过程[12];微自噬包含两种自噬方式,分别为选择性微自噬和非选择性微自噬,选择性微自噬是指特定细胞器直接靶向作用于溶酶体来介导自噬,非选择性微自噬是通过管状膜内陷到溶酶体中直接吞噬细胞器及其组分介导自噬;分子伴侣介导的自噬是一种选择性自噬形式,涉及热休克蛋白70复合物和溶酶体膜相关蛋白2A的多聚化[13-14]。目前有关自噬的研究中,巨自噬相较于微自噬和分子伴侣介导的自噬报道较多。
1.2 肿瘤细胞自噬
自噬是一种存在于正常细胞中的生理过程,自噬失调会产生各种疾病,如神经退行性疾病[15]、感染性疾病[16]、血管疾病、免疫系统疾病[17]和癌症[18]。机体饥饿,缺氧及缺乏能量的情况下,自噬又是一种重要的细胞存活机制[19]。Aita等[20]在自噬与肿瘤发生的研究中发现,自噬相关基因Beclin-1缺失的小鼠发生了原发性肿瘤,随后在乳腺癌、卵巢癌、前列腺癌中也发现了有等位基因Beclin-1缺失的现象,使用荧光探针鉴定出22 个乳腺癌细胞系存在9 个等位基因Beclin-1的缺失。自噬过程是动态变化的,并可以在不同组织细胞中以不同的速率发生,自噬体的形成、自噬性底物向溶酶体的运送以及在溶酶体内降解的整个过程称为自噬流。研究表明,随着在肿瘤细胞生长时间的延长,自噬流可能会随着肿瘤生长量的上调或下调[21],产生两种完全不同的自噬状态。
一方面,有研究发现自噬上调会促进癌细胞死亡,Arcella等[22]在使用雷帕霉素诱导自噬从而使小鼠胶质母细胞瘤细胞减小的实验中证明,雷帕霉素诱导的自噬上调可以延长小鼠的存活时间并使肿瘤的体积变小;Zhou Chunxian等[23]在自噬影响结直肠癌细胞生长的实验中也证明了自噬相关蛋白(autophagy-related protein,Atg)基因5(Atg5)的上调,诱导结直肠癌细胞死亡。Liu Guoke等[24]发现自噬可以促进癌细胞存活并增加对化疗药物的耐药性。另一方面,有研究发现抑制肿瘤细胞自噬,可以减少肿瘤细胞的生长,使细胞凋亡数增加,Jin Fangfang等[25]研究结果表明,抑制自噬的表达可以促进细胞凋亡并增强肝癌细胞对化疗的敏感性;使用氯喹或通过下调Atg7抑制自噬可以促进细胞凋亡,进而诱导细胞死亡[26]。因此,癌症治疗中是否应该增强自噬[27-28]是值得深入探讨的问题。后文将围绕信号通路阐述自噬的形成过程及多糖对自噬的调控作用。
2 多糖调控自噬相关信号通路
多糖对自噬相关机制的研究主要集中在磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和腺苷一磷酸激活蛋白激酶(adenosine-monophosphateactivated protein kinase,AMPK)等信号通路,在自噬起始步骤中,Atg1/Unc-51样激酶1(Unc-51-like kinase 1,ULK1)、Atg13基因及分子质量为200 kDa的黏着斑激酶家族相互作用蛋白(focal adhesion kinase family interacting protein of 200 kDa,FIP200)激酶复合物被mTOR蛋白复合体1(mTORC1)抑制及腺苷一磷酸(adenosine monophosphate,AMP)依赖的AMPK、PI3K/AKT、p38 MAPK激活。在自噬的成核步骤中,ULK1复合物磷酸化并激活Beclin-1/囊泡蛋白分拣(vesicle protein sorting,VPS)4复合物。该复合物包括Beclin-1、VPS34、PI3K、VPS15、Atg14和自噬Beclin-1调节因子1(activating molecule in Beclin-1 regulated autophagy,AMBRA-1),起始蛋白和成核蛋白均促进自噬囊泡膜的形成。这种膜可以来自线粒体、质膜或内质网[29]。在成熟步骤中,自噬体形成需要两个独特的蛋白质偶联事件:1)Atg7和Atg10结合至Atg5和Atg12;2)Atg7、Atg3和Atg1与轻链3(light chain 3,LC3)共轭结合[30-31]。Atg5-Atg12结合物与自噬相关16样蛋白1(Atg 16-like 1,Atg16L1)形成复合物,Atg5-Atg12-Atg16L1复合物锚定在VPS34上,通过含有多个保守的WD基元的蛋白质重复结构域,与磷酸肌醇(phosphatidylinosito-2b,WIPI-2b)相互作用产生新的自噬体膜。自噬相关信号通路指示图如图1所示。

图1 自噬相关信号通路指示图Fig. 1 Autophagy-related signaling pathways
2.1 多糖调控PI3K/AKT/mTOR信号通路
PI3K/AKT/mTOR信号通路的机制靶标参与细胞生长、增殖与分化、凋亡与自噬,并在肿瘤的发生、发展及治疗中起着至关重要的作用。PI3K刺激信号级联产生磷脂酰肌醇三磷酸并促进AKT的激活;AKT是抑制细胞凋亡促进细胞存活的相关蛋白;mTOR激酶是吞噬诱导过程中的关键分子,磷酸化AKT作用于mTOR,激活mTOR通路,这些作用能增强细胞增长的蛋白质表达。PI3K/AKT/mTOR信号通路的调节可以增强或抑制自噬。这条通路是癌症治疗的关键靶点,因为它可以作为许多生长刺激的汇聚点,通过其下游底物控制改善癌症发生和维持的细胞稳态的过程[32]。
黄芪多糖抑制白细胞介素(interleukin,IL)-1β刺激的RSC-364细胞中PI3K/AKT/mTOR信号传导途径的激活,并通过调节PI3K/AKT/mTOR自噬途径在IL-1β刺激的成纤维细胞样滑膜细胞中发挥促凋亡和抗炎作用来降低类风湿性关节炎的病理进展[33]。白灵菇多糖(Pleurotus ferulae Lanzi polysaccharide,PN50G)抑制PI3K/AKT磷酸化进而抑制mTOR的活化。体内对携带肿瘤的小鼠进行成像,结果表明PN50G能够显著增加细胞内活性氧(reactive oxygen species,ROS)水平。此外,它表明PN50G以剂量依赖性方式提高Beclin-1和LC3的蛋白表达量。即PN50G介导的A549肿瘤细胞自噬主要通过PI3K/AKT/mTOR通路发挥作用[34]。枸杞多糖预处理大大减弱了原代培养的海马神经元中的氧葡萄糖剥夺/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)损伤,增加了OGD/R后的p-AKT和p-mTOR水平,即枸杞多糖通过激活PI3K/AKT/mTOR信号传导途径来保护原代海马神经元中的OGD/R诱导的神经元损伤[35]。枸杞多糖处理也可诱导人类血管瘤内皮细胞凋亡,抑制增殖细胞核抗原、肿瘤增殖抗原、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管内皮细胞生长因子受体2(VEGF receptor 2,VEGFR2)和PI3K/AKT信号通路蛋白的表达[36]。
2.2 多糖调控p38 MAPK信号通路
MAPK参与控制细胞因子和应激细胞反应的信号级联反应。p38 MAPK途径是转录和翻译水平的促炎细胞因子生物合成的关键调节剂,其使得该途径的不同组分成为治疗自身免疫和炎性疾病的潜在靶标。MAPK通路是细胞增殖、分化、炎症、凋亡和自噬等信号转导通路的共同交汇通路之一。
有研究发现脂多糖在小胶质细胞中触发p 3 8 α MAPK依赖的ULK1磷酸化。该磷酸化抑制ULK1活性,阻止其与下游效应因子Atg13结合,并减少小胶质细胞中的自噬[37]。黄芪多糖联合10-羟基喜树碱(10-hydroxycamptothecin,HCPT)对各种肿瘤细胞具有显著的抗肿瘤活性[38],包括肺癌细胞、人神经细胞瘤细胞、DU145-TxR前列腺癌细胞、肝癌细胞、口腔鳞状细胞癌和乳腺癌细胞等。已经发现HCPT在体外抑制H1299细胞中的促分裂原活化蛋白激酶3(mitogenactivated protein kinase 3,MAP4K3)活性和Thr389位点处的核糖体S6K蛋白磷酸化。但是,HCPT是否能够在H1299细胞中诱导自噬尚待阐明。因此,评估了自噬相关蛋白(LC31/2和P62)的表达,并证明了并通过破坏MAP4K3/mTOR信号转导S6K诱导了H1299细胞的自噬[39]。从金针菇中分离的多糖(Flammulina velutipes polysaccharide,WFVP-N-b1)被Toll样受体4(Toll-like receptor 4,TLR4)识别,促进了MAPK和AKT的磷酸化,促进核因子κB(nuclear factor kappa-B,NF-κB)p65亚基的核转位和NF-κB的抑制蛋白(inhibitor of NF-κB,IκB)的降解。使用自噬抑制剂(bafilomycin A1,Baf-A1)阻断WFVP-N-b1诱导的自噬进而降低了巨噬细胞的活化。表明WFVP-N-b1激活巨噬细胞是通过自噬途径介导的,这是第一份报道自噬介导异半乳聚糖诱导巨噬细胞活化的研究。总地来说,WFVP-N-b1通过MAPKs、AKT/NF-κB信号通路使TLR4受体激活RAW264.7细胞[40]。Erk和p38 MAPK在保护枸杞多糖免受电刺激诱导的细胞损伤方面发挥了多种作用。枸杞多糖通过调节自噬和MAPK途径改善双极脉冲电流诱导的小胶质细胞(BV-2)损伤[41]。通过自噬双标腺病毒共定位分析发现灵芝多糖在CRC细胞中阻断了自噬体和溶酶体融合,证明了GLP诱导的自噬体积聚和凋亡是通过MAPK/Erk活化介导的。灵芝多糖抑制肿瘤生长并且还抑制体内自噬通量。这些结果揭示了灵芝多糖抗肿瘤作用的新分子机制,表明灵芝多糖是一种有效的自噬抑制剂,可能在肿瘤治疗中起重要作用[42]。
2.3 多糖调控AMPK信号通路
AMPK已被广泛证明是一种在各种代谢应激下起作用的重要代谢调节因子,其中AMPK抑制合成代谢途径并同时激活分解代谢途径以实现能量稳态。研究揭示了许多营养信号分子,包括AMPK、AMPK-mTORC1-ULK1三联体参与自噬的调节[43]。AMPK通过在丝氨酸(Ser)317和Ser777直接磷酸化和激活ULK1促进自噬。PI3K激活AKT使mTOR阻遏物结节性硬化症2磷酸化,导致mTOR活化并随后抑制自噬活性。
灵芝多糖逆转了由棕榈酸促进的细胞凋亡和自噬,通过刺激MAPKs和AMPK磷酸化,抑制AKT和mTOR的磷酸化,揭示了灵芝多糖通过抗细胞凋亡和抗自噬特性对棕榈酸诱发的IPEC-J2细胞死亡的保护作用[44]。在高脂饮食喂养的小鼠组织中,从果胶蜂花粉中分离出多糖以AMPK/mTOR依赖性方式增强自噬[45]。脂多糖促进AMPK磷酸化并使mTOR失活,用脂多糖处理鼻上皮细胞(HNEpC)增加了TLR4的数量,而多黏菌素B抑制TLR4则降低了由脂多糖引起的自噬。此研究首次证明脂多糖在HNEpC中引起自噬,该过程是由AMPK-mTOR途径介导的[46]。脂多糖处理导致LX-2细胞和肝星状细胞(HSC)中自噬体形成和自噬通量的显著增加,其通过AKT-mTOR和AMPK-ULK1途径介导[47]。海藻糖抑制了H2O2诱导的人神经母细胞瘤细胞(SH-SY5Y)内ROS的增加以及超氧化物歧化酶活性的降低,使用抗氧化剂N-乙酰-L-半胱氨酸减轻细胞内ROS水平并显著减弱了H2O2诱导的AMPK激活和内质网应激。该研究表明海藻糖通过减轻ROS依赖性内质网应激和AMPK活化来预防H2O2诱导的SH-SY5Y细胞自噬性死亡[48]。
3 多糖与肿瘤细胞自噬关系
自然界中,多糖存在于几乎所有的生物体中,包括种子组织、草本植物的茎和叶、动物的体液、细菌细胞壁、酵母和真菌的细胞外液等[49],是机体重要组成物质。在中国等亚洲国家,中草药具有悠久的发展历史[50],多糖作为中草药中的活性成分受到了广泛的关注。目前大多数抗肿瘤药物及放疗、化疗手段对机体损伤较大,多糖能减轻放疗和化疗药物的毒副作用并延长肿瘤患者生存时间。多糖可能是开发抗肿瘤药物的理想候选者[51-53],其中最具代表性的香菇多糖已被用作治疗肿瘤的药剂。自噬性细胞死亡是目前抗肿瘤研究的热点,天然产物多糖能否调节细胞自噬受到了越来越多学者的关注。
近4 年来有关多糖影响肿瘤细胞自噬的相关文献总结见表1。
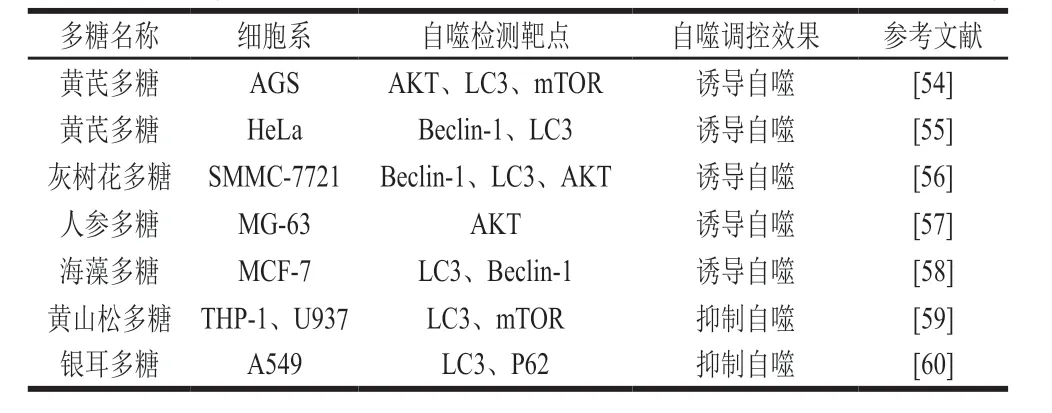
表1 多糖影响肿瘤细胞自噬的调控效果Table 1 Polysaccharides affect the regulation of tumor cell autophagy
3.1 多糖激活自噬、诱导肿瘤细胞死亡
自噬可以在多糖的不同调控作用下产生抗肿瘤作用。多糖可以激活肿瘤细胞自噬、抑制肿瘤细胞增殖。中药黄芪多糖具有较强的抗肿瘤活性和抗炎作用,常被认为是抗癌药物佐剂。Wu Jun等[54]研究表明,中药黄芪多糖通过抑制AKT信号通路增强了抗肿瘤药物阿帕替尼诱导胃癌AGS细胞自噬的能力,减轻其毒副作用从而起到抗肿瘤效果,该实验还发现阿帕替尼和中药黄芪多糖的组合可能是癌症治疗的潜在物质;海藻中含有营养丰富的海藻糖,Park等[58]研究发现海藻多糖激活乳腺癌MCF-7细胞中的mTOR信号传导途径,增强自噬。中药黄芪多糖可通过调节细胞自噬来增加宫颈癌HeLa细胞对抗癌药物顺铂的敏感性,实时荧光定量聚合酶链式反应和蛋白质印记分析结果显示,与对照组相比,Beclin-1、LC3的基因和蛋白表达水平均上调,而p62的基因和蛋白表达水平下调,说明中药黄芪多糖激活了HeLa细胞发生自噬[55]。
除此之外,多糖还可以同时激活肿瘤细胞的凋亡和自噬,两者共同作用抑制肿瘤细胞增殖。Zhang Xiaoyu等[57]研究表明人参多糖可以明显诱导骨肉瘤细胞MG-63发生早期细胞自噬和凋亡,Western blot分析表明,人参多糖降低了p38和AKT的磷酸化以及Bax和Caspase3的蛋白表达。总之,GPS抑制MG-63细胞的增殖,增加凋亡和自噬性细胞死亡[57]。通过检测自噬标记物LC3的表达也可以判断多糖诱导肿瘤细胞发生自噬,自噬发生时,胞浆型LC3被Atg4水解并切割掉一小段多肽形成LC3-1,LC3-1和磷脂酰乙醇胺(即脑磷脂)结合转变为自噬体模型LC3-2,这两种形式存在于正常细胞中,但发生自噬的细胞中LC3-2明显增加,检测LC3-2/LC3-1的值即可判断自噬水平高低。如VC与灰树花多糖联合诱导人肝癌细胞(SMMC-7721)凋亡及自噬,检测到LC3表达水平上调,自噬被激活[56]。
3.2 多糖抑制自噬、诱导肿瘤细胞死亡
肿瘤细胞的自噬是一把“双刃剑”,在饥饿条件下,肿瘤细胞为了存活,一部分肿瘤细胞发生自噬并为其他肿瘤细胞快速分化生长提供所需的营养物质,自噬能使肿瘤细胞继续存活及生长,是肿瘤细胞的一种自我保护机制。而抑制自噬,是使其不能为快速分化的肿瘤细胞提供营养物质,降低肿瘤细胞的生长速率。有研究表明,多糖既可以直接抑制自噬,进而抑制肿瘤细胞增殖;又可以抑制肿瘤细胞自噬进而引发细胞凋亡,两者共同作用抑制肿瘤细胞增殖。
Chao等[59]研究表明,黄山桦的水溶性多糖(Inonotus taiwanensispolysaccharid,WSPIS)以剂量和时间依赖性的方式降低LC3的表达,说明WSPIS能够抑制自噬。为研究自噬在WSPIS诱导的细胞凋亡和细胞死亡中的作用,使用自噬诱导剂mTOR激活自噬,自噬的上调降低了WSPIS诱导的细胞凋亡和细胞死亡,发现WSPIS抑制THP-1细胞中的自噬从而起到了抗肿瘤的作用[59]。Shi Xiaolan等[60]研究了银耳多糖在人上皮肺癌细胞(A549)中由铜绿假单胞菌脂多糖诱导的细胞凋亡和自噬的作用,加入银耳多糖后,抑制了脂多糖诱导的自噬,加快肿瘤细胞死亡,该研究对肺损伤相关铜绿假单胞菌感染的治疗具有重要意义。昆布多糖修饰的硒纳米粒子诱导早期自噬的激活,但阻止了自噬晚期的激活,自噬晚期的抑制作用导致受损的细胞器无法清除并加重HepG2细胞凋亡[61]。
4 结 语
自噬使细胞在饥饿和受到打击情况下维持细胞稳态。适度自噬是一种保护机制,过度自噬则会造成细胞死亡。以调节自噬活性为目的的治疗已经成为肿瘤治疗的热门[62]。在研究肿瘤细胞自噬过程中发现,通过自噬抑制肿瘤可以分为两种途径:1)直接上调自噬相关基因表达,增加肿瘤细胞自噬量,达到抑制肿瘤细胞增长的目的;2)抑制自噬,阻断细胞获取能量,进而诱导细胞凋亡来抑制肿瘤细胞生长。天然产物多糖抑制肿瘤细胞自噬的途径也分为两种,与以上研究结果相似。低毒高产的多糖是否可以成为抗肿瘤药物的辅助品、降低化学药品带来的副作用,成为了目前众多学者研究的重点。从相关报道中发现,多糖相关的自噬研究靶点主要集中在PI3K/AKT/mTOR、MAPK、AMPK等信号通路。而自噬性质判定,即保护机体引发的自噬和致死性自噬的鉴别则较为鲜见。多糖能否与肿瘤细胞表面某一特定受体结合,影响PI3K/AKT/mTOR、MAPK、AMPK上游的某一蛋白,从而激活自噬相关通路表达有待进一步探讨。因此,多糖对肿瘤细胞自噬的调控作用有待更深入的研究。

