miRNA参与益生菌调节肠道屏障功能的研究进展
李艾黎,张 欣,李 颖,杨佳杰,马向阳,贾新栋,杜 鹏
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
益生菌作为一类可对宿主健康产生有益影响的微生物,可通过调节肠道微生态环境来改善精神健康状况、降低胆固醇、改善人体胰岛素水平、调节免疫因子、辅助过敏治疗等[1-4]。常用的益生菌如双歧杆菌、嗜酸乳杆菌、植物乳杆菌等凭借其安全可靠、性能优良的生理特性备受消费者关注和青睐,已被广泛应用于食品、医药和饲料工业。预计2020年益生菌膳食补充剂和益生菌非处方药的国内市场规模将达到850亿 元[5]。
越来越多的研究发现益生菌与肠道屏障的生理状态以及病理性改变密切相关,有关益生菌保护和调节宿主肠道屏障的作用机制不断被揭示。如Jang等发现短乳杆菌G-101可显著下调结肠炎小鼠肠道内细胞炎性因子细胞白介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子(tumor necrosis factor-α,TNF-α)的水平,增强肠道黏膜免疫功能[6]。Yi Hongbo等观察到罗伊氏乳杆菌LR1通过恢复仔猪肠道紧密连接蛋白表达,修复致病性大肠杆菌破坏的肠上皮屏障[7]。miRNA(microRNA)是一种广泛参与细胞生理及病理活动的非编码小RNA分子,主要通过特异性的碱基配对与靶基因mRNA结合,在转录后水平上对基因表达进行调控。miRNA在肠道组织中表达极为丰富,不仅是肠道生长、发育和黏膜屏障的重要调控环节,而且在肠道免疫耐受和防御病原微生物感染方面也发挥重要作用[8]。最新的体外细胞和体内动物实验提示,益生菌保护或恢复肠黏膜屏障功能的作用亦与调节miRNA的表达密切相关。本文就miRNA参与益生菌保护肠道屏障和肠道稳态的相关研究进行文献收集和整理,拟从miRNA的作用机制及其在肠道疾病中的差异表达、益生菌调节肠道屏障功能和miRNA参与益生菌调节肠道屏障这3 个主要方面展开综述,旨在从miRNA角度分析益生菌对肠道上皮屏障功能的调节作用及其分子机制。
1 miRNA与肠道屏障
1.1 miRNA的生成及作用
miRNA是一类约由19~22 个核苷酸组成的内源性单链非编码小分子RNA,具有高度的保守性和组织器官特异性,参与肠道上皮细胞的增殖、分化以及肠道免疫功能[9]。miRNA编码基因在细胞核内被核酸内切酶裂解,形成含茎环结构的前体Pre-miRNA,随后该前体从细胞核中转移到细胞质,并在内切酶作用下形成短的双链RNA,双链中的前导链结合RNA诱导的沉默复合体产生具有生物活性的成熟miRNA。miRNA通过结合靶基因促进靶基因的mRNA降解并抑制其蛋白的表达,从而在转录后水平调控靶基因的表达[10]。具体机制与靶基因结合程度有关,如果miRNA与靶mRNA匹配完全,则该复合体降解mRNA;若两者序列部分匹配,如miRNA的5’端2~8 个被称为种子序列的核苷酸与靶mRNA完全匹配,则通过抑制靶mRNA的翻译来沉默特定基因。此外,某些miRNA能够特异结合于靶基因的富含腺嘌呤/尿嘧啶元件的3’端非翻译区,从而指导Ago蛋白与锌脂蛋白结合成沉默复合体区,进而改变相应mRNA的半衰期,加速靶mRNA的降解[11-12]。
1.2 miRNA在肠道疾病中的异常表达
炎性肠病、肠道肿瘤等肠道疾病存在不同程度的肠道屏障损伤,宿主体内异常表达的miRNA可能是诱因之一。如炎症性肠病(inflammatory bowel disease,IBD)患者肠道黏膜中激增的Th17细胞、内皮细胞、巨噬细胞等产生大量促炎细胞因子(如TNF-α、IL-1β、IL-6、IL-23等)可造成肠道屏障损伤[13]。Wu Feng等通过微阵列、实时荧光定量聚合酶链式反应和原位杂交分析发现,与健康组相比,在结肠炎患者结肠中有11 个miRNA差异表达,其中miR-192表达水平显著降低,该miRNA可靶向下调免疫调控因子巨噬细胞炎症蛋白2的表达,导致炎性细胞因子TNF-α大量产生破坏肠道屏障完整性,从而加重患病症状[14]。Xue Xiaochang等发现IBD患者肠黏膜组织中表达水平降低的miR-10a可负反馈调节相应靶基因,致使IL-23分泌激增[15]。Polytarchou等观察到IBD患者体内过表达的miR-214激活了转录调控因子STAT3,进而促进IL-6产生[16]。另外,IBD患者体内上调的miR-223可通过靶向抑制紧密连接蛋白相关基因CLDN8表达,破坏肠道上皮细胞屏障[17]。
此外,结直肠癌(colorectal cancer,CRC)患者肠道癌变细胞大量快速增殖会破坏其细胞组织,进而造成严重肠道屏障损伤[18]。迄今已发现百余个与CRC密切相关的miRNA[19],如Slattery等对217 例CRC病例分析后发现,CRC患者肠道内的11 个异常基因与37 个异常表达的miRNA相关,特别是miR-150-5p和miR-196b-5p[20]。进一步的研究提示,miRNA可通过影响肿瘤生成通路及其相关蛋白表达进而影响肿瘤增殖、侵袭和转移。如miRNA-106a、miRNA-92可通过激活磷脂酰肌醇-3激酶/蛋白激酶B
(phosphatidylinositol-3 kinase/protein kinase B,PI3K/AKT)信号通路促进结肠癌的转移[21-22]。而miRNA-145则可通过扰乱结肠癌细胞内Wnt/β-连环蛋白(wingless integrated/β-catenin,Wnt/β-catenin)信号通路的转运抑制早期细胞癌变。此外,miRNA-145还可通过破坏连环蛋白δ-1的核穿梭功能,致使β-catenin核转运异常而发挥抑癌作用[23]。
另有实验利用过表达和干扰工具观察miRNA协同其靶基因的负反馈功能,评估miRNA作为生物靶点修复肠黏膜损伤的潜在作用。如Valeri等发现沉默miRNA-135b表达可有效抑制结肠肿瘤细胞增殖[24]。而给予2,4,6-三硝基苯磺酸诱导的急性结肠炎小鼠miR-301a或miR-141抑制剂灌肠治疗,可显著降低Th17细胞比例以及IL-17表达,防止炎症浸润损伤肠道屏障[25-26]。由此可见,加强对miRNA分子和肠道屏障功能之间关系的研究,有利于深层次挖掘和揭示影响机体肠道健康的机理。
2 益生菌调节肠道屏障功能
肠道屏障是机体抵抗外界有害物质的重要保障,与人体健康息息相关,主要由机械屏障、免疫屏障与生物屏障构成。其中机械屏障由肠上皮细胞、细胞间紧密连接蛋白与菌膜三者构成;免疫屏障由细胞因子、免疫球蛋白(immunoglobulin,Ig)与免疫活性细胞等共同组成;生物屏障由肠道菌群和肠上皮细胞结合产生的黏蛋白、活性肽等共同组成[27-29]。益生菌可通过调节肠道免疫、保护肠道上皮细胞和细胞间紧密连接、改善菌群失调等途径增强肠道屏障功能[30],进而维护肠道健康。
已有研究报道益生菌通过影响免疫屏障中的p38丝裂原活化蛋白激酶/核转录因子-kappa B(p38-mitogenactivated protein kinase/nuclear factor kappa B,p38 MAPK/NF-κB)信号通路,降低炎症因子IL-6、TNF-α、IL-8的转录与表达,减少上皮细胞凋亡,改善炎症病变。如Kim等证实双歧杆菌KCTC 5727抑制了TNF-α诱导的NF-κB信号通路激活,显著缓解小鼠急性结肠炎[31]。Takeda等研究表明,副干酪杆菌06TCa19通过抑制p38 MAPK信号通路,下调IL-8水平,从而有效改善幽门螺旋杆菌患者胃肠炎症[32]。Liu Meiling等也发现乳酸链球菌ML2018可通过抑制p38 MAPK/NF-κB炎症通路,下调TNF-α、IL-1β、IL-6水平,减轻硫酸葡聚糖钠(dextran sulfate sodium,DSS)诱导的小鼠结肠炎[33]。此外,益生菌对宿主免疫屏障的调节作用还体现在刺激宿主分泌Ig、增强体液免疫方面。如双歧杆菌OLB6378可上调血清IgG和肠道IgA表达水平,增强低出生体重婴儿的免疫力[34]。同样地,副干酪乳酸菌MCC1849也可诱导肠道分泌IgA[35]。Kozakova等发现小鼠灌胃含李糖乳杆菌LOCK0900、鼠李糖乳杆菌LOCK090833和干酪乳杆菌LOCK0919的混合益生菌后,其血清中特异性IgE降低,总IgA水平提高,同时明显改善了小鼠对花粉的敏感性[3]。
益生菌还可促进紧密连接蛋白(包括闭合蛋白(Occludin)、密封蛋白(Claudin)、闭合小环蛋白(zonula occludens,ZO)-1、2、3)表达从而保护肠道机械屏障完整性。如蒋红利等发现,双歧杆菌Bi-07通过上调尿毒症大鼠肠道紧密连接蛋白Occludin和Claudin-1的表达水平来促进肠上皮屏障的完整性[36]。Guo Shuangshuang等报道婴儿双歧杆菌和嗜酸乳杆菌可抑制Caco-2细胞中IL-1b诱导的NF-κB信号通路活化,调节Claudin和Occludin表达,降低上皮细胞通透性,保护肠道屏障[37]。Wang Jing等研究发现植物乳杆菌ZLP001通过恢复Claudin和ZO-1表达提高断奶仔猪肠防御肽pBD2、PG1-5和pBD2的生成,下调炎性因子IL-6、IL-8、TNF-α水平,从而改善肠道屏障功能[38]。另外,益生菌可通过修复病原菌诱导的紧密连接蛋白内吞,改善肠道屏障功能。如Jariwala等研究表明,鼠李糖乳杆菌修复了大肠杆菌O26:H11诱导的紧密连接蛋白内吞,并将紧密连接蛋白重新分布到细胞边界,改善致病菌造成的肠道上皮功能障碍[39]。
益生菌调节肠道屏障功能的作用还体现在增加有益菌丰度、减少有害菌比列、维护菌群平衡、保护生物屏障等方面。多项给予肠易激综合征患者或DSS诱导的溃疡性结肠炎小鼠益生菌治疗的研究表明,益生菌可明显增加肠道菌群中有益菌(如双歧杆菌和乳酸杆菌属)丰度,降低有害菌(如芽孢杆菌和嗜胆菌)比例,修复失衡菌群并减少患者体内炎症标志物,促进肠道黏膜功能恢复,使肠道炎症得到显著改善[40-42]。这些研究表明,应用益生菌在防治屏障功能受损相关的肠道疾病中取得良好效果。
3 miRNA参与益生菌调节肠道屏障
3.1 肠道菌群影响宿主miRNA的表达
肠道微生物主要由共生菌、条件致病菌以及病原菌组成,在调节机体营养代谢、拮抗病原菌定植、维持肠道屏障功能等方面发挥重要作用,被认为是连接基因、环境和免疫系统的重要纽带[43-44]。最近研究表明,肠道微生物群可通过调控宿主miRNA表达来影响宿主肠道健康。如Peck等研究发现,在共生菌的影响下,肠道上皮细胞存在19 个miRNA差异表达,其中miR-375与上皮细胞增殖密切相关[45]。Nakata等比较了普通小鼠和无菌小鼠肠上皮细胞的miRNA表达谱,发现共生菌诱导的miR-21-5p在肠道上皮细胞中显著过表达。进一步研究发现,该miRNA可靶向作用于核糖基化因子4调节紧密连接蛋白(Claudin和Occludin)表达继而影响肠上皮通透性[46]。与此类似,Natasha等研究发现,与正常对照组小鼠相比,在无菌小鼠的盲肠中有16 种miRNA差异表达,这些miRNA的靶点均参与调节肠道屏障功能[47]。Liang Guanxiang等研究发现定植于牛肠道内的双歧杆菌或乳酸菌的数量与miR-15/16、miR-29和miR-196的表达水平呈正相关,对淋巴组织和免疫细胞的发育有重要意义[48]。此外,一些病原菌降低机体免疫力使宿主患病也与影响miRNA表达有关。如Xue Xiaochang等发现,与空白对照组小鼠相比,大肠杆菌感染使小鼠肠道内miR-107表达降低,导致该miRNA靶向抑制的炎性因子IL-23 p19大量生成,破坏肠道稳态[49]。Archambaud等报道李斯特菌通过下调小鼠肠道miRNA(miR-192、miR-200b和miR-215)和抗炎因子IL-2、IL-10表达,上调促炎因子IL-22水平,降低小鼠免疫力从而导致小鼠感染[50]。与此相似,幽门螺杆菌和土拉弗菌可通过干扰正常miRNA表达引发宿主感染[17,51]。
此外,共生菌代谢低聚糖产生的短链脂肪酸(如乙酸、丙酸、丁酸等)也可通过调控肠道组织miRNA表达影响肠道屏障稳态。丁酸是重要短链脂肪酸之一,不仅为上皮细胞提供能量,还有抗癌功效[52]。以往研究表明丁酸盐能抑制组蛋白脱羧酶诱导的蛋白乙酰化,增加细胞周期阻滞的关键调控因子p21的转录,从而限制癌细胞增殖[53]。新近研究发现miRNA也参与丁酸盐的抗癌作用,如丁酸能抑制miR-106b表达、促进细胞周期抑制蛋白p21转录、减少肿瘤细胞增殖[54]。另一研究发现丁酸钠通过上调HT-29细胞和Caco-2细胞中miR-203表达来诱导细胞凋亡,进一步研究发现,miR-203还可靶向肿瘤细胞转移相关蛋白NEDD9的3’端非翻译区,下调NEDD9表达,抑制癌症恶化[55]。Nielsen等也发现给大鼠喂食抗性淀粉(低聚糖)后,促癌基因miR-17的表达减少,粪便中的丁酸盐含量增加[56]。上述证据提示,肠道菌群种类及其代谢产物可通过影响miRNA表达来调节宿主肠道屏障功能。事实上,益生菌作为肠道微生物中的一部分,其对肠道屏障的调节作用也是通过介导miRNA表达实现的(表1)。
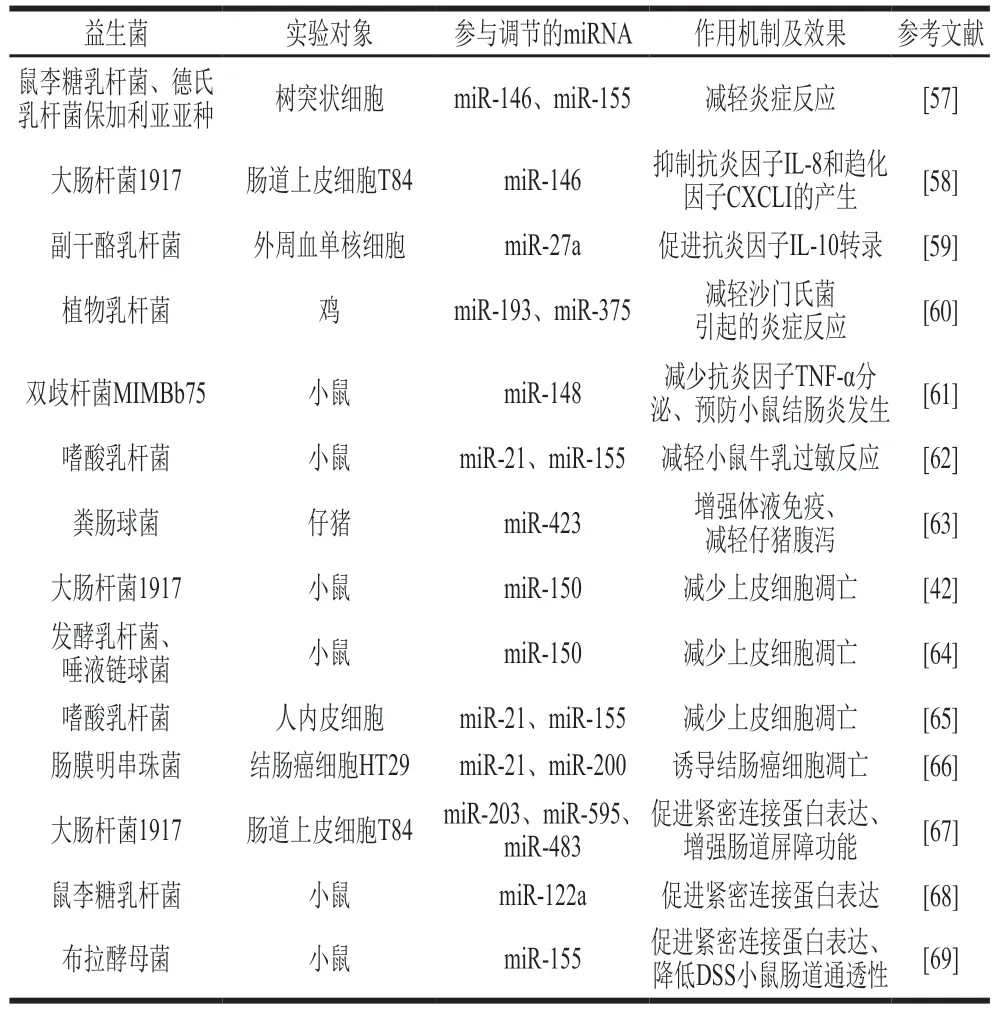
表1 益生菌调节miRNA保护肠道屏障Table 1 Probiotics regulate miRNA expression to protect intestinal barrier
3.2 miRNA参与益生菌调节肠道免疫屏障
肠道依赖于天然免疫和适应性免疫来实现免疫调节作用。天然免疫是通过抗原呈递细胞识别病原体并呈递给T细胞来启动获得性免疫应答,同时通过合成炎性因子和抗炎因子引发免疫反应[70]。特异性免疫分为细胞免疫和体液免疫。其中体液免疫是以Ig起主要作用的免疫应答反应[71]。益生菌对肠道天然免疫和适应性免疫均可产生有益影响。
3.2.1 miRNA参与调节TLR4信号通路
宿主肠道上皮细胞、树突状细胞和巨噬细胞等抗原呈递细胞上存在的一系列模式识别受体(pattern recognition receptors,PRRs),可识别分布于致病菌表面的致病相关分子模式。Toll样受体4(Toll-like receptor 4,TLR4)是一种重要的PRRs。当TLR4的胞外区域与刺激物结合后,其胞内区与髓样分化因子88(myeloid differentiation factor 88,MyD88)结合,从而使IL-1受体相关激酶1(IL-1 receptor-associated kinase 1,IRAK1)磷酸化,进而结合TNF受体相关因子6(TNF receptor associated factor 6,TRAF6),导致转化生长因子激酶1(transforming growth factor kinase 1,TAK-1)及TAK-1结合蛋白(TAK binding proteins,TAB)募集并形成复合物,并启动下游信号通路:1)TRAF6通过磷酸化激活MAPK,继而活化P38 MAPK信号通路;2)TAK-1诱导核转录因子抑制因子(inhibitor of nuclear factor kappa B,IκB)蛋白抑制剂磷酸化,使IκB与NF-κB复合物解离,导致NF-κB向细胞核移位,激活NF-κB信号通路[72]。上述信号转导过程被称为TLR4/p38 MAPK/NF-κB信号通路,该通路是机体发挥先天免疫作用的重要途径,过度活跃的TLR4/p38 MAPK/NF-κB信号通路将常导致炎性因子大量产生,进而诱发炎症反应[73-74]。
炎症反应激活TLR4/p38 MAPK/NF-κB信号通路,同时诱导特异性miRNA表达;而上调的miRNA可通过靶向沉默TLR4/MyD88下游关键蛋白,如IRAKl和TRAF6表达,减弱NF-κB信号活化,抑制IL-6、TNF-α等炎症因子产生[74-75]。如Zhang Quanbo等发现miR-146a缺失使得痛风关节炎模型小鼠的TRAF6、IRAK1上调,并增加IL-1、TNF-α水平[76]。此外,miR-146、miR-155、miR-21、miR-9、miR-148、miR-27a也可靶向作用于TLR4/p38 MAPK/NF-κB信号通路,参与免疫调节反应(表2)。上述成果提示,miRNA仿佛强大的“刹车片”,协同其靶基因参与负向调节TLR4信号通路中的关键分子,从而可能成为缓解和终止炎症反应的治疗靶点。

表2 参与调节TLR4/p38 MAPK/NF-κB信号通路的miRNATable 2 MiRNA involved in TLR4/p38 MAPK/NF-κB signaling pathway
近年来,研究者对益生菌免疫调节机制的解析已深入至分子水平,有关miRNA参与益生菌调控肠道屏障和肠道稳态的作用被不断揭示。多数研究认为,益生菌可通过调控miRNA表达来影响TLR4/p38 MAPK/NF-κB信号通路,抑制促炎因子(TNF-α、IL-8、IL-6)合成,促进抗炎因子IL-10分泌,从而增强肠道免疫屏障功能(图1)。如G i a h i 等报道,热灭活的鼠李糖乳杆菌G G、德氏乳杆菌保加利亚亚种分别与脂多糖(lipopolysaccharide,LPS)处理的树突状细胞共培养时,均可抑制TLR4 mRNA表达,其中鼠李糖乳杆菌GG可影响miR-146表达并抑制NF-κB信号通路,德氏乳杆菌保加利亚亚种可通过调控miR-155表达抑制p38 MAPK信号通路,从而缓解炎症反应[57]。Sabharwal等也观察到大肠杆菌Nissle 1917与肠上皮细胞T84共培养时可调节miR-146表达,并抑制炎性因子IL-8和趋化因子CXCLI的产生[58]。Chen Qiaoling等研究发现,经植物乳杆菌ZO-1喂养后,沙门氏菌感染的鸡肠道内miR-193、miR-375表达发生变化,这两个miRNA的靶基因可靶向NF-κB信号通路的关键分子,进而降低炎性因子TNF-α分泌,减轻感染症状[60]。与此类似,热致死副干酪乳杆菌NCC2461与外周血单核细胞共培养可抑制miR-27a表达,上调抗炎因子IL-10水平[59]。值得注意的是,Taibi等提出益生菌调节miRNA表达具有时间依赖性[61],如双歧杆菌MIMBb75干预结肠炎小鼠的实验中发现,表达的miR-148可通过靶向TLR4/p38 MAPK/NF-κB信号通路减少内皮PAS1蛋白基因表达及TNF-α的合成。并且,miR-148表达在益生菌干预宿主2~13 d内显著上调,14 d后miR-148的表达水平不再变化。但这种调节作用的具体机制有待进一步阐释。
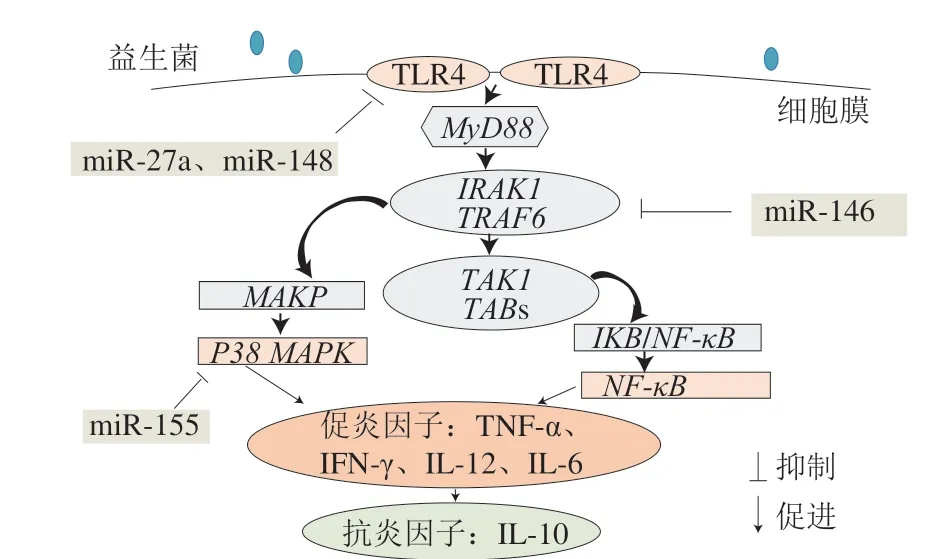
图1 益生菌调节miRNA表达影响TLR4/p38 MAPK/NF-κB信号通路[73]Fig. 1 Regulation of miRNA expression by probiotics affects TLR4/p38 MAPK/NF-κB signaling pathway[73]
3.2.2 miRNA参与调节Ig分泌
Ig能特异性识别并结合外来分子,阻断有害物质入侵,在体液免疫过程中发挥着主要作用。Ig由Ig重链(Ig heavy chain,IGH)和Ig轻链(Ig light chain,IGL)构成,根据恒定区的不同,IGH可分为IgG、IgA、IgM、IgD和IgE等5 类,而IGL有κ链和λ链等2 种类型[82]。新近研究显示,miRNA可参与特异性免疫反应影响Ig分泌。如Chen Zhe等报道在变应性鼻炎小鼠体内低表达的miR-466a-3p可靶向转录因子GATA结合蛋白3从而抑制Th2细胞转录影响IgE分泌[83]。Fang Lei等发现过敏性哮喘患者体内IgE含量与miRNA-21-5p表达水平呈正相关,进一步研究发现miRNA-21-5p通过下调磷酸酶表达水平及张力蛋白同源物PTEN转录,刺激气道平滑肌细胞重塑,造成病情加重[84]。Younger等研究表明高表达的miR-423可以降低Ig超家族成员1的水平,影响免疫细胞间的相互作用[85]。有关益生菌调节miRNA与体液免疫的作用机制仍然不清楚,但已有研究者从分子水平探索,并且取得了一定进展。如Kreuzer-Redmer等发现,给断奶后给仔猪喂食富含粪肠球菌NCIM 10415的食物后,可上调仔猪肠道内miRNA-423表达,抑制IGL合成增强体液免疫,从而减轻断奶造成的腹泻[63]。本课题组前期研究也发现,乳球蛋白过敏小鼠灌胃嗜酸乳杆菌后,肠道miR-155、miR-21表达量下降,同时抑制了特异性IgE和炎性因子IL-6、TNF-α分泌,牛乳过敏症状得到缓解[62]。
3.3 miRNA参与益生菌调节肠道机械屏障
机械屏障主要由单层柱状上皮细胞及细胞间连接复合物构成,柱状上皮细胞使肠腔与固有层分离,在对抗毒素和肠道病原体方面发挥积极的作用。细胞间连接复合物将上皮细胞紧密结合在一起,包括紧密连接、黏着连接、桥粒和缝隙连接[86]。以下就益生菌通过介导miRNA表达调控肠道上皮细胞凋亡和紧密连接蛋白两个方面论述益生菌对肠道机械屏障的保护作用。
3.3.1 miRNA参与调控上皮细胞凋亡
上皮细胞的增殖、分化和凋亡之间保持着良好的平衡,是一个不断自我替代的细胞屏障,保护自身不受病原体侵袭。当大量病原菌在机体肠道内增殖时,不仅引发肠上皮细胞的异常凋亡并造成严重肠道屏障损伤,还会加速病原菌进入肠组织引发炎症、导致癌变,可见控制肠上皮细胞的凋亡对维持肠道屏障的稳态和功能至关重要。目前研究人员普遍认为,线粒体途径是主要的细胞凋亡调控通路,B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)家族蛋白是典型的线粒体途径凋亡调控基因,由抑制凋亡的Bcl-2、Bcl-xl基因和促进凋亡的Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)两大类组成。线粒体在接受到凋亡信号后,刺激Bax转录,释放细胞色素c,募集下游含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)9基因,进而活化Caspase3,导致凋亡信号转导途径放大最终诱导细胞凋亡[87]。
miRNA作为一种转录后调控因子,可通过调控凋亡基因表达影响上皮细胞凋亡。如Bian Zhen[88]和Ramsay[89]等发现,在小鼠DSS结肠炎模型中高表达的miR-150可以靶向上调转录因子基因c-Myb(Bcl-xl、Bcl-2的前导因子)合成,进而促进细胞凋亡。XU Haixiang等在探究miR-21参与葛根素对心肌损伤(低氧再灌注导致)的修复机制时发现,上调miR-21表达,可下调Bax和Caspase3转录水平,从而减少心肌细胞死亡,改善心肌缺血损伤[90]。此外,某些miRNA能促进细胞进入增殖期抑制细胞凋亡,如Chen等研究表明miR-200b过表达能够增加细胞周期蛋白D1表达,促进细胞进入增殖期,诱导肠上皮细胞增殖[91]。
新的研究发现益生菌可通过介导miRNA表达,抑制c-Myb、Bax、Caspase3转录,诱导Bcl-2合成,从而发挥调控细胞凋亡的作用(图2)。如Rodriguez-Nogales等研究发现大肠杆菌Nissle 1917通过低表达miR-150,下调c-Myb转录水平,抑制结肠上皮细胞凋亡,改善DSS小鼠炎症[42]。Zununi等研究发现肠膜明串珠菌可下调miR-21、miR-200和Bcl-xl表达,增加Caspase3含量,并诱导结肠癌细胞HT29凋亡[66]。值得注意的是,益生菌影响miRNA表达具有菌株特异性。如研究人员在比较发酵乳杆菌和唾液链球菌对DSS小鼠治疗差异时,发现只有发酵乳杆菌具有影响miR-150表达、减少DSS小鼠肠道上皮细胞凋亡的能力[64]。Kalani等报道,LPS诱导的内皮细胞炎症,经嗜酸乳杆菌处理后,细胞内miR-21合成增加,而细胞凋亡减少[65]。以上结果提示益生菌调控细胞凋亡的机制可能是通过调节miRNA表达实现的。

图2 益生菌调节miRNA表达抑制肠上皮细胞凋亡[87]Fig. 2 Probiotics regulate miRNA expression and inhibit apoptosis of intestinal epithelial cells[87]
3.3.2 miRNA参与调控紧密连接蛋白
miRNA已被证实能够调节紧密连接蛋白的表达进而影响肠道机械屏障。Ye Dongmei[92]和Zhang Bin[93]等报道,在肠道上皮细胞中,过表达的miR-122与Occludin mRNA的3’端非翻译区结合,诱导其降解,损害肠道屏障功能导致肠通透性增加,进一步研究发现miR-122通过降低上皮生长因子受体转录来下调Occludin表达水平。Caballero-Garrido等发现大脑动脉闭塞小鼠经注射miR-155抑制剂后,其靶蛋白Rheb被上调,ZO-1的表达增加,血流梗死区域和微血管紧密连接的完整性得到改善[94]。极性蛋白复合体(polarity protein complex,PAR)由PAR-3、PAR-6与非典型蛋白激酶C(atypical protein kinase C,aPKC)等组成,该极性蛋白复合体与紧密连接蛋白的形成和功能维持密切相关。近年来的研究发现,miRNA可通过靶向PAR进而调节紧密连接蛋白表达。如Krissansen等发现IBD患者体内高表达的miR-595通过靶向抑制神经细胞黏附分子1和成纤维细胞生长因子受体2的表达,减少PAR-6合成,造成紧密连接成分缺失,提示miR-595可破坏上皮细胞间紧密连接蛋白完整性,加重IBD症状[95]。
研究表明益生菌可通过调节miRNA,促进紧密连接蛋白表达,保护肠道屏障完整性(图3)。Veltman等报道大肠杆菌Nissle 1917与上皮细胞T84共培养时,可上调miR-203、miR-595、miR-483表达,这些miRNA分别靶向紧密连接蛋白ZO-2、PAR复合体PAR-3、PAR复合体PAR-6,从而促进紧密连接蛋白生成[67]。Zhao Haiyang等发现鼠李糖乳杆菌可上调酒精暴露下小鼠肝脏和Caco-2细胞中的miR-122a,促进Occludin表达[68]。Rodriguez-Nogales等研究表明布拉酵母菌可上调miR-155表达,促进Claudin和ZO-1合成,改善DSS小鼠肠道通透性[69]。以上结果提示益生菌可能通过调节miRNA表达维护肠道上皮屏障功能。
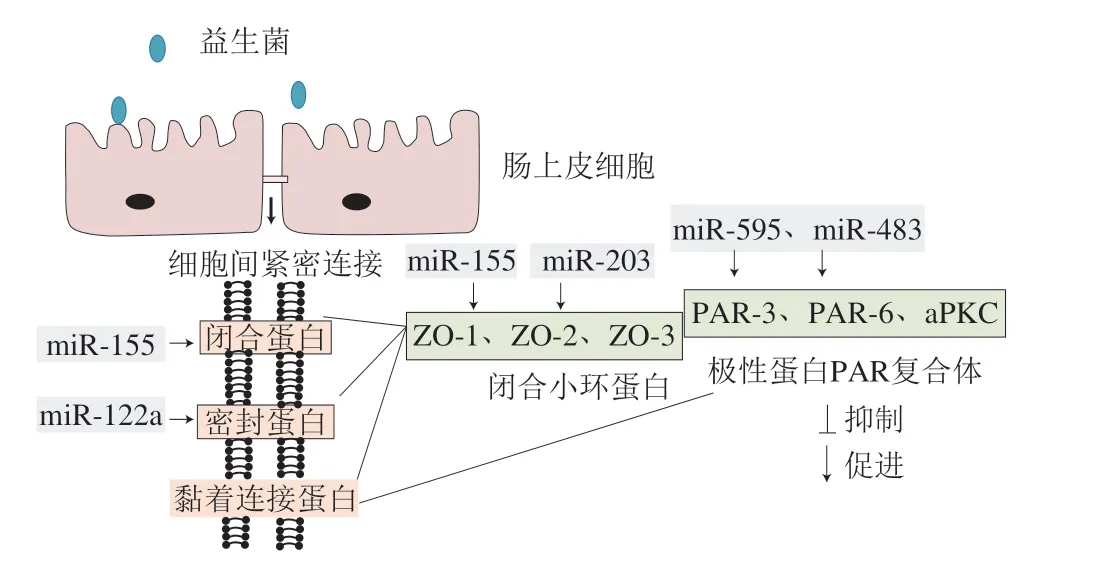
图3 益生菌影响miRNA表达促进紧密连接蛋白转录[67]Fig. 3 Probiotics regulate miRNA expression and promote tight junction protein transcription[67]
4 结 语
肠道屏障是机体抵抗外界有害物质的重要防线之一,屏障功能受损将严重影响宿主肠道健康,并诱发各种肠道疾病。益生菌能够保护肠道屏障的结构和功能,目前,在分子水平解析益生菌对肠道屏障的调节作用,是了解益生菌对肠道益生机制的新途径。miRNA是一类非编码RNA,在肠道组织中表达丰富,可通过与mRNA靶标结合发挥抑制靶基因表达的功能。近年来国内外越来越多的研究发现益生菌可通过影响miRNA表达进而调节肠道免疫,减少肠道上皮细胞凋亡,调节紧密连接蛋白表达保护肠道屏障。但miRNA受益生菌调控的机制、特定功能的miRNA对应具体哪个或哪些菌株,这些问题还需要进一步的深入研究和探讨。研究益生菌调控miRNA的分子机制,加深益生菌促进健康作用的认识,将会为保护肠道健康及预防各种肠道疾病提供新的策略。

