Urocortin对吗啡成瘾大鼠伏隔核中DA能神经电活动影响及机制研究
裴 苗,刘新宇,杨 帆,刘春娜
(1. 锦州医科大学药理学教研室,辽宁 锦州 121001;2. 抚顺中心医院药剂科,辽宁 抚顺 116000)
吗啡等阿片类药物依赖成瘾(drug dependence- addiction,DDA)在现今社会中常见,其吸食率和复吸率逐年上升,并呈现年轻化趋势。强化和奖赏是DDA产生的基本机制[1-2]。阿片类药物的成瘾过程中,NAc起到关键的作用[3]。NAc接受来自多个中脑神经核团的神经投射纤维,如DA能和GLU能,DA和其他的神经递质一同构成脑内的奖赏系统(rewards system,RWS),阿片类药物直接或间接地刺激RWS,使神经元异常高频放电[4]。高成瘾性药品能引起NAc的DA浓度的大量增加。编码RWS的功能信号是NAc的DA能神经元成簇放电导致DA能神经突触末梢DA释放量瞬时大量增加,诱导成瘾的发生。然而,诱发DA能神经元产生簇放电的机制尚不清楚[5]。UCN对DDA有治疗作用,UCN通过与CRF-R2受体结合参与酒精成瘾和戒断后焦虑与觅药等行为的应激性反应,并发挥其脱瘾作用[6-7]。本实验室已证实:UCN与CRF-2R结合后可明显抑制吗啡成瘾大鼠VTA内神经元的簇状放电,减少爆发放电,并且影响下游蛋白激酶A,引发UCN抑制VTA内DA神经元的异常高频放电,在吗啡类药物成瘾中发挥抑制效应。UCN对NAc内DA如何影响尚不清楚,对吗啡依赖大鼠的行为、学习记忆等变化尚未揭示。因此,本实验旨在探讨UCN对吗啡成瘾大鼠NAc中DA能神经电活动影响与相关机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 Sprague-Dawley(SD)大鼠,80只,雌、雄各半,体质量(180~220) g,由锦州医科大学实验动物中心提供,动物使用许可证号:SCXK(辽)2014-0010。
1.1.2Urocortin2(UCN)、Astressin-2B(CRF-2R受体阻断剂) 均购自美国Sigma公司;盐酸吗啡及盐酸纳洛酮由东北制药集团沈阳第一制药厂提供;东北制药集团沈阳第一制药厂。多管微电极拉制仪及大鼠脑立体定位仪:由美国Stoelting公司提供;DAM-80微电极放大器,美国WPI公司提供;Morris 水迷宫装置由中国科学院药物研究所研制;6400-A微电泳仪,由美国Dagan有限公司提供。
1.2 实验方法
1.2.1分组与造模 NG:每日腹腔注射等体积的生理盐水1 mL·kg-1,12 d;MCG:序贯给药方法(Tab 1),吗啡给药体积为1 mL·kg-1,12 d;UCN-L:序贯给药吗啡,1 mL·kg-1,12 d,d 6~12,尾静脉注射Urocortin2溶液1 mg·kg-1;UCN-H:序贯给予吗啡,1 mL·kg-1,12 d。给药的d 6~12,尾静脉注射Urocortin-2溶液10 mg·kg-1。给予盐酸吗啡溶液12 d,成功建立大鼠吗啡成瘾模型60只。在d 12,阿片受体阻断剂——纳洛酮溶液(5 mg·kg-1)诱导吗啡成瘾大鼠模型出现,吗啡成瘾大鼠均出现典型戒断综合症。
1.2.2Koob躯体戒断症状评分 对吗啡成瘾大鼠的戒断综合症状按照表2内所述的标准进行测定,大鼠的综合症状评分≥15分,确定为吗啡成瘾大鼠造模成功。
1.2.3Morris水迷宫行为学实验 每只受试动物给予不同处理因素后d 9~11,每天按照4个象限各训练 1次,连续训练 3 d,记录各受试实验吗啡成瘾模型大鼠寻找平台并爬上平台所需要的时间(逃避潜伏期,s),如未找到平台,将受试大鼠放在该平台上,令其学习记忆15 s。在给予吗啡造模的12 d,即本项Morris水迷宫实验的d 4,进行空间探索实验,撤除平台,将受试的各组大鼠放入水中,记录大鼠在 60 s内的游泳轨迹和游泳路线,计算大鼠在原平台象限游泳时间/总游泳时间×100%,计算各组受试的实验动物60 s内的游泳路程。
1.2.4电生理微电泳实验 各组另取10只大鼠进行电生理实验。采用20 %乌拉坦(1 g· kg-1)进行全麻,根据《Paxions and Watson 大鼠脑图谱》,确定NAc神经核团的位置。多管玻璃微电极微电泳受试药物:urocortin-2(10-6mol·L-1);astressin 2B(AST-2B,CRF-2的特异性受体阻断剂,10-6mol·L-1);DA(10-4mol·L-1)及其非选择性阻断剂—α-flupenthixol(FLU,10-5mol·L-1)。细胞外记录NAc神经元自发放电情况,包括NAc神经元放电形式、放电分布、频率及特征等。
1.2.5TH含量测定 采用 ELISA 法定量测定大鼠脑组织中DA能神经元特异性标记物TH含量,记录各组脑组织在475 nm吸光度(OD)的值,对TH进行半定量测定,酶标仪检测,用GU表示。
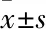
2 结果
2.1 吗啡成瘾动物的Koobs躯体戒断症状评分结果本实验制备成功吗啡成瘾大鼠模型30只,均出现典型WDS症状。与MCG组(18.88±1.25)比较,UCN-L(17.13±1.25,P<0.05)及UCN-H(16.88±0.99,P<0.01),差异具有统计学意义。
2.2 Morris 水迷宫行为学实验结果MCG组大鼠的总游泳时间较NG组延长,差异具有统计学意义(P<0.05),UCN-L和UCN-H组大鼠在原平台象限游泳时间占总游泳时间的百分比较MCG组增加(P<0.05)。典型游泳轨迹结果见Fig 1。

Tab 1 Morphine administration of sequential incremental method
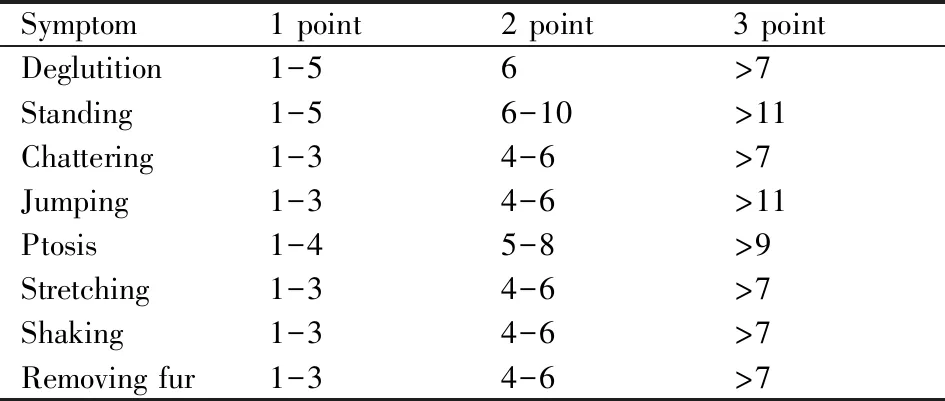
Tab 2 Withdrawal symptoms of scoring criteria
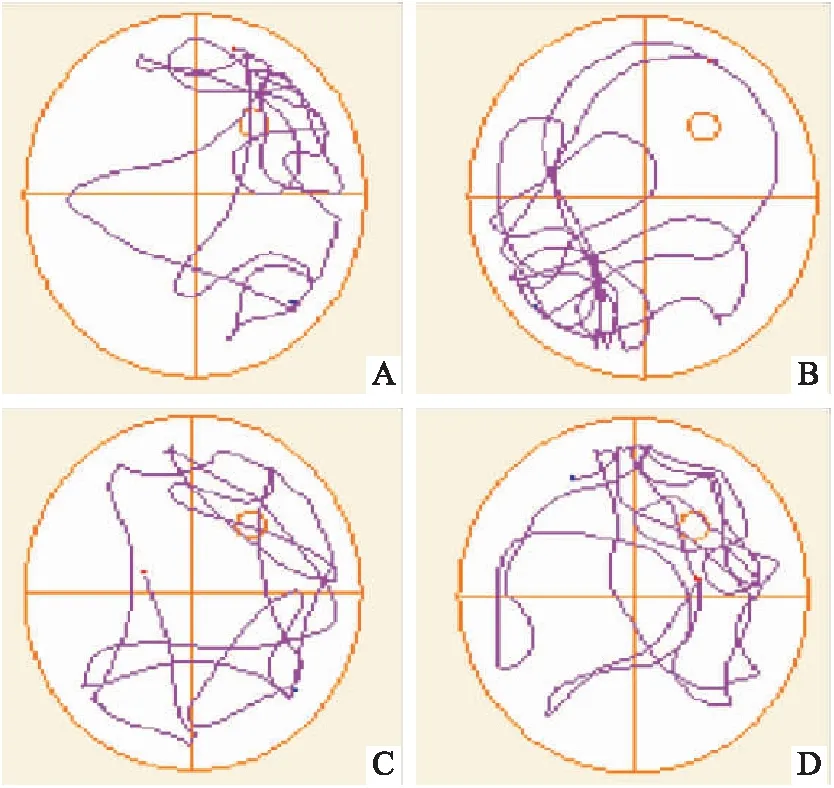
Fig 1 Typical swim-tacking path in each group
2.3 电生理微电泳实验结果
2.3.1吗啡成瘾大鼠NAc神经元自发放电情况 与NG组相比,MCG、UCN-L和UCN-H组神经元自发放电频率增加,差异具有统计学意义(P<0.01)。与MCG组相比,UCN-L和UCN-H两组的放电频率降低,具有统计学差异(P<0.05)(Tab 3)。
2.3.2UCN对吗啡成瘾大鼠NAc神经元中DA神经元放电情况 微电泳DA(10-4mol·L-1,20 nA,20 s)使吗啡成瘾大鼠的NAc神经元的自发放电频率明显加快(P<0.01);微电泳UCN2(10-6mol·L-1,20 nA,20 s)使被DA兴奋的NAc神经元的自发放电频率明显下降,与给予UCN之前比较,放电频率下降,具有统计学差异(P<0.01)。给与DA能神经元微电泳α-flupenthixol(FLU, 10-5mol·L-1),可使之前兴奋的吗啡成瘾的NAc神经元中的DA神经元的自发放电频率下降,DA受体被FLU阻断后,再次微电泳UCN2,UCN2的抑制略有所下降,但与给予FLU前比较,差异无统计学意义(P>0.05),具体实验结果见图Fig 2。
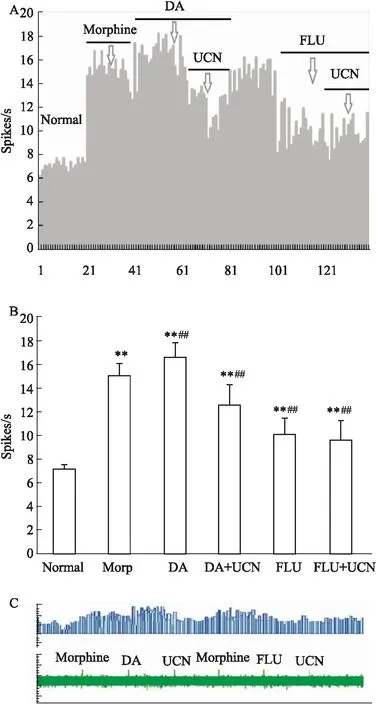
Fig 2 Effect of UCN and DA on NAc neuronsof morphine model rats
2.4 TH含量测定与NG组相比,MCG组、UCN-L和UCN-H组大鼠脑组织匀浆中TH的水平明显升高,差异具有统计学意义(P<0.05)。MCG组与UCN-L和UCN-H组比较,TH的水平降低,差异具有统计学意义(P<0.05)(Fig 3)。
3 讨论
本实验中给予UCN的两组,虽也出现较典型的WDS戒断症状,但与MCG组比较明显降低,提示UCN具有减缓戒断症状的作用,对吗啡成瘾、甚至阿片类药物成瘾和依赖有缓解和改善作用。在DA基因缺失小鼠的位置偏爱实验中,小鼠出现活动减少,此结果提示DA是参与吗啡依赖成瘾的主要神经递质,DA受体是产生精神依赖的重要受体[8]。本实验发现UCN可通过CRF-R2受体,影响DA,抑制吗啡成瘾及戒断后焦虑等行为的应激性反应。

Tab 3 The spontaneous discharge of NAc neurons in each group

Fig 3 Level of TH in each group
UCN增加吗啡成瘾大鼠的Morris水迷宫的空间探索能力,提示UCN能增强吗啡成瘾大鼠的学习和记忆能力。在给不限制活动的大鼠脑室内微量注射UCN后,大鼠的自发性活动减少,表明UCN具有镇静及抗焦虑作用[9]。小鼠敲除UCN后,焦虑行为增强,特别是CRF-2R敲除小鼠对应激反应超敏,进一步提示UCN参与焦虑等精神行为反应性疾病。
电生理实验结果发现,UCN能降低吗啡成瘾大鼠NAc 神经元自发放电。本实验前期研究已证实,UCN 对VTA神经元放电有抑制作用,抑制成簇及爆发式放电,并对DA等神经递质(如Glu、GABA)释放产生交互影响作用,VTA 和NAc在阿片类药物的成瘾中起重要作用,是成瘾及奖赏效应产生的主要神经解剖学部位,从VTA 到NAc 的DA 能投射,更是介导药物奖赏及强化的重要神经投射[10-12]。本研究发现,UCN 对NAc 中的DA 神经元有抑制作用,提示从VTA投射来的DA兴奋性神经递质受阻,另外DA 受体阻断剂FLU,使兴奋的NAc 神经元的放电频率下降,提示UCN 对吗啡成瘾大鼠的NAc 神经元的抑制效应通过影响DA受体而产生,并进一步证明UCN 与DA 能在NAc中有汇聚交互作用。NAc 在大脑的奖赏、成瘾、恐惧及安慰效果等活动中起主导作用,当抑制信号减弱或神经核团的激活信号增加时均会导致NAc 的DA 神经元异常兴奋,诱发神经元过度爆发式放电,产生药物依赖[13-14]。
本实验发现,吗啡成瘾大鼠脑组织中TH的水平升高,UCN能降低TH的水平。TH是负责催化L-酪氨酸转变为二羟基苯丙氨酸的酶[15-16]。TH水平升高,引起脑内DA量增多,可能是造成吗啡成瘾和药物依赖的重要原因。UCN通过降低TH的水平,减少脑内DA的过度生成,可能是UCN抑制NAc的DA神经元异常兴奋的主要原因。
本研究证明UCN对NAc内DA 含量变化与行为学改善的相关性,以及UCN抑制吗啡成瘾中NAc的DA神经元的异常兴奋,并在学习记忆功能中发挥改善作用,证明NAc中的DA是吗啡成瘾的关键环节,其异常兴奋是多个神经递质作用整合结果。本项研究结果有助于阐明药物成瘾机制,并为临床防治吗啡成瘾提供新的思路。
——吗啡