GDF11在结肠癌中的表达和作用研究
张永慧,瞿 艳,牟金阿哥,张昊洋,刘 丹,付 菲,刘 奉
( 1. 重庆三峡医药高等专科学校基础医学部药理学教研室;2. 重庆市抗肿瘤天然药物工程技术研究中心;3. 重庆三峡医药高等专科学校药学院,重庆 404020)
结直肠癌(colorectal cancer)是世界最常见的恶性肿瘤之一,发病率和死亡率均居所有癌症的第三位[1]。随着科学的发展,虽然涌现许多新的结直肠癌治疗方式及药物,但手术和术后化疗仍是目前治疗结直肠癌的主要手段,然而结直肠癌手术治疗效果不够理想、术后复发率高且常伴有急性肠梗阻,而化学药物治疗过程中常出现耐药性等问题,这些问题为结直肠癌的治疗带来很大的难度,深入探究结直肠癌的发病机制及增加对结直肠癌的预防和预后监测势在必行。肿瘤标志物是肿瘤细胞本身存在或分泌的特异性物质, 在肿瘤的预防、诊断和治疗中均发挥重要作用。现阶段肿瘤标志物监测诊断某一种恶性肿瘤的准确率不是很高,特异性也会受到一定的限制。因此,找到针对某种肿瘤的特异性和灵敏度均很高的肿瘤标志物具有重要的临床应用价值。
生长分化因子11(growth differentiation factor,GDF11)是转化生长因子超家族的一员,参与胚胎发育、红细胞生成、衰老和心血管疾病等生理病理过程[2-5]。以往研究显示,GDF11参与肝癌、乳腺癌、口腔癌等癌症的发生发展,仅有一篇临床研究证明GDF11参与结直肠癌病理过程,与结直肠癌预后具有相关性[6-10]。而对于我国结直肠癌患者组织GDF11表达水平及GDF11与患者预后相关性研究仍处于空白阶段。本研究采用Oncomine数据库、结肠癌cDNA芯片和组织芯片利用qPCR技术检测正常癌旁组织与结肠癌患者组织GDF11表达水平的变化。体外培养HCT116和SW480结肠癌细胞,分为3组:正常对照组(C)、GDF11低剂量组(50 μg·L-1)、GDF11高剂量组(100 μg·L-1),利用CCK-8法检测GDF11对结肠癌细胞活力的影响,流式细胞术检测GDF11对结肠癌细胞周期的影响,Transwell实验检测GDF11对结肠癌细胞迁移的影响,Western blot技术检测GDF11、p-smad3、p-smad2、smad2/3、p-p38、p38、p-JNK、JNK、p-ERK、ERK、Vimentin、E-cadherin、N-cadherin、fibronectin、ZEB1、SNAIL、TWIST1、p21表达水平,探讨GDF11在结肠癌组织中表达差异和GDF11对结肠癌细胞活力、迁移的影响及机制。
1 材料
1.1 细胞株与分组SW480和HCT116结肠癌细胞株,购自上海中乔新舟生物科技有限公司。细胞培养达80%~90%融合后,将细胞随机分为3组:正常对照组(C)、GDF11低剂量组(50 μg·L-1)、GDF11高剂量组(100 μg·L-1)。
1.2 药物与试剂cDNA芯片购自上海芯超生物,批号:cDNA-HColA030CS01;组织芯片购自上海芯超生物,批号:HColA030PG02;SYBR®Premix Ex TaqTMⅡ(TaKaRa,批号:RR820Q);重组人/大鼠/小鼠源GDF11(PeproTech,批号:120-11);CCK-8(Dojindo,批号:CK04);Transwell小室(Corning,批号:3422);细胞周期检测试剂盒(凯基生物,批号:KGA512);L-15 基础培养基(上海中乔新舟生物科技有限公司,批号:ZQ-1100);胎牛血清(Quacell biotechnology,批号:B21001);Smad2/3 Antibody Sampler Kit(CST公司,批号:12747);GDF11抗体(Abcam公司,批号:ab71347);p-p38(CST公司,批号:4511);p38(Santa Cruz公司,批号:sc-81621);p-ERK1/2(CST公司,批号:4370);ERK(Santa Cruz公司,批号:sc-514302);p-JNK(CST公司,批号:9255);JNK(Santa Cruz公司,批号:sc-7345); p21(CST公司,批号:2947T);E-cadherin(CST公司,14472);Vimentin(CST公司,5741T);N-cadherin(CST公司,批号:13116);fibronectin(Santa Cruz公司,批号:sc-8422);ZEB1(Santa Cruz公司,批号:sc-515797);SNAIL(Santa Cruz公司,批号:sc-271977);TWIST1(Santa Cruz公司,批号:sc-81417);ECL化学发光检测试剂盒(伯乐公司,批号:1705060)。
1.3 仪器7900HT实时荧光定量PCR仪(美国ABI公司); ChemiDoc Touch化学发光成像系统(美国伯乐公司); ELX800TM酶标仪(美国BioTek公司);DXFlex临床分析型三激光流式细胞仪(美国Beckman Coulter公司)。
2 方法
2.1 Oncomine数据库提取数据设定筛选条件为:① “Cancer Type: Colorectal Cancer”;② “Gene: GDF11”;③ “Analysis Type:Cancer vs. Normal Analysis”;④ “Data Type: mRNA copy number”;⑤ “Sample type: Clinical Specimen”数据记录保存为excel表格。
2.2 qPCR检测cDNA基因芯片GDF11 mRNA水平cDNA芯片是一种通过实时荧光定量的方法来检测目的基因的表达的cDNA阵列,本实验购买的结肠癌cDNA基因芯片包含结肠癌30例,癌/癌旁各1点,通过实时荧光定量PCR,检测目的基因GDF11表达,内参基因为β-actin。GDF11引物序列:Forward 5′-GCCATCAACACCACTCACATT-3′;Reverse 5′-CCAATCCCTACTCTGCCAAG-3′。β-actin引物序列:Forward 5′-GAAGAGCTACGAGCTGCCT GA-3′;Reverse 5′-CAGACAGCACTGTGTTGGCG-3′。
2.3 免疫组化检测结肠癌组织芯片GDF11蛋白质水平组织芯片购买于上海芯超生物科技有限公司,对组织芯片进行免疫组化染色,GDF11蛋白表达定位于细胞质和(或)细胞膜,观察到深褐色或棕黄色颗粒为阳性细胞。
2.4 细胞培养人结肠癌细胞株SW480接种于包含10%血清的L-15培养基,HCT116接种于包含10%血清的DMEM高糖培养基,置于37 ℃,5% CO2饱和湿度的培养箱中培养。
2.5CCK-8法检测细胞活力将HCT116和SW480细胞培养至密度为90%左右,进行细胞计数,按实验分组接种于96孔培养板中,每孔的细胞数为5×103个,每组设6个复孔,接种后置于37 ℃、5% CO2培养箱中分别培养24 h。分别在给药组中加入终浓度为50、100 μg·L-1的GDF11,培养24、48和72 h后,加入10 μL CCK-8溶液,置于37 ℃培养箱中孵育4 h,在酶标仪上测定其在450 nm处OD值,进行数据分析。
2.6 Transwell检测细胞迁移在Transwell上层小室加入200 μL调整好浓度的结肠癌细胞悬液,分为3组:正常对照组(C)、GDF11低剂量组(50 μg·L-1)、GDF11高剂量组(100 μg·L-1),培养24~48 h,用镊子取出Transwell小室进行染色。吸干上清液体,移入预先添加甲醇的孔中,室温固定15 min,再移入添加结晶紫溶液的孔中,染色15 min。将Transwell小室从结晶紫溶液中取出,用去离子水清洗去除结晶紫染料。吸去Transwell小室中残余的水,用棉签擦去Transwell小室上层未穿膜细胞,显微镜下观察Transwell小室下层细胞穿膜的情况,每个小室随机选择5个视野拍摄计数。
2.7 流式细胞术检测细胞周期根据凯基细胞周期试剂盒说明书,收集细胞,用PBS洗涤细胞并制备单细胞悬液离心后,在细胞中加入70%冷乙醇500 μL固定,4 ℃保存;加入提前配制好的500 μL PI/RNaseA染色工作液,室温避光30~60 min;上机检测,记录激发波长488 nm处红色荧光。
2.8 Western blot检测提取总蛋白,进行电泳、转膜、孵育抗体、ECL显色发光,利用 Bio-Rad Image Lab Software软件测定蛋白条带的积分光密度值,目的蛋白包括:GDF11、p-smad2、p-smad3、p-p38、Vimentin、N-cadherin、fibronectin、ZEB1、SNAIL、TWIST1、E-cadherin和p21,β-actin蛋白条带作为内参照。
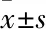
3 结果
3.1 GDF11在人结肠癌组织的表达差异cDNA组织芯片包含30例结肠癌组织,年龄在31~84岁,平均年龄64岁;男性19人,女性11人;AJCC病理分期:1期4人,2期12人,3期12人,4期2人(Tab 1)。Fig 1A结果显示,与正常癌旁组织相比,GDF11在癌症组织高表达(P<0.01),Oncomine数据库结果和组织芯片与此结果一致(Fig 1B,1C)。

Tab 1 Relationship between GDF11 expression and clinicopathological characteristics in tissue microarray of 30 colorectal cancer patients
3.2 GDF11对人结肠癌细胞株smad2/3、AMPK和MAPK信号通路的影响用外源性GDF11处理人结肠癌细胞株HCT116和SW480可以增加细胞内GDF11表达水平(Fig 2A)。GDF11属于转化生长因子β(transforming growth factor β,TGF-β)超家族的一员,与其他TGF-β成员类似,smad信号通路为其经典信号通路。本实验用GDF11处理细胞后,可以增加p-smad2,p-smad3表达水平,暗示GDF11可能通过激活smad2/3信号通路发挥其生理功能(Fig 2B)。同时,我们检测了GDF11对人结肠癌细胞株p-AMPK、AMPK、p-p38、p38、p-JNK、JNK、p-ERK、ERK蛋白质表达的影响,结果显示,GDF11可明显激活p-p38表达水平(Fig 2C~2F)。
3.3 GDF11对人结肠癌细胞株细胞活力的影响用不同浓度GDF11(50 μg·L-1和100 μg·L-1)处理人结肠癌细胞株后,Fig 3结果显示,GDF11作用48、72 h后,与对照组相比,GDF11处理组细胞活力明显增加(P<0.01)。
Fig 1 Cancer tissues had significantly higher GDF11 mRNA and protein expression than normal tissues
3.4 GDF11对人结肠癌细胞株细胞迁移及EMT相关蛋白的影响Fig 4A结果显示,GDF11处理后可促进人结肠癌细胞株纵向迁移(P<0.01)。GDF1处理后可增加Vimentin、N-cadherin、fibronectin、ZEB1、SNAIL、TWIST1表达水平、降低E-cadherin表达水平(Fig 4B)。

Fig 2 Effect of GDF11 on GDF11 expression, smad2/3 signals and non-smad signals in human colon cancer cell line HCT116 and SW480
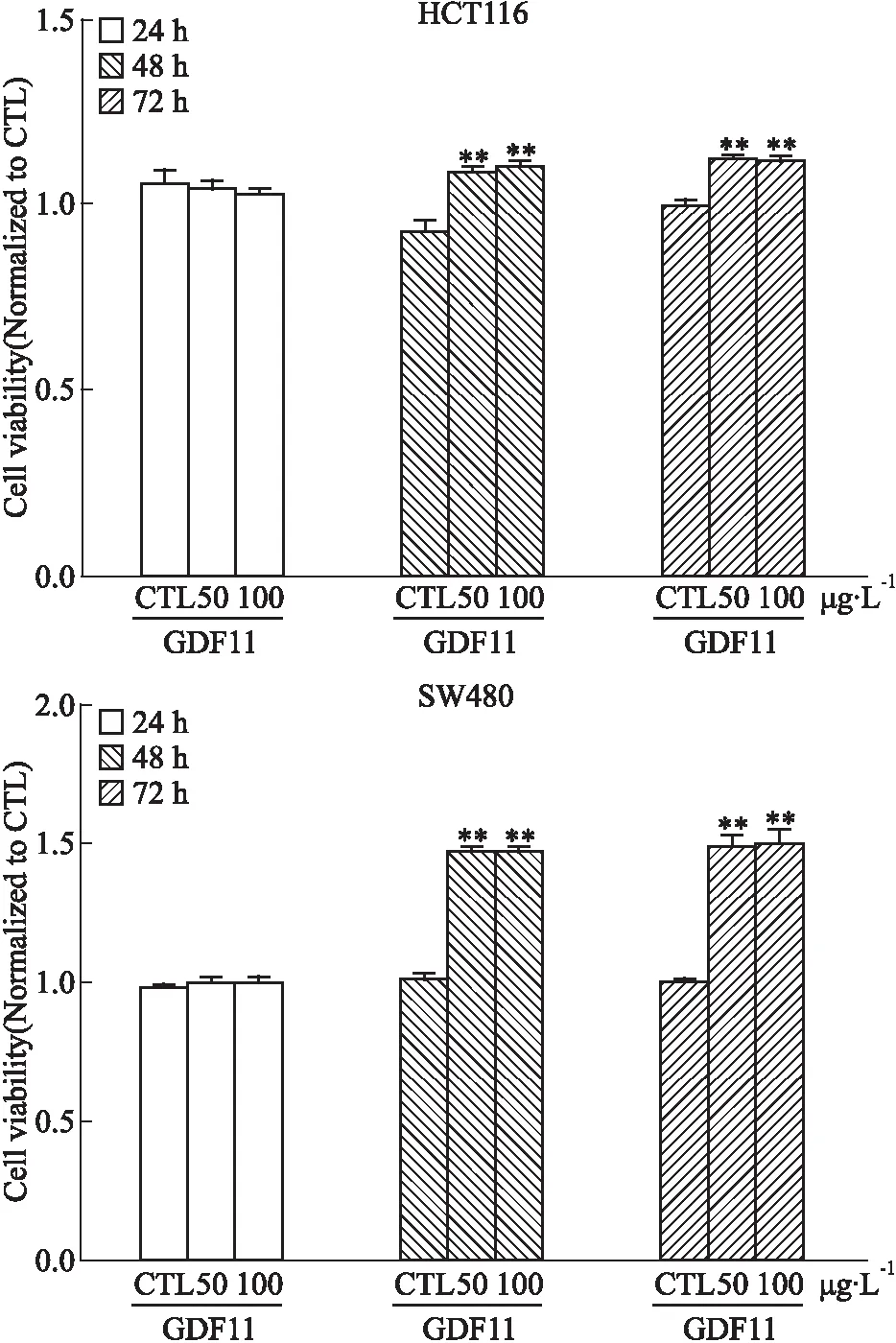
Fig 3 GDF11 increased cell viability of HCT116 and SW480 for long-term
3.5 GDF11对人结肠癌细胞株细胞周期及周期相关蛋白的影响Fig 5A结果显示,GDF11处理可降低G0/G1期,增加G2/M期和S期。GDF11处理可降低p21表达水平(Fig 5B)。
4 讨论
虽然结直肠癌早期诊断和治疗有所改善,但患者5年生存率仍较低。传统的结直肠癌血清标志物包括血清癌胚抗原(CEA)、糖蛋白抗原19-9(CA 19-19),但在诊断时仅使用CEA或CA 19-9缺乏灵敏性和特异性[11]。随着测序技术的飞速发展,涌现出愈来愈多的新型肿瘤标志物,例如循环肿瘤细胞、DNA、RNA、基因甲基化等,但大多数新型肿瘤标志物缺乏大规模临床实验验证。现阶段肿瘤标志物监测诊断某一种恶性肿瘤的准确率不是很高,特异性也会受到一定的限制。因此,找到针对某种肿瘤的特异性和灵敏度均很高的肿瘤标志物具有重要的临床应用价值。
研究证明,GDF11参与结直肠癌病理过程,结直肠癌组织GDF11表达水平增高;具有GDF11高表达的肿瘤患者,淋巴结转移风险更高,肿瘤相关的死亡率增加,患者存活率下降,暗示GDF11可作为结直肠癌预后的指标之一[10]。而对于我国结直肠癌患者组织GDF11表达水平改变及GDF11参与结肠癌发生发展机制仍处于空白阶段。本研究首先探究GDF11 mRNA和蛋白质在结肠癌组织表达水平的改变,结果显示,与正常癌旁组织相比,结肠癌组织GDF11表达水平明显增加;通过查阅Oncomine数据库,进一步验证此结论。我们探究GDF11在体外对人结肠癌细胞株细胞活力、细胞迁移表型的影响。购买人源GDF11细胞因子处理细胞,可明显增加细胞内GDF11表达,证明外源性GDF11处理可使细胞内GDF11高表达,进而探索GDF11高表达水平条件下对人结肠癌细胞株的影响。与TGF-β家族其他成员一样,GDF11首先与细胞膜表面的Ⅱ型受体ActRⅡ(包括ActRⅡA和ActRⅡB)结合,进而募集Ⅰ型受体ActRⅠ(ALK4,ALK5,ALK7)。与相应受体结合后可以激活下游通路,下游通路主要分为两类:即smad和非smad信号通路[3]。已有多篇文章报道GDF11可在不同组织或细胞内通过激活smad2/3信号通路,再与Smad4形成复合物被转运到细胞核内,在胞核内该复合物与特定的DNA位点结合,进而调节靶基因的转录[3,12]。本实验用GDF11处理细胞后,可激活人结肠癌细胞株smad2/3信号通路,暗示其对结肠癌表型的作用可能通过smad2/3信号通路。同时,我们也检测了GDF11对non-smad信号通路的影响,结果显示,GDF11可以明显增加p-p38表达。用不同浓度GDF11(50 和100 μg·L-1)处理人结肠癌细胞株后,可明显增加细胞活力,其机制可能为降低细胞周期相关蛋白p21表达,加速细胞周期过程。同时,GDF11可通过影响EMT相关蛋白表达,促进细胞迁移。

Fig 4 GDF11 promoted cell migration of HCT116 and vs CTL group.

Fig 5 GDF11 promoted cell cycle progress of HCT116 and
综上所述,GDF11在结肠癌组织高表达,并发挥促进结肠癌的发生发展,其可能机制为加速细胞周期过程,促进上皮间质转化。本研究阐明GDF11参与结直肠癌病理过程的机制,为临床通过调控GDF11表达防治结直肠癌的发生发展提供新的理论基础和实验依据。同时,GDF11有望成为新型的结直肠癌预警标志物,对结直肠癌患者早期诊断及抗癌药理机制提供新的靶点。
(致谢: 感谢重庆三峡医药高等专科学校工程中心实验室为本课题研究提供仪器设备和技术支持。)