非洲猪瘟病毒p30蛋白的原核表达及其多克隆抗体制备
黄 剑,徐晶晶,程雪飞,李国新,高 飞,童光志
(1.福建农林大学动物科学学院,福州350002;2.中国农业科学院上海兽医研究所,上海200241)
非洲猪瘟(african swine fever,ASF)是非洲猪瘟病毒(African swine fever virus,ASFV)引起猪的一种出血性高度接触性疫病,最急性和急性病毒感染死亡率高达100%,ASFV是唯一已知的虫媒DNA病毒[1],持续感染的野猪和软蜱是家猪感染ASF的重要传染源[2]。
该病自1921年在非洲的肯尼亚被首次报道后,开始在非洲蔓延,后传入欧洲和南美洲。2007年,格鲁吉亚报道ASF疫情后,迅速扩散到波兰、俄罗斯,至今仍在暴发和流行[3]。2018年8月初,在辽宁某猪场发生我国首例ASF疫情,随后几个月,辽宁省、安徽省、浙江省、上海市、重庆市等全国各省市均报道发生ASF疫情,这无疑给我国带来巨大的经济损失[4]。
ASFV是双链闭合性DNA病毒,是非洲猪瘟病毒科非洲猪瘟病毒属的唯一成员[1,5-6]。ASFV基因组长度为170~190 kb,有150多个开放阅读框(opening reading frame,ORF)[7],编码50多种结构蛋白和100多种非结构蛋白。ASFV病毒粒子由里到外主要由5部分组成:含病毒基因组DNA的拟核、内核芯壳(core shell)、内膜(inner envelope)、衣壳(capsid)和囊膜(external envelope)[8]。其结构主要包含中间约130 kb比较稳定的基因区(stable region),两边是约20~40 kb的由串联重复序列和多基因家族(multigene families,MGF)构成的可变区(variable region),末端是有37 nt部分碱基互补配对的发卡环结构(hairpin loop)[7]。CP204L基因位于中间稳定的基因区,编码的p30蛋白主要有参与病毒内化的功能,在病毒DNA合成开始之前就已经产生并持续表达至病毒生命周期的结束[9],在病毒进入宿主细胞时期具有重要作用,具有良好的抗原性[10]。鉴于此,本研究表达和纯化了具有生物学活性的p30蛋白,为ASFV早期诊断试剂盒的研发、p30蛋白结构功能研究奠定了基础。
1 材料和方法
1.1 细胞、质粒和实验动物pColdI以及Vero细胞由本实验室保存;含有p30序列的质粒pIRES-p30由公司合成;6~8周龄Balb/c小鼠购自上海杰思捷实验动物技术有限公司。
1.2 主要试剂限制性内切酶EcoR I、NheI和XbaI购自NEB公司;BL21(DE3)、胶回收试剂盒和同源重组酶购clonExpress自南京诺唯赞(Vazyme)公司;2×PrimeSTAR® HS DNA Polymerase购自TaKaRa公司;细胞培养液(DMEM)、胎牛血清(FBS)、胰酶和磷酸盐缓冲液(PBS)购自Gibco公司;弗氏完全佐剂、弗氏不完全佐剂和IPTG购自Sigma公司;去内毒素中提质粒试剂盒购自QIAGEN公司;转染试剂Lipofectamine 3000和Goat anti-Mouse IgG conjugated FITC荧光二抗购自上海英潍捷基公司;HRP-conjugated goat Anti-mouse购自Protech公司;SDS-PAGE Gel Kit和超敏ECL化学发光试剂盒购自碧云天生物技术有限公司;PierceTMRIPA Buffer购自Thermo公司。
1.3 引物设计根据中国流行的ASFV毒株(SY18株)p30基因序列(GenBank登录号:MH766894.1),设计1对p30基因的特异性引物,由上海桑尼科技有限公司合成。EcoRI-pColdI-p30-F:5'-accctcgagg gatccgaattcATGGATTTTATTTTAAATATATCCAT GAAA-3';EcoRI-pColdIp30-R:5'-caggtcgacaagc ttgaattcTTAAATGTAGGTGAGAAAAAAGCTTAT TT-3'(其中小写的序列为酶切位点附近的同源臂序列)。
1.4 重组表达载体的构建与鉴定以实验室保存的含有目的片段 p30的pIRES质粒为模板进行PCR扩增,具体反应体系如下:2×GC Buffer 25 μL,4 μL 10 mmol/L dNTP,16.5 μL ddH2O,0.5 μL PrimeStar® HS DNA,分别使用引物EcoRI-pColdI-p30-F/ EcoRI-pColdIp30-R扩增出用于连接的p30片段,反应过程:95℃预变性5min;95℃变性30 s,62℃退火30 s,72℃延伸40 s,35个循环;72℃再延伸10 min。10 g/L琼脂糖凝胶电泳分析扩增产物,回收目的片段。将目的片段与EcoR I单酶切后的pCold I载体连接,将连接产物转化至TOP10感受态细胞;挑取单菌落,进行PCR、酶切鉴定,并送上海桑尼科技有限公司测序,挑选阳性质粒,命名为pColdI-p30。
1.5 p30的诱导表达及纯化将构建好的pColdI-p30质粒转化至BL21(DE3)感受态细胞,挑取单菌落,摇菌,当菌液D值为0.6时,加入终浓度为1 mmol/L的IPTG,16℃条件下诱导16 h,经超声仪破碎裂解细胞后,离心获得上清和沉淀,经SDS-PAGE获取p30的表达情况。将超声裂解获取的沉淀分别经过洗液Ⅰ(2 mol/L尿素、0.1%Triton100、50 mmol/L NaCl、0.2 mmol/L EDTA)和洗液Ⅱ(2 mol/L尿素、0.1%Triton100)清洗离心后,最终使用8 mol/L的尿素(8 mol/L尿素、0.5 mol/L NaCl、20 mmol/L Na2HPO4、20 mmol/L NaH2PO4)[11]溶解纯化后的p30蛋白,然后使用BCA测定法测p30蛋白的浓度。
1.6 多克隆抗体制备免疫10只Balb/c小鼠,每只小鼠皮下免疫100 ng p30蛋白,共免4次,间隔2周,蛋白与佐剂等体积混合均匀,初免使用弗氏完全佐剂,后3免使用弗氏不完全佐剂,3免和4免后4 d采集小鼠血清。
1.7 免疫荧光检测使用pCAGGS-p30和pCAGGS空载分别转染至Vero细胞,24 h后取出细胞,用PBS清洗1遍,每孔加入1 mL冰甲醇,-20℃孵育30 min;再用PBS清洗3遍,每遍5 min,每孔加入1 mL多抗(1∶100稀释),37℃孵育1 h;然后再用PBS清洗3遍,每遍5 min,每孔加入1 mL FITC标记的山羊抗鼠的荧光二抗,37℃孵育1 h;接着再用PBS清洗3遍,每遍5 min。最后置于倒置式荧光显微镜下观察。
1.8 Western blot检测使用pCAGGS-p30和pCAGGS空载分别转染至Vero细胞,24 h后收获细胞,使用PierceTMRIPA Buffer(含蛋白酶抑制剂)细胞裂解液冰上裂解15 min,离心收取上清,加入SDSPAGE上样缓冲液于沸水中煮10 min。然后进行SDS-PAGE电泳,然后半干转至硝酸纤维素膜(NC膜)。将NC膜用含5%脱脂乳的TBST溶液37℃封闭2 h,TBST洗3次,每次10 min;使用阳性血清作为一抗孵育1 h,TBST洗3次,每次10 min;使用HRP标记的山羊抗鼠二抗(1∶6000)孵育1 h,TBST洗3次,每次10 min;最后在ECL发光显色。
2 结果
2.1 pColdI-p30的构建PCR扩增产物经1%琼脂糖凝胶电泳显示,在500~750 bp有1条单一的条带,大小为606 bp,条带大小与预期符合。将PCR产物回收,与EcoR I单酶切后的线性化载体pColdI连接并转化TOP10,挑取单菌落进行菌液PCR鉴定和双酶切鉴定。双酶切后,条带大小与预期符合,并且测序验证无误,命名为pColdI-p30。
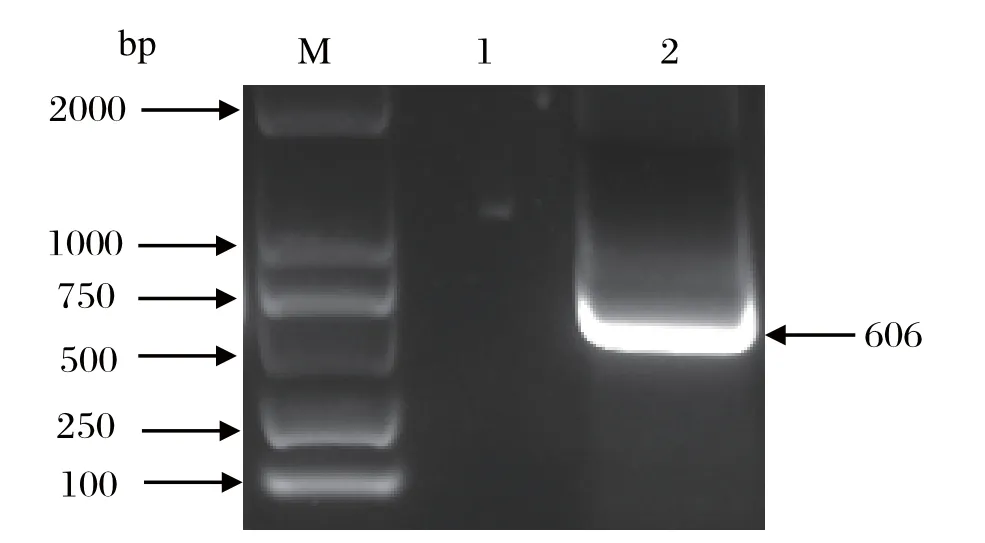
图1 非洲猪瘟病毒p30基因的PCR扩增Fig.1 PCR-amplified p30 gene from ASFV
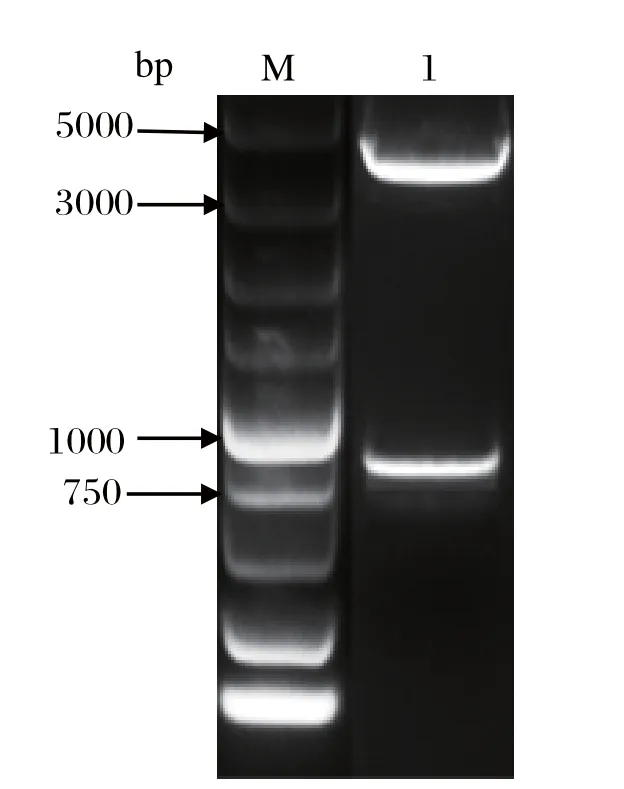
图2 pColdI-p30的酶切鉴定Fig.2 Identification of the recombinant plasmid pColdI-p30 by restriction enzymes digestion
2.2 SDA-PAGE鉴定p30表达当IPTG浓度为1mmol/L,在16℃诱导16 h后,pColdI-p30的沉淀出现1条非常明显的条带(图3),大小在25~35 kDa,与预测的30 kDa相差不大。pColdI空载、未诱导的pColdI-p30和诱导的pColdI-p30的上清均未出现条带,说明p30蛋白主要在包涵体中大量表达,包涵体可在8 mol/L尿素溶解。
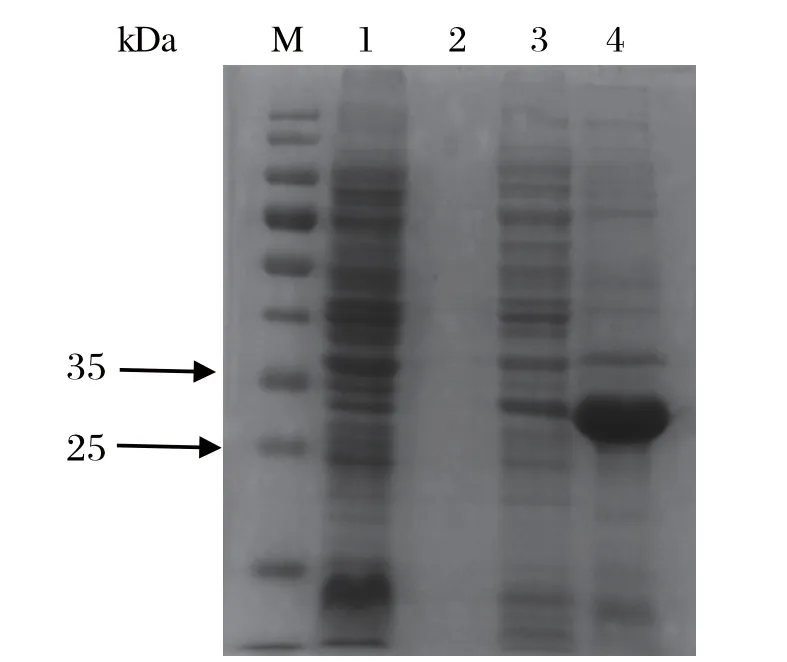
图3 p30蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of p30 protein
2.3 多克隆抗体的特异性为验证多克隆抗体的特异性,将pCAGGS和pCAGGS-p30质粒分别转染至Vero细胞,进行免疫荧光检测(immunofluorescence assay,IFA)和Western blot分析。IFA结果显示,p30蛋白多克隆抗体可特异性识别Vero细胞中表达的p30蛋白,而与空白对照没有反应(图4)。针对p30蛋白多克隆抗体可识别蛋白分子量约为25 kDa大小的特异性蛋白条带(图5)。
3 讨论
ASFV是OIE法定报告的烈性传染病之一,给全球养殖业造成巨大的经济损失。我国将其列为动物一类传染病,目前还没有有效的商品化疫苗问世。自2018年8月份以来,我国的ASFV疫情形势一直在扩展,现有ASF的防控方法主要包括流行病学监测、划定疫区以及扑杀受感染动物等。目前,在ASF的疫苗研究中,今年5月,中国农业科学院哈尔滨兽医研究所自主研发非洲猪瘟疫苗取得了阶段性成果,具有良好的生物安全性和免疫保护性;今年10月,饶子和、王祥喜和步志高团队合作采用了单颗粒三维重构的方法首次解析了非洲猪瘟病毒全颗粒的三维结构[12],对新型疫苗研发、优化具有指导意义。
p30是ASFV在感染过程中引起体液免疫应答的1个重要抗原蛋白,p30产生抗体可阻止病毒内吞[13],已有研究表明,p30蛋白在病毒DNA合成之前就已经产生并持续表达至病毒生命周期的结束。李杰等[14]通过融合表达方式制备出非洲猪瘟病毒p30-54的多克隆抗体。
本研究针对ASFV SY18毒株的p30基因,构建了重组真核表达质粒和含有His-tag的重组原核表达质粒。在原核表达系统中,低温诱导时,p30蛋白主要呈不可溶性表达,纯化后,用8 mol/L的尿素溶液将包涵体变性溶解,然后用稀释复性法将变性的p30蛋白复性。经过Western blot检测和IFA检测,制备的p30多克隆抗体具有很好的反应原性和特异性,为实验室后续进一步研究蛋白的生物学功能以及重组病毒P30的表达鉴定奠定了基础。
——一道江苏高考题的奥秘解读和拓展

