子宫内膜异位症中错配修复基因1启动子区异常甲基化与甲基化转移酶的关系*
单莉莉,何可人,温佳琦,王中海
子宫内膜异位症中错配修复基因1启动子区异常甲基化与甲基化转移酶的关系*
单莉莉1,何可人1,温佳琦1,王中海2*
(1. 深圳职业技术学院 医学与护理学院,广东 深圳 518055;2. 华中科技大学 协和深圳医院,广东 深圳 510000)
为探讨错配修复基因1(human mutL homolog 1,hMLH1)启动子区异常甲基化与甲基化转移酶(DNA methyltransferase,DNMT)的关系,揭示子宫内膜异位症(endometriosis,EM)的可能病因,留取43例卵巢子宫内膜异位症患者的异位内膜组织纳入EM组,留取30例其他妇科手术患者的正常子宫内膜纳入对照组.采用甲基特异性PCR(methylation specificity PCR,MSP)检测2组标本中hMLH1启动子区甲基化水平.同时采用免疫组化SP法,检测2组标本中DNMT1和DNMT3a、DNMT 3b的表达.结果显示,EM组甲基化率37%(16/43),对照组甲基化率3%(1/30),两者比较,差异有统计学意义(<0.05).EM组DNMT1表达阳性率为28%(12/43),对照组DNMT1表达阳性率为3%(1/30),两组比较,差异有统计学意义(<0.05).甲基化的EM标本中,DNMT1表达阳性率为69%(11/16);未甲基化的EM标本中,DNMT1表达阳性率为4%(1/27),两组比较,差异有统计学意义(<0.05).DNMT1高表达所致的hMLH1启动子区异常甲基化可能是子宫内膜异位症的病因之一.
子宫内膜异位症;hMLH1;甲基化;甲基化转移酶
子宫内膜异位症(endometriosis,EM)在育龄期女性中的发病率逐年升高,易造成不孕,影响女性生活质量[1].内异症病因目前尚不清楚,已有研究证实:hMLH1启动子区异常甲基化是内异症的可能病因,与国内外很多学者的研究结果一致[2].甲基化转移酶(DNA methyltransferase,DNMT)是DNA甲基化的关键酶,与DNA甲基化活性有密切关系.本项研究提取内异症组织中的DNA,用甲基特异性PCR(methylation specificity PCR,MSP)检测组织中错配修复基因1(human mutL homolog 1,hMLH1)启动子区甲基化水平;采用免疫组化SP法,检测内异症组织中DNMT1和DNMT3a、DNMT3b的表达,同时用正常子宫内膜组织做对照,探讨内异症中hMLH1启动子区异常甲基化与DNMT的关系,揭示内异症的可能病因.
1 资料与方法
1.1 研究对象及分组
选择2018年6月至2019年1月华中科技大学协和深圳医院收治的卵巢子宫内膜异位症病人43例,年龄为26~45岁,无其他并发疾病,留存卵巢的异位内膜组织.同期,在该院行其他妇科手术(主要为子宫脱垂手术或节育术)的病人30例,年龄29~38岁,无其他并发疾病,留存正常子宫内膜组织.
1.2 方法
1)采用小量组织基因组DNA抽提试剂盒提取组织DNA,设计并合成了hMLH1甲基化引物(hMLH1-m)和非甲基化引物(hMLH1-u),采用MSP检测组织中hMLH1启动子区的甲基化状态,琼脂糖凝胶电泳,EB染色,紫外凝胶成像系统下观察.
2)采用免疫组化SP法检测组织中DNMT1、DNMT3a、DNMT 3b的表达,DNMT阳性出现在子宫内膜腺上皮的胞浆中,呈黄棕色沉淀.随机选择5个高倍镜视野(×400),观察黄棕色沉淀所占比例,取5个高倍镜视野平均值,≥10%为阳性,<10%为阴性.
1.3 统计学分析方法
本研究数据采用SPSS21.0统计学软件进行统计学分析,组间比较采用t检验,以P<0.05示差异有显著意义.
2 结 果
2.1 hMLH1启动子区甲基化情况
43例内异症组织中,16例出现甲基化(m),27例出现未甲基化(u),甲基化率37%.30例正常子宫内膜组织中,1例出现甲基化,甲基化率3%.见表1,图1-3.两者比较,差异有统计学意义(<0.05)

表1 hMLH1启动子区甲基化情况

图1 对照组DNA hMLH1启动子区甲基化

1、2、3、9、10、11号部分甲基化;4、5、6、12、13、14、15、16、19、20号完全甲基化,7、8、17、18、21-43号未甲基化
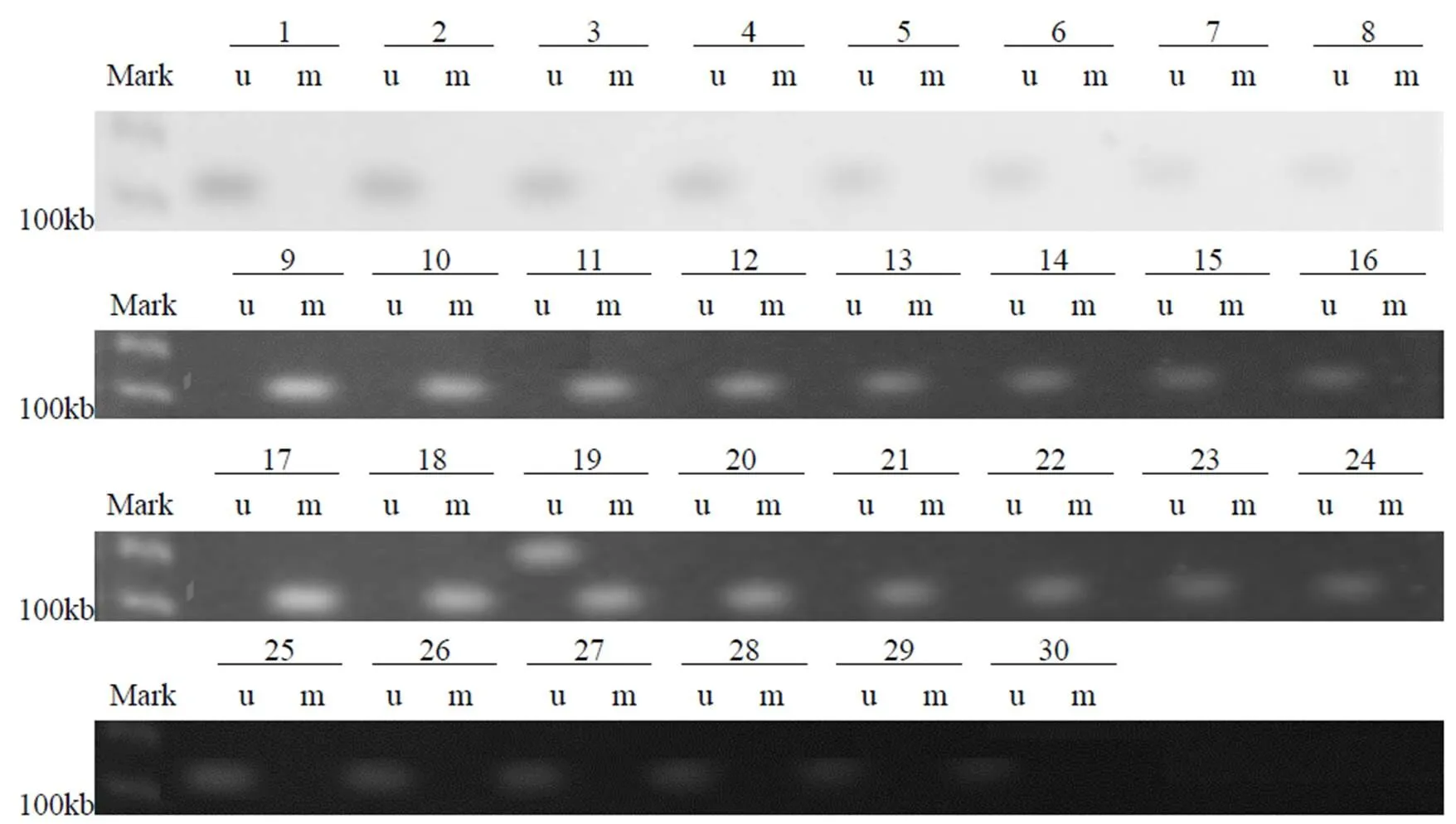
18号部分甲基化,其余全部未甲基化
2.2 DNMT1、DNMT3a、DNMT 3b的表达
内异症组与正常子宫内膜组均未检测到DNMT3b的表达.内异症组中,DNMT3a表达阳性2例,表达阳性率为5%(2/43例),正常子宫内膜组中,DNMT3a表达阳性1例,表达阳性率为3%(1/30例),两组比较,差异无统计学意义(>0.05).内异症组中,DNMT1表达阳性12例,表达阳性率为28%(12/43例),正常子宫内膜组中,1例DNMT1表达阳性,表达阳性率为3%(1/30例),两组比较,差异有统计学意义(<0.05)(表2、图4、图5).
2.3 内异症中DNMT1、DNMT3a的表达
16例hMLH1启动子区异常甲基化的内异症中,11例DNMT1表达阳性,表达阳性率为69%;27例hMLH1启动子区未甲基化的内异症中,1例DNMT1表达阳性,表达阳性率为4%,两组比较,差异有统计学意义(<0.05).16例hMLH1启动子区异常甲基化的内异症标本中,1例DNMT3a表达阳性,表达阳性率为6%;27例hMLH1启动子区未甲基化的内异症标本中,1例DNMT3a表达阳性,表达阳性率为4%,两组比较,差异无统计学意义(>0.05).其中,1例异常甲基化标本DNMT1、DNMT3a同时表达阳性(见表3).

表2 DNMT1、DNMT3a、DNMT3b在内异症及正常内膜中的表达

图4 DNMT1在内异症组织中表达阳性(SP×400)

图5 DNMT1在正常内膜组织中表达阴性(SP×400)

表3 DNMT1、DNMT3a在内异症中的表达
3 讨 论
人类基因组错配修复反应可修复DNA复制中出现的碱基错配、消除不配对序列,从而防止DNA复制差错的发生.错配修复基因(mismatch repair gene,MMR)与错配修复反应有密切关系,hMLH1是MMR中最重要的成员,国内外很多研究已证明,hMLH1启动子区异常甲基化导致的hMLH1表达缺陷,在结肠癌、子宫内膜癌、直肠癌、胃癌等的发生过程中起重要作用[3-5].内异症属于妇科良性疾病,却具有浸润、转移、复发等恶性肿瘤的特点,已有研究证实:hMLH1启动子区异常甲基化导致的hMLH1表达缺陷可能是内异症的病因之一[6].本次研究结果进一步支持了上述论断,内异症组织与正常子宫内膜组织比较,hMLH1启动子区异常甲基化的发生率更高.
DNA甲基化需要DNMT的催化,已有研究证明,主要有3种DNMT参与DNA甲基化过程.DNMT3a、DNMT3b的主要功能是参与DNA从头甲基化,对未甲基化DNA的亲和力及生物活性更高,DNMT3a、DNMT3b将未甲基化的位点进行甲基化,建立新甲基化.DNMT1的主要功能是参与DNA甲基化状态的维持,对于半甲基化DNA的亲和力及生物活性更强,催化复制后DNA子链的甲基化,使其保持与亲链相同的甲基化状态.本研究提示,内异症组织中存在DNMT1的高表达,hMLH1启动子区异常甲基化与DNMT1的高表达密切相关,与DNMT3a、DNMT3b无关.这一研究结果提示:DNMT1高表达所致的hMLH1启动子区异常甲基化可能是子宫内膜异位症的病因之一.
研究表明,甲基化转移酶的过度表达可以作为DNA甲基化的重要指标.很多内异症病人没有临床症状,能否通过DNMT1表达的监测,协助内异症诊断;内异症治疗后的复发问题,一直困扰着妇科医生,能否通过监测DNMT1的表达,预警内异症复发,可作为我们未来的研究方向.已有学者在动物实验中证明:采用甲基转移酶抑制剂,抑制甲基转移过程,进行基因靶向治疗,对疾病的治疗有重要作用[7,8].2006年在美国上市的DNA甲基转移酶抑制剂—地西他滨(Decitabine,DacogenTM)和阿扎胞苷(Azacitidine,VidazaTM)已用于治疗骨髓异常增生综合征(myelodysplasia syndrome,MDS),该药物可通过抑制基因异常甲基化而在基因水平治疗MDS.目前学界认为,EM是一种表观遗传学疾病,而表观遗传修饰是一种可逆性的修饰,未来,能否在临床应用DNA甲基转移酶抑制剂,通过抑制基因异常甲基化而治疗内异症,尚待进一步研究.
[1] 谢幸,孔北华,段涛,等.妇产科学[M].北京:人民卫生出版社,2018.
[2] Saare M, Krigul K L, Laisk-Podar T, et al. DNA methylation alterations-potential cause of endometriosis pathogenesis or a reflection of tissue heterogeneity[J]., 2018,99(2):273-282.
[3] Westwood A, Glover A, Hutchins G, et al. Additional loss of MSH2 and MSH6 expression in sporadic deficient mismatch repair colorectal cancer due to MLH1 promoter hypermethylation[J]., 2019,72(6):443-447.
[4] Qi M, Xiong X. Promoter hypermethylation of RARβ2, DAPK, hMLH1, p14, and p15 is associated with progression of breast cancer: A PRISMA-compliant meta-analysis[J].(), 2018,97(51):e13666.
[5] Cornel K M C, Wouters K, Van de Vijver K K, et al. Gene Promoter Methylation in Endometrial Carcino- genesis[J]., 2019,25(2):659-667.
[6] Fuseya C, Horiuchi A, Hayashi A, et al. Involvement of pelvic inflammation-related mismatch repair abnormalities and microsatellite instability in the malignant transformation of ovarian endometriosis[J]., 2012,43(11):1964-72.
[7] Vető B, Szabó P, Bacquet C, et al. Inhibition of DNA methyltransferase leads to increased genomic 5-hydroxymethylcytosine levels in hematopoietic cells[J]., 2018,8(4):584-592.
[8] 张婷,夏良斌,高静,等.DNA甲基转移酶抑制剂对子宫内膜异位灶的影响[J].实用妇产科杂志,2016,32(1):57-62.
The Relationship between the DNA Methyltransterase and the Methylation of Human MutL Lomolog 1 Promoter in Endomrtriosis
SHAN Lili1, WEN Jiaqi1, WANG Zhonghai2
()
This paper is to study the relationship between the methylation of human mutL homolog 1(hMLH1) promoter and the DNA methyltransterase (DNMT), and the relationship between DNMT and endometriosis(EM). Methylation of hMLH1 promoter was verified by methylation specificity PCR(MSP) and the protein expression of DNMT1, DNMT3a, DNMT3b was analysed by the immunohistochemistry SP method in 43 tissues of endometriosis and 30 tissues of normal endometrium. Results show that there was significant difference between two groups(<0.05). First, the hMLH1 promoter methylation in endomrtriosis was 37%(16/43), while in control group was 3%(1/30). Second, the protein expression of DNMT1 in endomrtriosis was 28%(12/43), while in control group was 3%(1/30).Third, the protein expression of DNMT1 in endomrtriosis with methylation of hMLH1 promoter was 69%(11/16), while the protein expression of DNMT1 in endomrtriosis without methylation of hMLH1 promoter was 4%(1/27). The high expression of DNMT1 with high methylation of hMLH1 promoter may be one of the mechanisms of endometriosis.
endomrtriosis; triosishuman mutL homolog 1(hMLH1); methylation; methyltransferase inhibitou
2020-05-25
深圳职业技术学院校级自然科学类重点资助项目(601822K31007)
单莉莉,女,吉林人,医学博士,副教授,副主任医师,主要研究方向:子宫内膜异位症发病机制.
王中海,男,安徽人,医学学士,主任医师,硕士生导师,主要研究方向:子宫内膜异位症发病机制的研究、妇科微创手术技术.
R711.71
A
1672-0318(2020)05-0047-05
10.13899/j.cnki.szptxb.2020.05.009

