猪伪狂犬病病毒变异株gE/gI/TK三基因缺失株rPRV NY-gE-/gI-/TK-的纯化及生物学特性
郑慧华,田润博,徐 通,崔建涛,侯承尧,赵 宇,郑兰兰,刘 芳,陈红英,2*
(1.河南农业大学 牧医工程学院,河南 郑州450002;2.郑州市猪重大疫病防控重点实验室,河南 郑州 450002)
伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(PRV)引起牛、猪、羊等家畜和野生动物的一种急性、致死性传染病。该病具有高度接触性、传染性等特点,且猪是唯一的天然宿主[1]。PRV感染猪,主要临床表现为发热、脑脊髓炎、呼吸系统以及繁殖系统障碍。在我国20世纪80年代,猪PR的防制主要依靠接种PRV Bartha-K61疫苗,使该病得到有效控制[2-3]。然而,2011年底,我国很多地区经Bartha-K61疫苗免疫的规模化猪场出现PR的流行。研究表明,再次出现的PR是PRV变异株引起的,且毒力增强,甚至可导致成年猪死亡,PRV gE抗体阳性率也在逐年上升,使我国养猪业受到了巨大的威胁[4-6]。最近报道,PRV可通过伤口引发人眼内炎和脑炎[7-8],引起学者们的极大关注与忧虑。因此,针对当前流行于我国PRV变异株的疫苗研发已迫在眉睫。
考虑到增强型绿色荧光蛋白(EGFP)的安全性,本研究在表达EGFP的PRV变异株gE/gI/TK三基因缺失株rPRV NY-gE-/gI-/TK-/EGFP+基础上,采用传统的同源重组技术,构建不表达EGFP的rPRV NY-gE-/gI-/TK-,并对其主要生物学特性进行研究,为进一步研制PRV基因缺失疫苗提供有效的技术支持。
1 材料与方法
1.1 质粒、毒株和细胞含PRV左同源臂(含部分UL24、TK基因)、右同源臂(含部分TK、UL22基因)的转移质粒pUC-TKLR、PRV变异株gE/gI双基因缺失株rPRV NY-gE-/gI-和表达EGFP的gE/gI/TK三基因缺失株rPRV NY-gE-/gI-/TK-/EGFP+均由郑州市猪重大疫病防控重点实验室构建并保存。PRV NY强毒株由郑州市猪重大疫病防控重点实验室分离并保存;ST细胞(猪睾丸细胞系)、VERO(非洲绿猴肾细胞系)、PK-15细胞(猪肾细胞系)、MDCK细胞(犬肾细胞系)由郑州市猪重大疫病防控重点实验室保存。
1.2 实验动物32只6周龄SPF雌性昆明小鼠购自河南省实验动物中心。
1.3 主要试剂OMEGA Endo-Free Plasmid Mini Kit购自广州飞扬生物工程有限公司;UNIQ-10柱式病毒基因组抽提试剂盒和质粒小量提取试剂盒购自生工生物工程(上海)股份有限公司;细胞转染试剂ZLip2000购自北京庄盟国际生物基因科技有限公司;低熔点琼脂糖购自索莱宝科技有限公司;DMEM培养液购自武汉博士德生物工程有限公司;胎牛血清(FBS)购自浙江天杭生物科技股份有限公司。
1.4 转移质粒pUC-TKLR的鉴定参照OMEGA Endo-Free Plasmid Mini Kit说明书提取转移质粒pUC-TKLR,用Hind Ⅲ和Pst Ⅰ进行酶切鉴定。同时,以pUC-TKLR为模板,利用2对特异性引物TKL-F/R和TKR-F/R(TKL-F:5′-AAGCTTGCCTTATCATCCCCGCT-3′和TKL-R:5′-CTGCA-GCTGATGTCCCCGACGAT-3′;TKR-F:5′-CTGCAGTCCAGGACACCCTCTTC-3′和TKR-R:5′- GAATTCGCGGAGATGATGACCTC-3′)分别扩增TK缺失部分两端的左、右同源臂并测序,以验证左右同源臂克隆的正确性。
1.5 重组病毒rPRV NY-gE-/gI-/TK-的构建
1.5.1转染 当ST细胞融合程度达到80%左右时,将PRV转移质粒pUC-TKLR与rPRV NY-gE-/gI-/TK-/EGFP+株基因组参照细胞转染试剂ZLip2000说明书共转染到ST细胞中。约6 h 后,换为2% FBS的DMEM培养液,继续培养48 h,反复冻融3次收取病毒液,置于-80℃保存。
1.5.2重组病毒的空斑纯化与鉴定 用无血清DMEM培养液,将收获的病毒液进行10倍系列稀释,分别取100 μL 10-2~10-6稀释度的病毒液接种到六孔板的90%融合 ST细胞中,利用蚀斑法进行重组病毒的筛选。选取最大稀释度孔内的无绿色荧光蚀斑,置于无血清DMEM培养液中,反复冻融3次。重复上述操作,直至所有蚀斑均无绿色荧光。将纯化的PRV三基因缺失病毒命名为rPRV NY-gE-/gI-/TK-。利用特异性引物TKQS/F:5′-TCGTCGGGGACATCAGC-3′和TKQS/R:5′-GACGGGCACGGCAAACT-3′,按照以下反应参数:95℃ 5 min;95℃ 50 s,59℃ 45 s,72℃ 150 s,共35个循环;72℃总延伸10 min;4℃ 10 min进行PCR鉴定,并将回收纯化的PCR产物进行序列测定,以验证TK基因上缺失的序列。再利用高晓云等[9]gC全基因特异引物gC/F和gC/R,对rPRV NY-gE-/gI-/TK-进行gC基因的扩增。
1.6 重组病毒在多种细胞上的毒价测定及培养特性用无血清DMEM培养液,将rPRV NY-gE-/gI-/TK-按10-1~10-10比例进行稀释。分别取100 μL病毒液接种于ST细胞、VERO细胞、PK-15细胞和MDCK细胞长至90%的96孔细胞培养板中,每个稀释度设8个重复,同时接种100 μL DMEM培养液作为阴性对照。吸附2 h后,加入100 μL的2%FBS DMEM培养液继续培养,逐天观察并记录结果,按照Karber法计算该毒株在不同细胞中TCID50。
取106.0×TCID50/0.1 mL病毒液,分别接种于单层的ST细胞、VERO细胞、PK-15细胞和MDCK细胞,吸附2 h后,加入2%FBS的DMEM培养液继续培养。于接毒后0,6,12,24,36,48 h时,在倒置荧光显微镜下观察不同细胞的病变情况。
1.7 重组病毒与亲本株在ST细胞上TCID50的测定取106.0×TCID50/0.1 mL的rPRV NY-gE-/gI-/TK-与亲本株NY,分别接种于ST单层细胞,待ST细胞出现90%病变时收病毒液。随后参照1.6分别测定rPRV NY-gE-/gI-/TK-和亲本株NY株在ST细胞上的TCID50。
1.8 重组病毒的一步生长曲线测定取10 μL(106.0×TCID50/0.1 mL)rPRV NY-gE-/gI-/TK-接种于六孔细胞板的ST单层细胞中,同时做4个重复孔,设正常的ST细胞作为阴性对照。接毒后0,4,6,8,10,12,24,36,48,60,72 h分别收集上清液和细胞沉淀。参照1.6测定各时间点上清液和细胞沉淀的TCID50,分析rPRV NY-gE-/gI-/TK-在ST细胞上的增殖特性。
1.9 重组病毒的遗传稳定性评价将rPRV NY-gE-/gI-/TK-在ST细胞增殖20代,在倒置荧光显微镜下观察每代细胞病变以及绿色荧光情况。从第1代开始到第20代,提取每隔1代病毒液DNA,PCR鉴定其TK和gC基因,并测序验证rPRV NY-gE-/gI-/TK-的遗传稳定性。
1.10 重组病毒的安全性初步检测将32只6周龄SPF雌性小鼠随机分4组,8只/组,第1,2和3组分别用500 μL 106.0×TCID50/0.1 mL PRV NY强毒株、rPRV NY-gE-/gI-和rPRV NY-gE-/gI-/TK-背部皮下注射,而第4组接种500 μL DMEM。接种后,人工隔离饲养,逐日观察试验小鼠的精神及食欲状况,初步研究rPRV NY-gE-/gI-/TK-对小鼠的安全性。
2 结果
2.1 转移质粒pUC-TKLR的鉴定结果利用Hind Ⅲ与Pst Ⅰ对转移质粒pUC-TKLR进行酶切、电泳,结果显示,在约1 000和3 700 bp处出现了特异性条带,与预期结果相一致。测序结果显示,左同源臂片段为967 bp,右同源臂片段为976 bp,与PRV TJ毒株KJ789182序列相应部分的序列同源性100%。
2.2 重组病毒的拯救与PCR鉴定结果将PRV转移质粒pUC-TKLR与rPRV NY-gE-/gI-/TK-/EGFP+株基因组共转染至ST细胞,pUC-TKLR与rPRV NY-gE-/gI-/TK-/EGFP+在细胞内发生同源重组,拯救出PRV三基因缺失株rPRV NY-gE-/gI-/TK-(图1)。经5轮蚀斑纯化,由于重组病毒没有EGFP基因,所有病毒蚀斑均不呈现绿色荧光。
利用TK特异性引物TKQS/F和TKQS/R,以重组病毒DNA为模板,对TK缺失部分进行PCR鉴定并测序。结果显示,rPRV NY-gE-/gI-/TK-株在约500 bp处有单一的特异性条带(图2),而rPRV NY-gE-/gI-/TK--EGFP+株和rPRV NY-gE-/gI-株分别在约2 000和750 bp处有单一的特异性条带(图2),经测序,rPRV NY-gE-/gI-/TK-不含EGFP,并在TK基因上缺失311 bp,与预期结果一致。利用gC全基因特异引物,对rPRV NY-gE-/gI-/TK-株进行鉴定。电泳结果显示,在约1 500 bp 处有特异且单一的目的条带,与预期结果一致。
2.3 重组病毒在多种细胞上的毒价测定及培养特性结果经测定,rPRV NY-gE-/gI-/TK-在ST细胞、PK-15细胞、VERO细胞和MDCK细胞中TCID50,分别为106.375/0.1 mL,105.625/0.1 mL,105.375/0.1 mL,103.875/0.1 mL,表明rPRV NY-gE-/gI-/TK-在ST细胞上有较高的感染滴度。将rPRV NY-gE-/gI-/TK-接种ST细胞,6 h时没有明显的细胞病变;12 h时呈现部分细胞之间界限不清、变圆现象;24 h时有明显的细胞病变,可见细胞明显变圆;36 h时细胞严重病变,出现细胞变圆、融合、脱落;48 h时可见严重的细胞脱落现象。对于PK-15细胞和VERO细胞,细胞病变较ST细胞慢,而MDCK细胞脱落最慢(图3~6),因此该病毒更适合在ST细胞上进行大量增殖培养。

图1 rPRV NY-gE-/gI-/TK-构建示意图
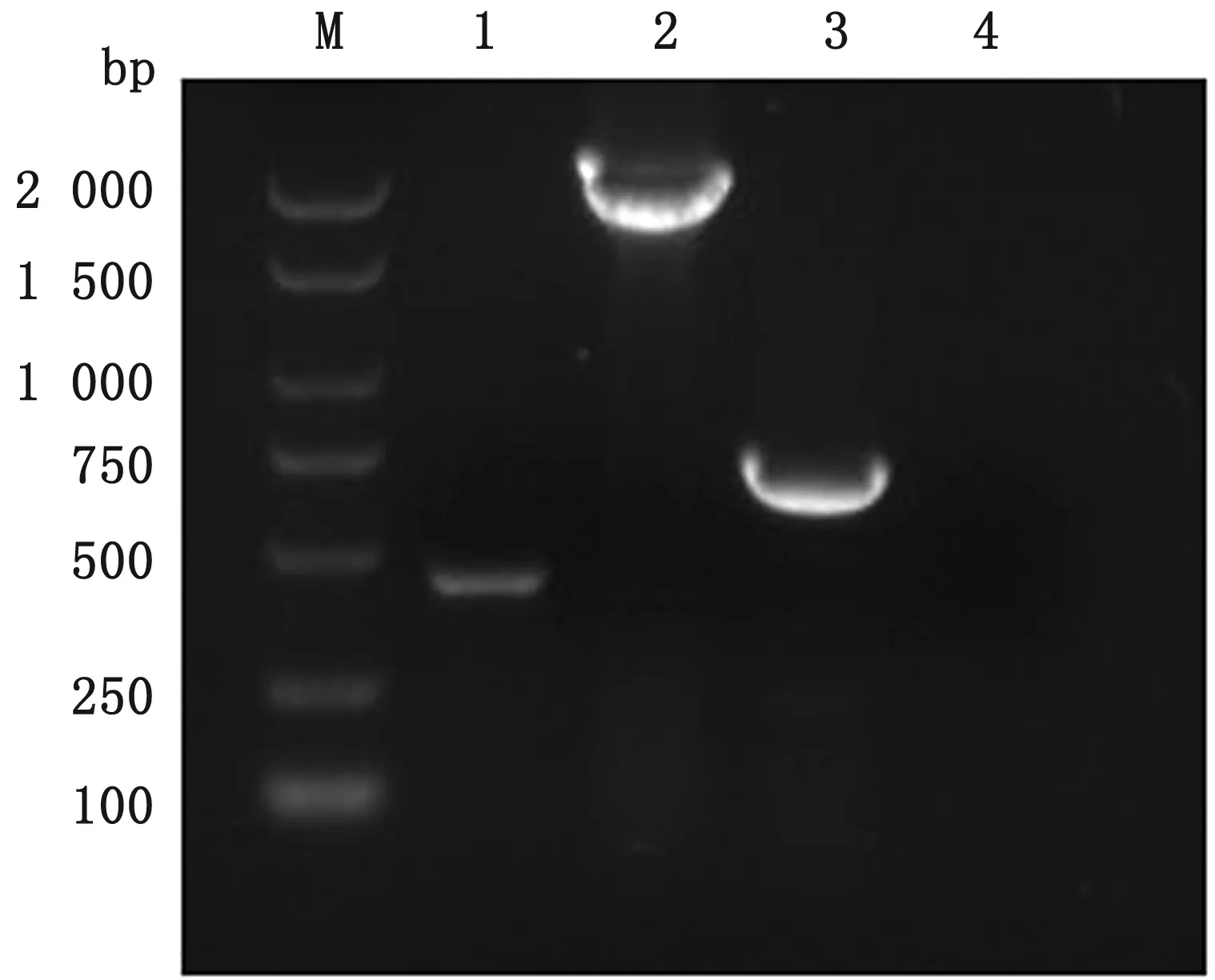
图2 rPRV NY-gE-/gI- /TK-的TK缺失基因鉴定 M.DL2000 DNA Marker;1.rPRV NY-gE-/gI- /TK-缺失株;2.rPRV NY-gE-/gI- /TK-/EGFP+基因;3.rPRV NY-gE-/gI-基因;4.阴性对照
2.4 重组病毒与亲本株在ST细胞上的TCID50测定结果rPRV NY-gE-/gI-/TK-与亲本毒株PRV NY在ST细胞上的TCID50分别为106.375、TCID50/0.1 mL和106.5TCID50/0.1 mL,可见2株病毒在ST细胞上的增殖滴度相近,表明gE、gI和TK三基因的缺失并不明显地影响PRV的增殖。
2.5 重组病毒的一步生长曲线测定rPRV NY-gE-/gI-/TK-在ST细胞上的一步生长曲线,如图7所示。接种24 h内,上清液与细胞内的病毒滴度均随时间增加而呈上升趋势,但主要存在于细胞内;24 h后增殖的病毒大量释放于上清液中,且36 h后病毒滴度趋于稳定;而接种24 h后细胞内的病毒滴度逐渐减小,且在接种后60~72 h的病毒滴度下降较快。

图3 rPRV NY-gE-/gI-/TK-在接种ST细胞后各时间点的细胞病变

图4 rPRV NY-gE-/gI-/TK-在接种PK-15细胞后各时间点的细胞病变

图5 rPRV NY-gE-/gI-/TK-在接种Vero细胞后各时间点的细胞病变

图6 rPRV NY-gE-/gI-/TK-在接种MDCK细胞后各时间点的细胞病变
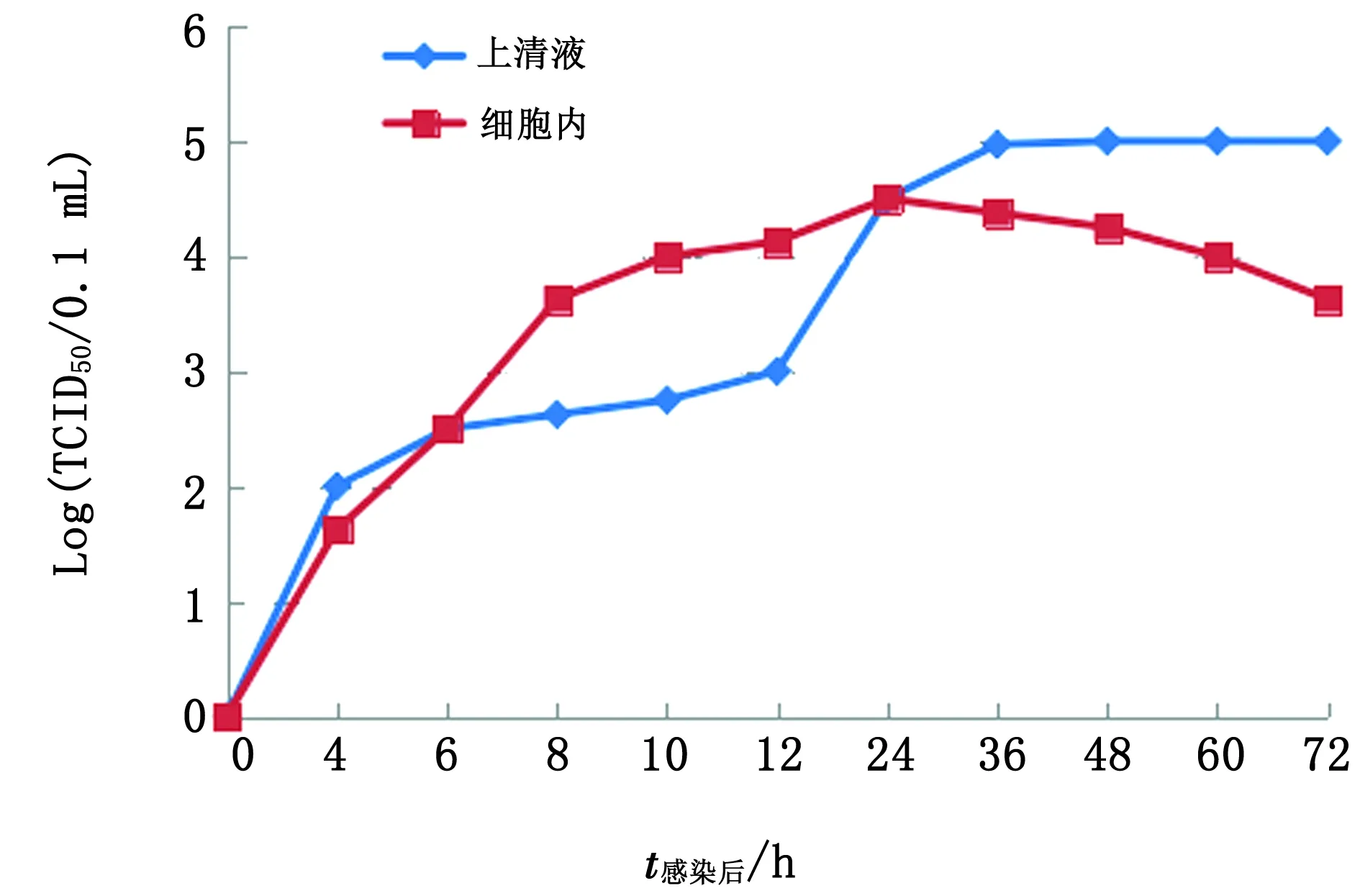
图7 rPRV NY-gE-/gI-/TK-在接种ST细胞后的生长曲线分析
2.6 重组病毒的遗传稳定性评价结果将rPRV NY-gE-/gI-/TK-在ST细胞中增殖20代仍无绿色荧光。从第1~20代的每隔1代病毒液DNA中,均能扩出大小约为500 bp的部分TK基因及约为1 500 bp 的完整gC基因,与预期结果相一致。经测序,rPRV NY-gE-/gI-/TK-均在TK基因上缺失311 bp,并且不影响gC基因。表明rPRV NY-gE-/gI-/TK-具有良好的遗传稳定性(图8)。
2.7 重组病毒的安全性初步检测结果显示,rPRV NY-gE-/gI-/TK-接种组(第3组)和DM-EM培养液组(第4组)小鼠均健康存活,且精神与食欲正常;而亲本株PRV NY强毒株接种组(第1组)和rPRV NY-gE-/gI-接种组(第2组)的小鼠全部发病死亡,可见TK基因是小鼠的主要毒力基因。此外,第1组小鼠于接种60 h后,陆续出现抓挠啃咬注射部位、皮毛脱落、出血及死亡等PR典型症状,并于72 h内全部死亡,而第2组小鼠在72 h后,开始发病,且96 h内全部死亡;这可能是缺失gE/gI基因的PRV致病性降低,导致小鼠发病晚,存活时间长。表明rPRV NY-gE-/gI-/TK-对6周龄SPF雌性小鼠是安全的。
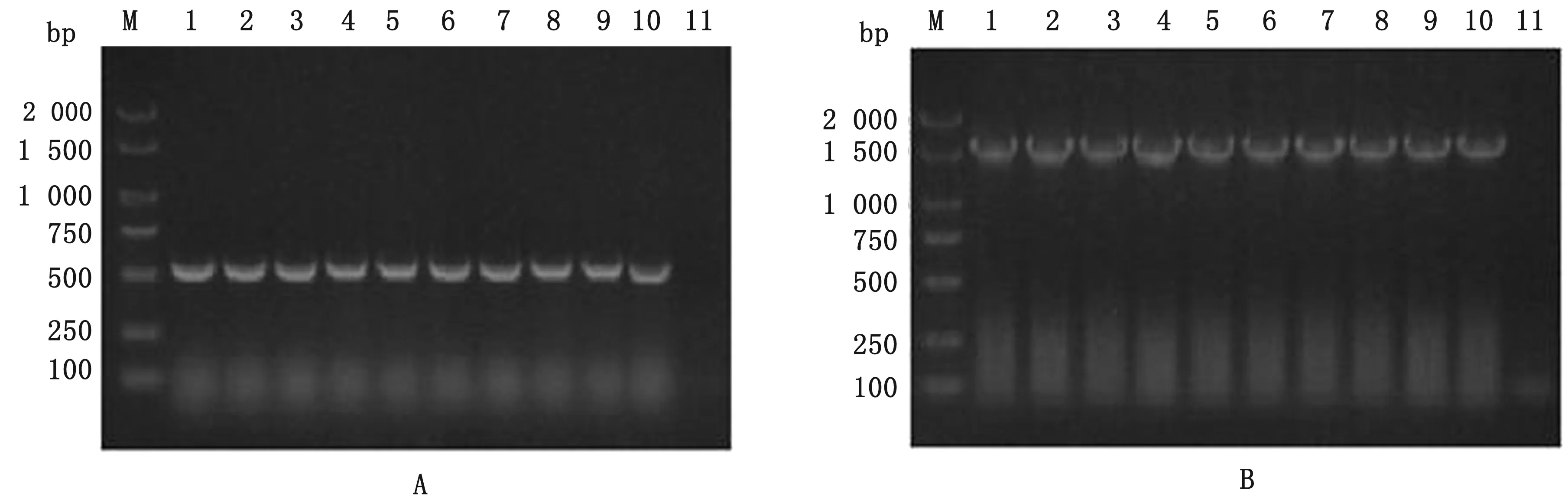
图8 rPRV NY-gE-/gI-/TK-PCR鉴定结果 A.rPRV NY-gE-/gI-/TK-的TK缺失基因鉴定结果;B.rPRV NY-gE-/gI-/TK-的gC基因鉴定结果。M.DL2000 DNA Marker;1~10.PCR产物;11.阴性对照
3 讨论
自中国首次报道PR后,该病陆续在养猪场流行,但在接种Bartha-K61疫苗后得到很好的控制[2]。然而,自2011年底以来,正常接种Bartha-K61疫苗的猪群中再次出现PR大流行,且不同阶段的猪均可感染PRV,新生仔猪和生长肥育猪死亡率也逐年上升,gE抗体阳性率上升到50%以上[10]。有研究证明,正常接种Bartha-K61疫苗的动物可以抵抗经典毒株SC等的攻击,但不能完全抵抗PRV流行变异株(如PRV HeN1和TJ株)[4,11]。因此,我国迫切需要开发更有效的PRV疫苗来控制现行PRV变异株的流行。
目前,基因缺失疫苗仍然是防制PRV最有效的措施。由于gE、gI、TK基因是PRV的主要毒力基因,且在PRV增殖中是非必需的,缺失后可降低PRV的侵染力、传播力和毒力,但仍能具有良好的免疫原性[12-13]。已有学者采用BAC技术以PRV变异株为研究对象,缺失TK/gE/gI三基因或者gE/gI双基因[5,14]。然而,利用这种技术,构建的病毒携带高重组频率的LoxP位点,不利于重组病毒的遗传稳定性,这用于PRV疫苗株的生产是不可取的,尤其是活疫苗株。由于脂质体法的DNA转染效率比磷酸钙法高[15],故本研究采用脂质体法将转移质粒pUC-TKLR与rPRV NY-gE-/gI-/TK-/EGFP+株的基因组共转染至ST细胞,通过5轮蚀斑纯化,成功获得不表达EGFP的rPRV NY-gE-/gI-/TK-,其在rPRV NY-gE-/gI-基础上缺失了311 bp的部分TK基因。不含外源EGFP基因的重组病毒,不仅避免了基因污染,也保证了接种猪后不会诱导机体产生针对外源蛋白的抗体,进而消除了外源基因EGFP对PRV自身生物学特性的影响及在临床上造成的副作用,提高该重组病毒的稳定性和生物安全性[16]。
本研究对rPRV NY-gE-/gI-/TK-在ST、PK-15、VERO和MDCK细胞上测定TCID50分别为106.375/0.1 mL,105.625/0.1 mL,105.375/0.1 mL和103.875/0.1 mL,且接种ST细胞后观察细胞病变最快,表明rPRV NY-gE-/gI-/TK-更适合在ST细胞上进行大量增殖培养,证实gE/gI/TK的缺失并不影响PRV的增殖特性,但低于亲本株NY的病毒滴度(106.5×TCID50/0.1 mL),与陈焕春等[17]的研究一致。rPRV NY-gE-/gI-/TK-在ST细胞上的体外生长曲线结果显示,接种24 h内,上清液与细胞内的病毒滴度均随时间增加而呈上升趋势,但主要存在于细胞内;24 h后增殖的病毒大量释放于上清液中,且36 h后病毒滴度达到最大,为rPRV NY-gE-/gI-/TK-在ST细胞培养和收毒时间的确定提供了参考。此外,rPRV NY-gE-/gI-/TK-在ST细胞中增殖20代仍无绿色荧光,且对第1~20代中每隔1代病毒DNA进行TK、gC基因的PCR扩增及测序,结果显示均在TK基因上缺失311 bp,且均具有完整的gC基因,表明rPRV NY-gE-/gI-/TK-株具有良好的遗传稳定性;rPRV NY-gE-/gI-/TK-接种小鼠后均健康存活,而rPRV NY-gE-/gI-接种小鼠后全部死亡,进一步证实了TK基因为小鼠的毒力基因,与仇华吉等[18]的研究一致。综上所述,rPRV NY-gE-/gI-/TK-有望成为应用于当前PRV流行防控工作的候选疫苗株。

