β-catenin在lα,25-(OH)2D3调控小鼠体外破骨细胞形成中的作用
周佳桦,张雨蓓,张松彬,张 闯,闵雯嫣,赵鸿雁,刘宗平,顾建红
(扬州大学 兽医学院 江苏高校动物重要疫病与人兽共患病防控协同创新中心/江苏省人兽共患病学重点实验室,江苏 扬州 225009)
破骨细胞(osteoclasts,OC)能够降解骨有机质和无机质,在骨形成、骨组织血管形成、关节软骨生理病理过程中均发挥重要作用[1],能够维持机体骨骼和钙磷代谢的平衡[2]。维生素D作为抗佝偻病因子,其活性形式1α,25(OH)2D3可增加骨质疏松病人的骨密度,常被用来治疗骨质疏松。然而,1α,25(OH)2D3还能促进体外成骨细胞(osteoblasts,OB)与骨髓巨噬细胞(bone marrow-derived macrophages,BMMs)共培养体系中OC的形成和骨吸收功能[3]。可能是1α,25(OH)2D3在体内主要是促进肠钙的吸收,改变钙内环境,促进骨组织的钙化;而1α,25(OH)2D3在体外能够促进OB表达膜结合型核因子κB受体活化因子配体(receptor activator for nuclear factor-κB,RANKL),间接促进OC的形成[4]。本研究发现,1α,25(OH)2D3在体外能够直接作用于小鼠OC前体,抑制其分化和骨吸收功能。然而,1α,25(OH)2D3调控小鼠OC形成的机制仍不十分清楚。
研究表明,Wnt信号通路的中心因子β-连环蛋白(β-catenin)是维持骨稳态的必须因子。敲除间充质干细胞,OB以及骨细胞中的β-catenin基因Ctnnbl可致机体骨量减少,而激活这些细胞中的Ctnnbl可使机体骨量增加。因为敲除间充质干细胞Ctnnbl,可使间充质干细胞向软骨细胞或脂肪细胞分化,阻止其向OB分化[5-7]。由此可见,Wnt/β-catenin信号在骨形成和骨量调节中至关重要。然而,Wnt/β-catenin信号在OC形成中的作用仍不清楚,且1α,25(OH)2D3是否能够通过β-catenin信号调控OC形成需要进一步研究。本试验采用巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)和RANKL诱导OC形成[8],观察β-catenin在1α,25(OH)2D3调控小鼠OC形成中的作用,为1α,25(OH)2D3调控OC防治人与动物骨骼和钙磷代谢紊乱性疾病的机制研究奠定基础。
1 材料与方法
1.1 实验动物4~6周龄雄性C57BL/6小鼠购自扬州大学比较医学中心,实验动物许可证号为SYXK(苏)2017-0044。所有实验动物的实施程序均严格遵循《实验动物管理条例》。
1.2 主要试剂和耗材GAPDH兔多克隆抗体(CST, USA);-catenin小鼠单克隆抗体(BD, USA);基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9);兔多克隆抗体(Abcam,USA);Trizol(Invitrogen,USA); HiScript Q RT SuperMix for qPCR(+gDNA wiper)和ChamQTM SYBR®qPCR Master Mix(Vazyme,China);96孔骨细胞培养板(Sigma-Aldrich,USA)。
1.3 小鼠骨髓源性破骨细胞前体的分离培养C57BL/6小鼠脱颈处死,75%乙醇消毒后分离胫骨和股骨,剔净肌肉;用无菌注射器吸取α-MEM培养基(不含血清)冲洗骨髓腔至发白,移液器吹打分散细胞团,200目无菌筛网过滤后1 200 r/min离心5 min,收集细胞;1 mL无菌PBS重悬细胞,加入5 mL 红细胞裂解液混匀后静置2 min,1 200 r/min离心5 min,收集细胞;10 mL无菌PBS清洗细胞;10 mL含体积分数10% FBS、25 μg/L M-CSF的α-MEM培养基重悬细胞,接种于100 mm培养皿,置于体积分数5% CO2培育箱,37℃培养过夜(约16 h);收集未贴壁细胞,作为BMMs,接种于不同培养板,用α-MEM培养基(含25 μg/L M-CSF和10% FBS)培养3 d,去除未贴壁细胞,贴壁细胞为OC前体细胞(osteoclast precursor cells,OCPs)。
1.4 破骨细胞的诱导和鉴定OCPs用含25 μg/L M-CSF、50 μg/L RANKL和10% FBS的α-MEM培养基诱导6 d形成OC。按抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒说明书染色,显微镜观察,含有3个以上细胞核的TRAP阳性多核细胞视为OC。PBS反复冲洗骨细胞培养板至细胞脱落,倒置显微镜观察、拍摄骨吸收陷窝,计算面积。
1.5 β-catenin siRNA转染细胞BMMs在含25 μg/L M-CSF的α-MEM培养基中培养2 d,诱导成OCPs后转染处理(图1)。准备4支无菌EP管,其中2支各加入3.75 μL Lipofectamine®3000转染试剂,再加入Opti-MEM®培养基使总体积至125 μL;另外2支分别加入4 μL的10 μmol/L negative control-siRNA(NC-siRNA)和4 μL的10 μmol/L β-catenin siRNA,再加入Opti-MEM®培养基使总体积至125 μL;将稀释完成的2支Lipofectamine®3000转染试剂分别与稀释完成的NC-siRNA和β-catenin siRNA充分混合均匀,孵育5 min。
将孵育好的含有siRNA和转染试剂的Opti-MEM®培养基按照体积比1∶7混入a-MEM培养基(含25 μg/L M-CSF)转染24 h,以此为OC形成起点(0 d),使用25 μg/L M-CSF和50 μg/L RANKL在有或无10-8mol/L 1a,25-(OH)2D3的条件下处理细胞(图1),2 d换液1次。
图1 细胞转染及1α,25-(OH)2D3处理时间示意图 黑色实线代表M-CSF;蓝色实线代表M-CSF+NC siRNA;蓝色虚线代表M-CSF+β-catenin siRNA;红色实线代表M-CSF+RANKL;红色虚线代表M-CSF+RANKL+1α,25-(OH)2D3
1.6 总蛋白提取和Western blot检测OCPs使用25 μg/L M-CSF及50 μg/L RANKL培养基诱导形成OC,处理组额外添加10-8mol/L 1,25-(OH)2D3处理3 d收集细胞。用含蛋白酶抑制剂的RIPA裂解液冰上裂解,提取总蛋白,BCA法检测蛋白浓度,调整蛋白浓度一致,依体积加入5×Loading buffer(1∶4),95℃变性10 min,-70℃冰箱储存备用。
蛋白样品凝胶电泳(SDS-PAGE),每孔10~20 μL(20~40 g),恒压100 V,90 min,采用湿转法将蛋白从SDS-PAGE胶转移至NC膜,转膜条件为恒流260 mA,90 min。5%脱脂乳的TBST室温封闭2 h,一抗4℃摇床孵育过夜,TBST洗脱3次,每次10 min,辣根过氧化物酶(HRP)标记的二抗常温孵育90 min,TBST洗脱3次,每次10 min,ECL法检测NC膜,化学发光成像分析系统获取曝光结果,软件分析条带灰度值。
1.7 qRT-PCR 检测 OC 形成相关基因的表达同1.6诱导OC形成,10-8mol/L 1,25-(OH)2D3处理3 d用Trizol法提取总RNA,NanoDrop 2000测定RNA浓度和纯度(A260/A280比值)。按反转录试剂盒进行反转录,得到对应的cDNA,稀释后-70℃保存。以cDNA为模板,使用荧光定量试剂盒进行 qRT-PCR 反应。反应体系为:2×ChamQ SYBR qPCR Master Mix 10 μL、上下游引物(10 μmol/L) 各0.4 μL、 50×ROX Reference Dye 0.4 μL、 cDNA 模板 2 μL,加无RNA酶水至20 μL。qRT-PCR扩增采用两步法,循环反应设置为95℃ 10 s;60℃ 30 s,40个循环。内参为GAPDH,采用 2-△△CT法对 qRT-PCR 结果进行数据分析,引物见表1。

表1 目的基因引物序列
2 结果
2.1 1α,25-(OH)2D3抑制TRAP阳性OC形成及骨吸收活性TRAP染色结果显示,OCPs诱导6 d对照组可形成TRAP染色阳性的多核OC(图2A,实心箭头),添加1α,25-(OH)2D3组TRAP阳性多核OC极显著减少(P<0.01)(图2A,B)。

图2 OC染色(A)及计数(B) 注:与对照组比较,**P<0.01。下图同
骨吸收馅窝结果显示,OCPs诱导6 d对照组OC可在骨吸收培养板上形成大量吸收馅窝,添加1α,25-(OH)2D3组吸收馅窝数量减少(图3A,空心箭头),骨吸收面积极显著小于对照组(P<0.01)(图3B)。
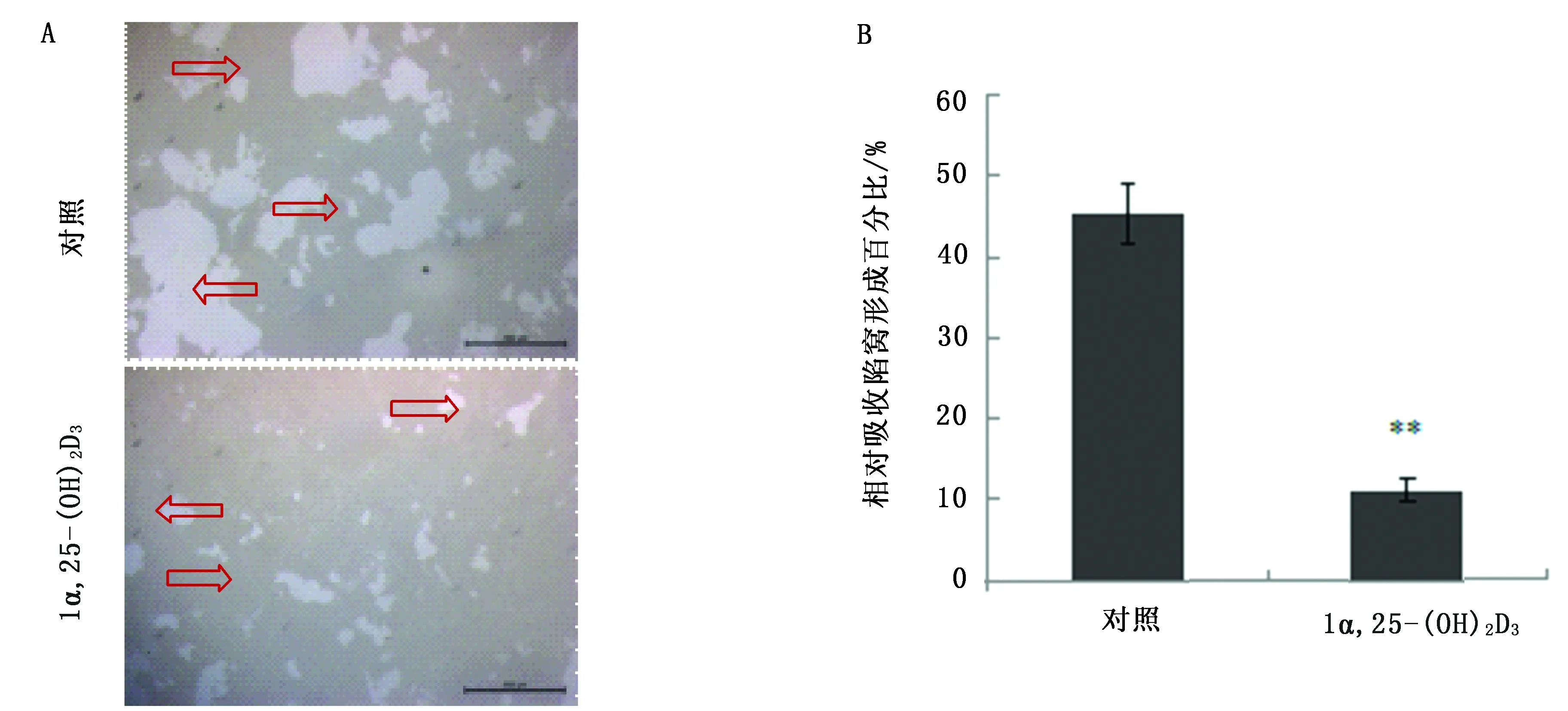
图3 骨吸收馅窝(A)及面积分析(B)
2.2 1α,25-(OH)2D3上调OC形成过程中Ctnnb1 mRNA表达qRT-PCR结果(图4)显示,在RANKL诱导OC分化过程中Ctnnb1 mRNA表达水平先增高后降低,与0 d相比,分化1 d极显著升高(P<0.01),3 d极显著降低(P<0.01)。图5显示,RANKL诱导OC分化的同时,添加1α,25-(OH)2D3处理3 d极显著上调Ctnnb1 mRNA表达水平(P<0.01)。
2.3 敲低β-catenin对1α,25-(OH)2D3调控OC形成的影响转染β-catenin siRNA与NC-siRNA相比可极显著增加OC形成的数量(P<0.01)。转染NC-siRNA或者β-catenin siRNA再添加1α,25-(OH)2D3均可极显著减少OC形成的数量(P<0.01),1α,25-(OH)2D3处理的NC-siRNA和β-catenin siRNA两组间OC数量差异不显著(P>0.05)(图6)。
2.4 敲低β-catenin对1α,25-(OH)2D3调控MMP-9蛋白表达的影响转染NC-siRNA,添加1a,25-(OH)2D3可显著上调B-catenin蛋白表达(P<0.01),同时极显著抑制骨吸收相关蛋白MMP-9的表达(P<0.01)(图7)。

图6 敲低β-catenin对1α,25-(OH)2D3抑制OC形成数量的影响 A.TRAP染色(400 μm);B.OC数量统计图
转染β-catenin siRNA后β-catenin蛋白表达极显著下调,而骨吸收相关蛋白MMP-9表达显著上调(P<0.05)。转染β-catenin siRNA组,添加1α,25-(OH)2D3仍可极显著下调MMP-9蛋白表达(P<0.01)。转染NC-siRNA和β-catenin siRNA后,分别添加1α,25-(OH)2D3处理,两者MMP-9蛋白表达差异并不显著(P>0.05)。
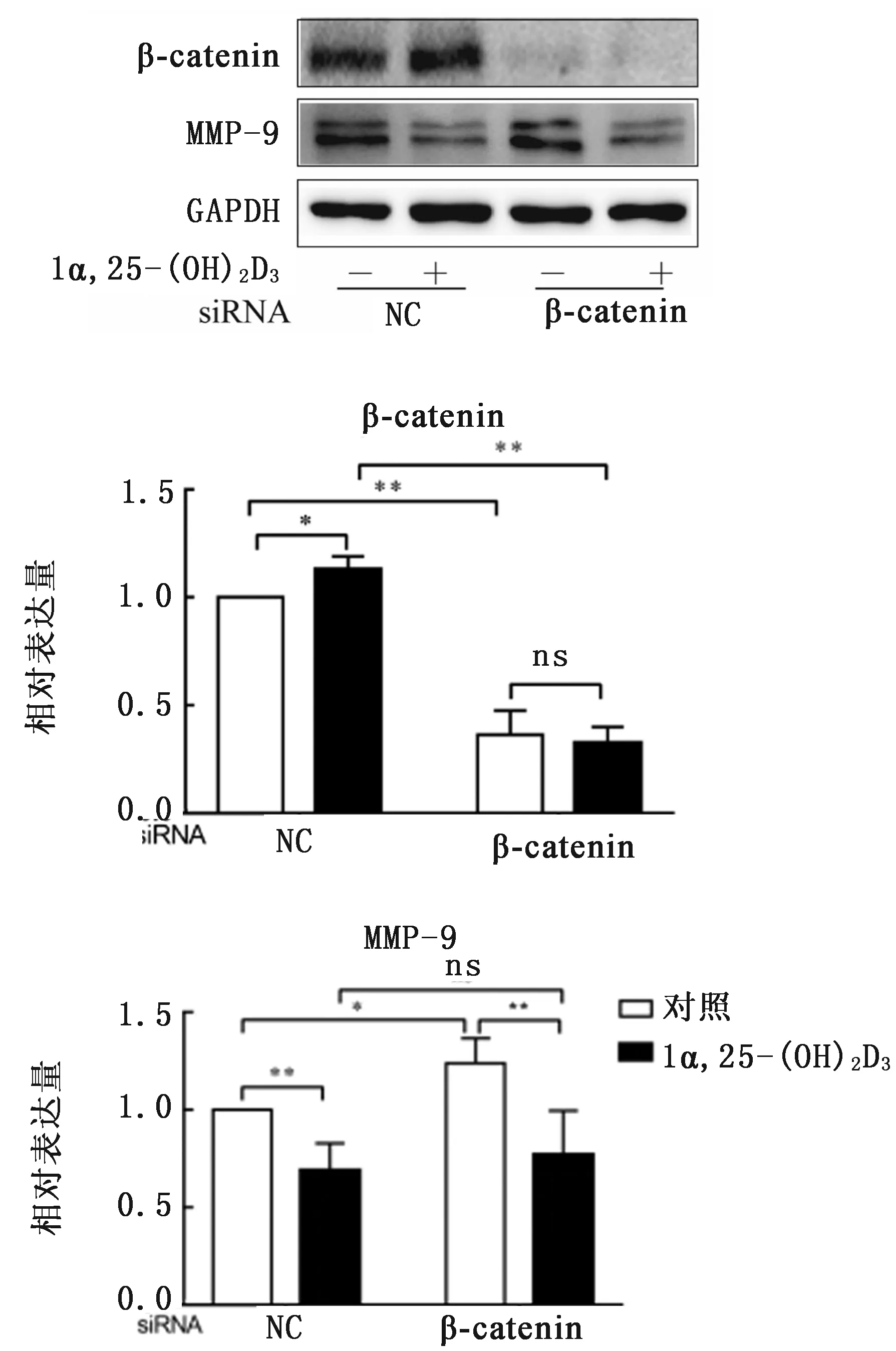
图7 敲低β-catenin对1α,25-(OH)2D3调控OC相关蛋白表达的影响
2.5 敲低β-catenin对1α,25-(OH)2D3调控Nfatc1 mRNA的影响转染NC-siRNA,添加1α,25-(OH)2D3极显著抑制了激活T-细胞核因子1(nuclear factor of activated T cells,cytoplasmic 1,NFATc1) mRNA表达(P<0.01),显著上调了Ctnnb1 mRNA表达(图8)。
转染b-catenin siRNA组Ctnnb1 mRNA表达极显著降低(P<0.05),添加1a,25-(OH)2D3仍可极显著抑制Nfatc1 mRNA表达(P<0.01)。转染NC-siRNA和b-catenin siRNA后,分别添加1a,25-(OH)2D3处理,两者Nfatc1 mRNA表达差异不显著(P>0.05)。

图8 敲低β-catenin对1α,25-(OH)2D3调控OC相关mRNA表达的影响
3 讨论
骨组织集中了体内约99%的钙,不仅可以作为机体的支架,在维持血液钙磷平衡中也十分重要[9]。骨细胞中的OB主要负责骨骼的形成和矿化,而OC主要负责骨骼有机质和无机质的溶解[10-11]。除了OB以外,OC在骨骼代谢以及血液钙磷平衡中同样发挥着不容忽视的作用。OC数量过少,活性过低可导致骨硬化症,甚至血液钙离子浓度降低;OC数量过多,活性过高则可导致骨骼溶解,引起骨质疏松和血液钙离子浓度升高[12]。维生素D常被用来预防佝偻病,治疗骨质疏松症,但其副作用可致血液钙离子浓度升高。生理及治疗剂量维生素D可以促进肠道钙磷吸收,促进OB分化和骨形成,抑制OC分化;而过量维生素D则可促进OB表达膜结合型RANKL,促进OC形成和骨溶解[13]。因此,体外OB和BMMs共培养体系中,维生素D活性形式1α,25-(OH)2D3能够促进OC形成;而小鼠BMMs单独培养时,1α,25-(OH)2D3调控OC形成的作用仍不十分清楚。本研究显示,1α,25-(OH)2D3能够抑制体外小鼠BMMs单独培养体系中TRAP阳性OC的形成,抑制其骨吸收活性,与ITONAGA等[14]报道单独添加1α,25-(OH)2D3可抑制人外周血单核细胞形成OC一致。
Wnt信号通路是一个复杂的蛋白质作用网络,其功能最常见于胚胎发育和癌症,但也参与成年动物的正常生理过程。Wnt信号通路包括经典Wnt通路、非经典Wnt/平面细胞极化通路和非经典Wnt/钙离子通路。β-catenin是经典Wnt信号的关键组成元素,是骨骼形成和发育的重要因子。在骨折修复早期,β-catenin是多能间充质细胞向OB或软骨细胞分化所必需的调节因子[15]。GLASS等[16]研究表明,Wnt/β-catenin信号能够直接调控骨形成OB活性,间接调控骨吸收OC活性,在维持骨量中不可或缺。但关于其在OC分化中的作用报道较少。本研究显示,OC分化过程中β-catenin基因Ctnnb1 mRNA表达先升高后降低,分化第3天 Ctnnb1 mRNA表达极显著(P<0.01)低于未分化组(0 d),表明OC分化过程中Ctnnb1 mRNA表达下降。分化过程中,1α,25-(OH)2D3处理3 d极显著(P<0.01)上调了Ctnnb1 mRNA表达,提示β-catenin可能参与1α,25-(OH)2D3调控OC形成。敲低β-catenin基因(Ctnnb1)后Ctnnb1 mRNA和β-catenin蛋白表达均极显著(P<0.01)低于对照组,表明成功敲低β-catenin基因。敲低β-catenin,TRAP阳性OC形成数量极显著(P<0.01)增加,MMP-9蛋白和Nfatc1 mRNA表达均极显著(P<0.01)高于对照组(NC)。MMP-9是成熟OC的主要标志之一[17-18],它能够有效降解Ⅰ型和Ⅱ型胶原酶等有机骨基质[19],常被用于成熟OC标志的检测。NFATc1是OB、OC以及T细胞等分化的重要转录因子,尤其在RANKL诱导的OC分化中可上调多种基因表达,在OC分化、迁移、黏附、骨有机和无机质的吸收中发挥关键作用,亦常被用于OC分化的鉴定[20]。说明,敲低β-catenin能够促进OC形成。然而,敲低β-catenin基因后再添加1α,25-(OH)2D3仍可极显著(P<0.01)抑制TRAP阳性OC的形成,MMP-9蛋白和Nfatc1 mRNA的表达,与未敲低β-catenin组(NC)相比无明显差异。以上结果表明,β-catenin能够抑制体外培养小鼠OC形成,但对1α,25-(OH)2D3抑制OC形成无影响。1α,25-(OH)2D3可能通过β-catenin以外的信号调控OC形成,具体仍需进一步研究。
综上所述,β-catenin能够抑制体外培养小鼠OC形成,但对1α,25-(OH)2D3抑制OC形成无影响。

