山东部分地区猪瘟病毒分离鉴定及E2基因遗传进化分析
焦秋林,姜子昕,孟凡亮,曹龙龙,李 焱,杨玉栋,佟 泽,刘思当
(山东农业大学 动物科技学院,山东 泰安 271018)
猪瘟(classicai swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)感染猪引起的一种急性败血症性传染病,具有高度传染性,流行范围广,是猪病中危害最大、最受重视的疾病之一[1]。CSFV会引起猪的出血性败血症,病猪临床表现高热、呕吐、精神沉郁和食欲废绝,后期伴有腹泻。妊娠期母猪感染CSFV会导致死胎、弱仔或木乃伊胎。CSFV虽然只有一个血清型,但是近年来基因变异加快,根据CSFV的E2和NS5B基因的部分区段,可分为3个基因型和10个基因亚型[2-5]。随着高效CSF疫苗的应用与普及,使我国猪群一度得到良好的免疫保护。但近年来时有免疫猪群发生CSF疫情的报道,对分离CSFV E2基因部分编码序列的分析表明,近年来我国CSFV流行毒株发生向远离疫苗株的方向变异[6]。随着CSF疫苗的长时间、广泛使用,可能会促使流行毒株发生遗传变异,导致猪群免疫效果不佳,免疫猪群发生CSF疫情并引起高病死率,造成重大经济损失。
E2基因是CSFV的主要免疫原性结构基因,基因序列的变异率相对较高,是CSFV中变异性最大的基因之一。位于E2基因5′端的190 bp片段属于高变区,也是国际对CSFV常用分型区域。CSFV基因组能够翻译3 898个氨基酸,可形成12种蛋白质,其中4种为结构蛋白,E2蛋白就属于结构蛋白之一,E2蛋白又称gp55,它能够刺激机体产生中和抗体,集中了 CSFV 的大部分主要抗原表位[6-9 ]。E2蛋白是CSFV识别、吸附宿主细胞的直接参与者。研究E2基因的遗传演化是直接反应CSFV毒力变化的有效工具。
1 材料与方法
1.1 病料来源23份病料(肺脏、肝脏、脾脏、肾脏、淋巴结、扁桃体)分别采集于山东各地疑似CSF的临床病例,其中泰安5份、济宁4份、莱芜4份、德州3份、菏泽3份、聊城2份、淄博1份、潍坊1份,发病猪场均按照常规免疫程序进行了CSF疫苗免疫。
1.2 试验材料Simply P 病毒DNA/RNA提取试剂盒购自杭州博日科技有限公司;琼脂糖凝胶DNA回收试剂盒购自北京天根生化科技有限公司;HiScript One Step RT-PCR Kit(Dye Plus)购自南京诺唯赞生物科技有限公司;DMEM/HIGH GLUCOSE购自赛默飞世尔科技(中国)有限公司;T1 载体及 T1 感受态细胞均购自北京全式金生物技术有限公司;胰蛋白酶-EDTA 消化液等购自北京索莱宝科技有限公司;PK-15细胞由本实验室冻存; ELISA试剂盒购自北京金诺联合科技有限公司。
1.3 引物设计根据GenBank中登录的CSFV的E2全基因序列,利用引物设计软件Primer Premier 5.0设计2对引物,用于扩增E2部分基因(鉴别引物)与全基因(全长引物)序列,引物由生工生物工程(上海)股份有限公司合成(表1)。
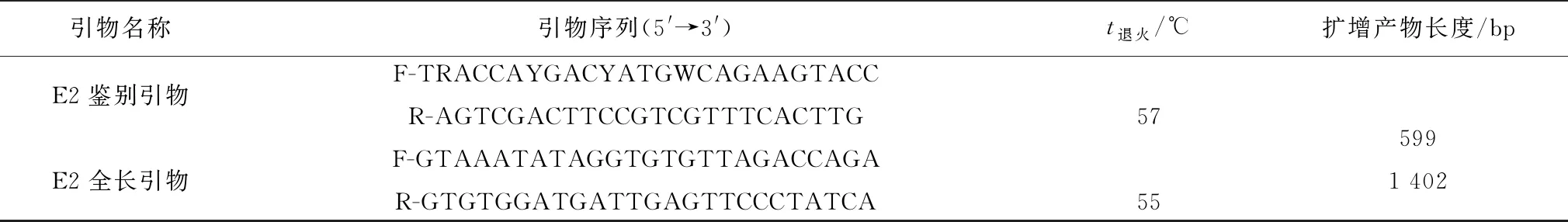
表1 引物序列
1.4 莱芜病猪样品采集及处理剖检病猪,采集肾脏、肝脏、脾脏、大脑、淋巴结和扁桃体,其中1份取适量病料放入液氮中保存;另1份用10%福尔马林溶液固定,用于组织病理学检查。
1.5 组织病理学检查取出固定于10%福尔马林溶液的组织,常规制作石蜡切片,HE染色。
1.6 病原检测参考梅小伟等[8]CSFRT-PCR检测方法,将保存于液氮中的23份疑似CSF病料与莱芜病猪病料解冻后每份各取适量并加入灭菌的PBS,研磨成匀浆,放于液氮中反复冻融3次。匀浆于4℃离心机9 000 r/min离心5 min,取上清使用 Simply P 病毒DNA/RNA提取试剂盒(批号:BSC67M1)提取核酸。以提取核酸为模板,使用HiScript One Step RT-PCR Kit(Dye Plus)(批号:L/N 7E290K8)体系加样,用E2鉴别引物经RT-PCR扩增后,将扩增产物于1.5%琼脂糖凝胶中电泳,使用紫外成像系统鉴别样品目的条带(图1)。
1.7 病毒培养与分离将1.5鉴别为CSFV阳性的样品研磨液上清通过0.22 μm滤器过滤后,用DMEM稀释10倍,接种于生长密度为70%单层PK-15细胞培养瓶中,连续盲传3代,收取带毒细胞,于-80℃反复冻融3次,同1.5步骤提取核酸,加入全长引物扩增,扩增产物于0.8%琼脂糖凝胶中电泳,紫外成像系统成像全长样品目的条带。将目的条带切下,利用胶回收试剂盒纯化核酸,连接T1载体,转化T1感受态细胞,将鉴别为阳性菌的样品送至上海生工生物科技有限公司进行测序,利用DNAStar软件将分离株与20株参考株(表2)进行核苷酸和推导氨基酸序列比对分析,构建遗传进化树,比对分离株与参考株亲缘关系的远近。
表2 E2基因参考毒株
2 结果
2.1 临床剖检剖检莱芜送检病猪可见肾脏表面有大量出血点(图1A);淋巴结严重充血肿胀(图1B);回盲瓣黏膜溃疡(图1C);扁桃体溃疡(图1D);膀胱黏膜有出血点(图1E);脾脏边缘见出血性梗死灶(图1F)。
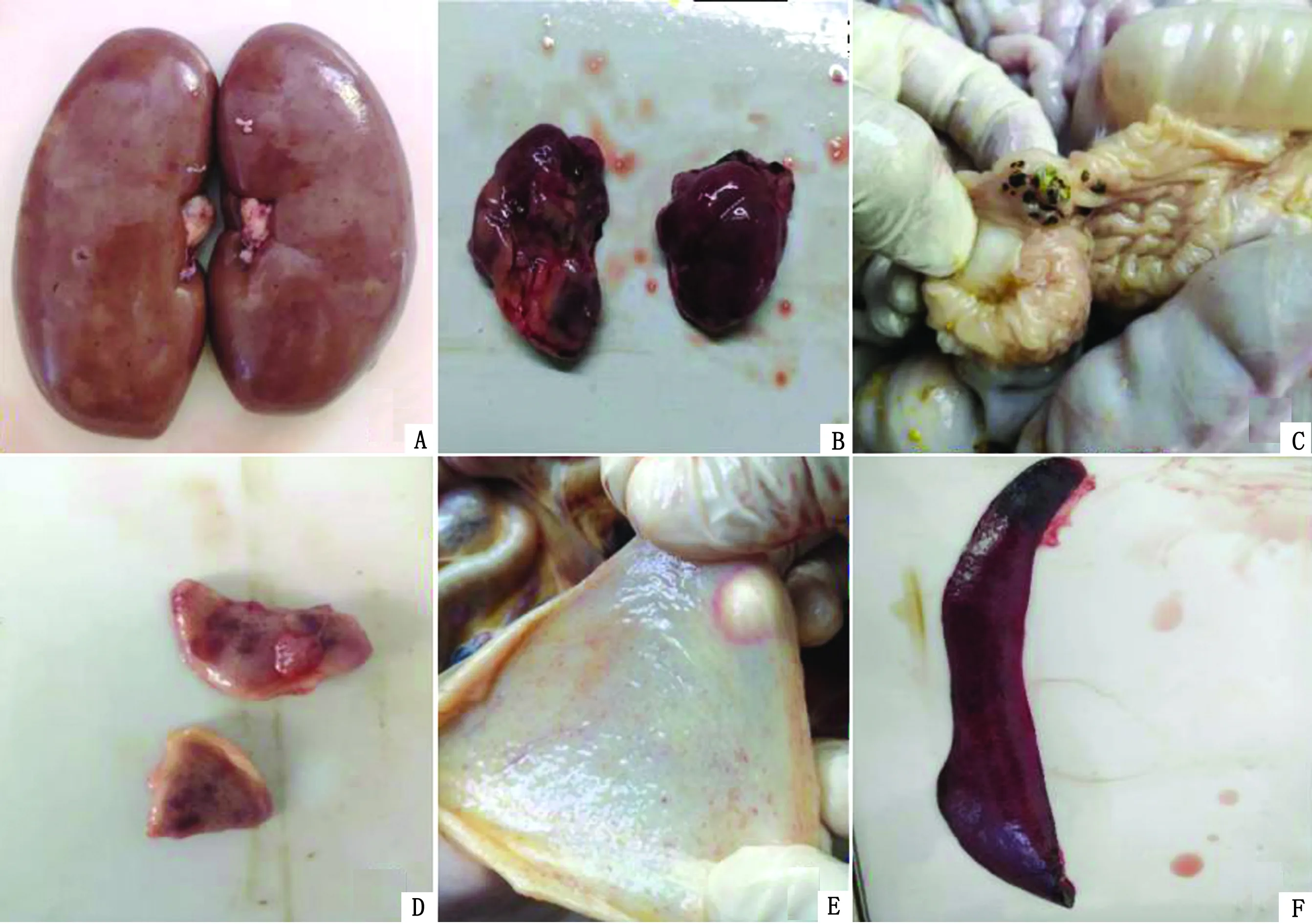
图1 病猪临床剖检病变 A.肾脏;B.淋巴结;C.回盲瓣黏膜;D.扁桃体;E.膀胱;F.脾脏
2.2 病理组织学检查镜检病理切片可见,肾小管上皮细胞变性坏死,肾间质出血(图2A);淋巴结充血、出血,淋巴细胞坏死(图2B);回盲瓣淋巴滤泡出血性坏死(图2C);扁桃体黏膜上皮细胞坏死、脱落,淋巴组织坏死,隐窝内充满坏死物(图2D);膀胱黏膜固有层充血、出血(图2E);脾脏充血,淋巴细胞坏死(图2F)。

图2 镜检病变 A.肾脏;B.淋巴结;C.回盲瓣淋巴滤泡;D.扁桃体;E.膀胱黏膜;F.脾脏
2.3 病毒检测结果通过鉴别引物RT-PCR扩增,莱芜送检病猪CSFV检测阳性(图3),23份疑似CSF病料中有17份阳性(图4)。
2.4 病毒培养及鉴定将18份阳性病料研磨液经过0.22 μm滤器过滤后,用DMEM稀释10倍,接种于生长密度为70%单层PK-15细胞培养瓶中,连续盲传3代,收取带毒细胞,于-80℃反复冻融3次,通过CSFV全长引物RT-PCR扩增结果显示15份细胞病毒液检测为阳性(图5),并将15株分离毒株进行命名(表3)。
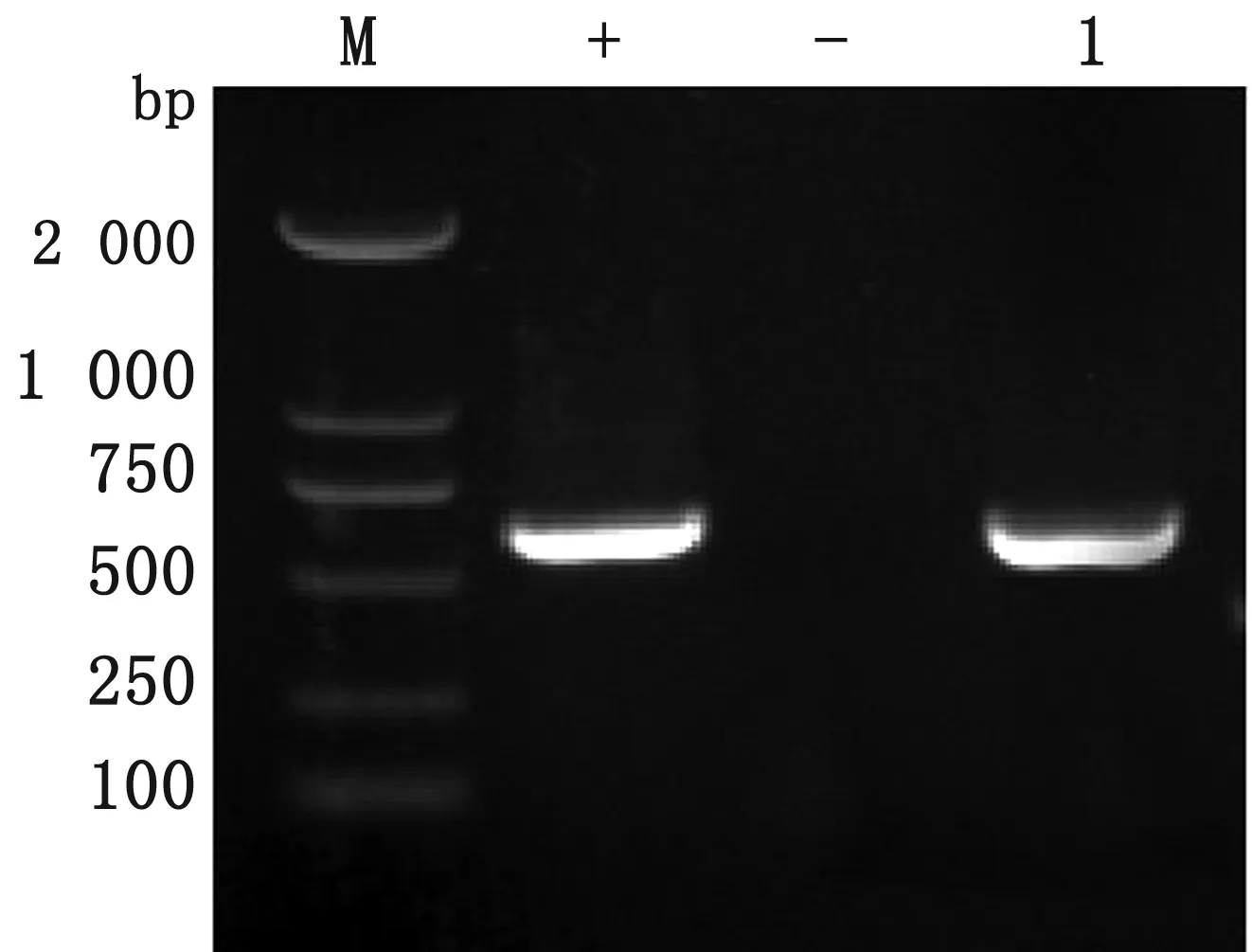
图3 莱芜病猪RT-PCR检测结果 M.DL2000 DNA Marker;+.阳性对照;-.阴性对照;1.检测样品
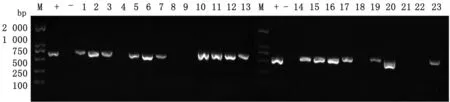
图4 23份疑似CSF病料RT-PCR检测结果 M.DL2000 DNA Marker;+.阳性对照;-.阴性对照;1~23.检测样品
2.5 分离株与参考株的核苷酸和推导氨基酸序列分析分离的15株CSFV间的核苷酸与推导氨基酸的同源性分别为97.0%~99.9%和97.1%~100.0%,分离株与参考株间的核苷酸与推导氨基酸的同源性分别为81.9%~97.4%和88.7%~99.7%。分离株与2.1d亚型同源性最高,并且与2.1b 亚型的同源性均高于2.1a和2.1c亚型,表明与2.1d和2.1b 亚型具有较高的相似性[10]。
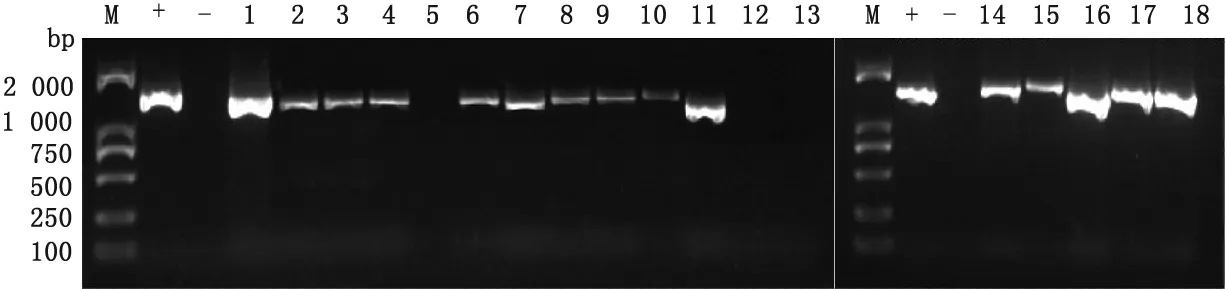
图5 E2基因RT-PCR扩增结果 M.DL2000 DNA Marker;+.阳性对照;-.阴性对照;1~18.检测样品
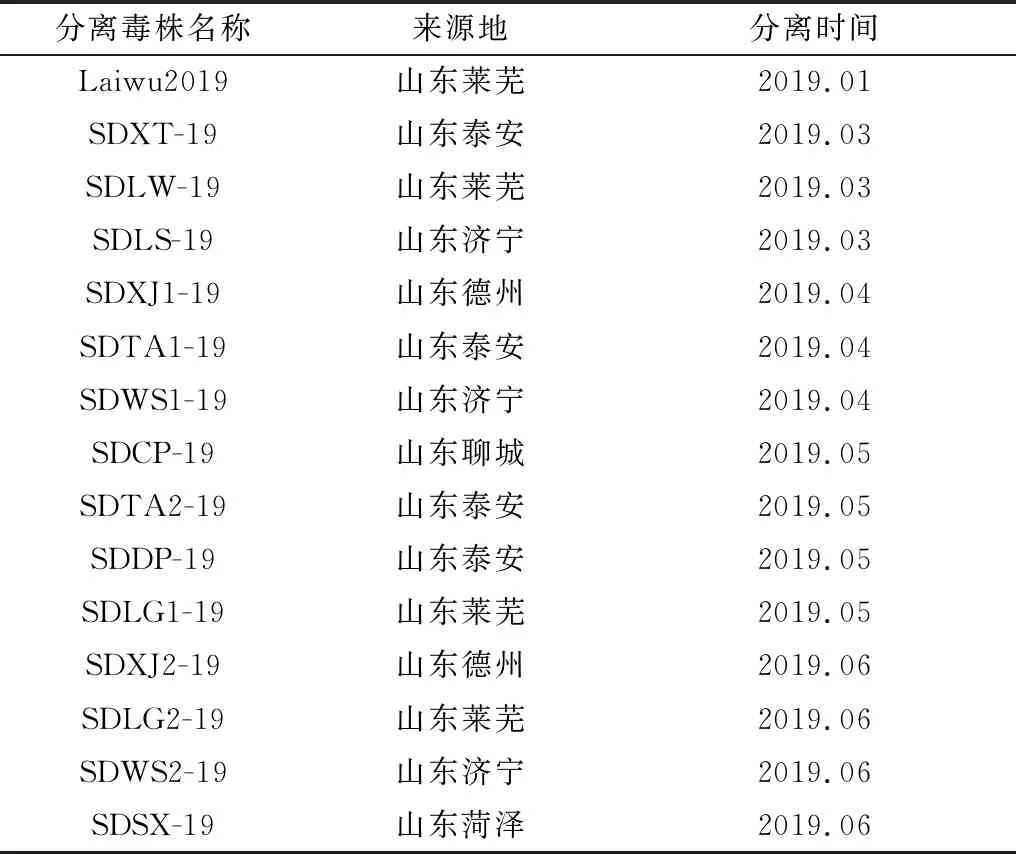
表3 CSFV分离毒株
2.6 CSFV分离株E2基因推导氨基酸序列比对通过与Shimen株糖基化位点分析,分离株仅在“986NYAK-NYTK989”处发生突变,与本实验室2018年分离株的突变一致;通过抗原表位分析发现,分离毒株与Shimen株比较,15株分离株在抗原表位“717TTWKEYSH724”发生“K720R”突变,在“771LLFDGTNP778”处发生“N777S”突变,Laiwu2019同时发生“G775T”突变;在抗原表位“829TAVSPTTLR837”处,SDCP-19株发生“S832C”突变,其他抗原表位未发生突变。
2.7 分离株E2基因的遗传进化分析15株分离株的E2基因与20株参考株进行核苷酸比较,利用MEGA6的Maximum-Likehood方法构建进化树(图6)。通过进化树分析,2019年上半年从山东省部分地区分离的15株CSFV与参考株EF683606 HuZ2-05 2.1d、JQ001834 SDQS11 2.1d变异株亲缘关系最近,与石门珠亲缘关系较远,分离株仍属于2.1d分支,但处于相对独立的1个大分支,表明分离株属于变异株。

图6 分离株与参考株E2基因进化树分析 □代表所得分离株
3 讨论
CSFV对猪免疫系统的实质细胞具有特殊嗜性,导致感染细胞坏死并诱导周边未感染细胞凋亡,外周血B淋巴细胞与T淋巴细胞数量减少[1],严重损坏猪的免疫系统及造血功能,并造成中枢神经感染,因此CSFV 感染任何阶段的猪都会造成较高的病死率。CSFV广泛流行于世界各地,在我国更是广泛存在,是我国乃至世界的最重要的猪传染病之一。
通过对山东省部分地区23份CSF疑似病例检测分析,2019年上半年共分离到15株CSFV,对分离株与参考株的核苷酸和推导氨基酸的同源性对比分析发现,分离的15株CSFV间的核苷酸与推导氨基酸的同源性分别为97.0%~99.9%和97.1%~100.0%,分离株与参考株间的核苷酸与推导氨基酸的同源性分别为81.9%~97.4%和88.7%~99.7%。
通过糖基化位点与抗原表位分析可知,糖基化位点“986NYAK-NYTK989”的突变会改变毒株E2蛋白相对分子质量,推断是在CSF疫苗普遍使用的大背景下,CSF野毒与疫苗株HCLV发生了重组后可能导致疫苗保护力下降,CSFV的毒力变化还需进一步研究。抗原表位“717TTWKEYSH724”对A11识别功能的核心氨基酸位“WKH”[9],该位点的突变对E2蛋白的影响需进一步研究;在“771LLFDGTNP778”处发生突变对E2蛋白和CSFV的影响需进一步研究;抗原表位“829TAVSPTTLR837”在CSFV各亚型中高度保守,起到鉴别CSFV的作用,该位点的突变产生的影响也需后续研究证明。
通过遗传进化树分析,分离株位于相对独立的一支,与近几年2.1d亚型变异株遗传关系较近。这说明,山东省部分地区所感染CSFV存在变异,可为CSF疫苗的研发与选择提供理论依据。
防制传染病的感染与流行应坚持“防”大于“制”的原则,在世界范围内发生CSF疫情时采取封锁、持续扑杀以达到净化CSF的国家仅占少数,大多数CSF流行的国家和地区仍是采取CSF疫苗免疫,通过疫苗接种可大幅度降低CSFV的感染率及发病死亡率,并协助CSF的净化,保证养猪业的健康发展。在猪饲养过程中应严格遵守猪场生物安全措施和免疫程序,猪场可采取全进全出制,方便统一管理和预防。禁止场内外人员车辆随意进出,健全消毒措施,做好饲养过程中对猪群的保健工作,合理使用抗生素可有效防止猪的细菌感染,提高免疫力。自繁自养场仔猪25和65日龄分别接种ST细胞苗,若哺乳仔猪有CSF发生,可考虑超免,后备母猪配种前45 d接种CSFST细胞苗,经产母猪产后20 d接种CSFST细胞苗。对育肥猪接种疫苗时可将剂量控制在国家推荐量的3倍左右,不可剂量过大,对于疫苗的选用要保证疫苗的高效性,避免疫苗失效及免疫人员的接种失误[11]。人们期待针对CSFV变异毒株的高效疫苗,伴随近几年分子生物学的快速发展,CSF疫苗的更新研发与高效疫苗的生产一定会有较大的突破。

